ХАРТИЛ® РОЗ
-
Угорщина ЗАТ Фармацевтичний завод ЕГІСФорма выпуска: капсули тверді по 10 мг/10 мг, по 10 капсул у блістері; по 3 блістери у картонній коробціСостав: 1 капсула містить: 1 таблетку, що містить 10,42 мг розувастатину кальцію (що еквівалентно 10 мг розувастатину), та 1 таблетку, що містить 10 мг раміприлуУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/20982/01/03код АТХ: C10BX17Срок годности: 3 роки
-
Угорщина ЗАТ Фармацевтичний завод ЕГІСФорма выпуска: капсули тверді по 10 мг/5 мг, по 10 капсул у блістері; по 3 блістери у картонній коробціСостав: 1 капсула містить: 1 таблетку, що містить 10,42 мг розувастатину кальцію (що еквівалентно 10 мг розувастатину), та 1 таблетку, що містить 5 мг раміприлуУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/20982/01/02код АТХ: C10BX17Срок годности: 3 роки
-
Угорщина ЗАТ Фармацевтичний завод ЕГІСФорма выпуска: капсули тверді по 20 мг/10 мг, по 10 капсул у блістері; по 3 блістери у картонній коробціСостав: 1 капсула містить: 1 таблетку, що містить 20,84 мг розувастатину кальцію (що еквівалентно 20 мг розувастатину), та 1 таблетку, що містить 10 мг раміприлуУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/20982/01/01код АТХ: C10BX17Срок годности: 3 роки
-
Угорщина ЗАТ Фармацевтичний завод ЕГІСФорма выпуска: капсули тверді по 20 мг/5 мг, по 10 капсул у блістері; по 3 блістери у картонній коробціСостав: 1 капсула містить: 1 таблетку, що містить 20,84 мг розувастатину кальцію (що еквівалентно 20 мг розувастатину), та 1 таблетку, що містить 5 мг раміприлуУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/20982/01/04код АТХ: C10BX17Срок годности: 3 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ХАРТИЛ® РОЗ
(HARTIL® ROZ)
Склад:
діючі речовини: розувастатин, раміприл;
1 капсула містить:
1 таблетку, що містить 10,42 мг розувастатину кальцію (що еквівалентно 10 мг розувастатину), та 1 таблетку, що містить 5 мг раміприлу,
або 1 таблетку, що містить 10,42 мг розувастатину кальцію (що еквівалентно 10 мг розувастатину), та 1 таблетку, що містить 10 мг раміприлу,
або 1 таблетку, що містить 20,84 мг розувастатину кальцію (що еквівалентно 20 мг розувастатину), та 1 таблетку, що містить 5 мг раміприлу,
або 1 таблетку, що містить 20,84 мг розувастатину кальцію (що еквівалентно 20 мг розувастатину), та 1 таблетку, що містить 10 мг раміприлу;
допоміжні речовини:
для таблетки розувастатину кальцію:
целюлоза силікатизована мікрокристалічна, магнію стеарат (Е 572), кремнію діоксид колоїдний безводний (Е 551);
для таблетки раміприлу:
целюлоза мікрокристалічна РН 102 FMC, кросповідон типу В, гіпромелоза 2910, 3 сР, натрію стеарилфумарат, кремнію діоксид колоїдний гідрофобний R972, заліза оксид жовтий (E 172) Cl 77492, вода очищена;
склад капсули 10 мг/5 мг:
титану діоксид (Е 171), заліза оксид червоний (E 172), заліза оксид жовтий (E 172), заліза оксид чорний (E 172), желатин;
склад капсули 10 мг/10 мг:
титану діоксид (Е 171), заліза оксид червоний (E 172), заліза оксид жовтий (E 172), желатин;
склад капсули 20 мг/5 мг:
титану діоксид (Е 171), заліза оксид червоний (E 172), заліза оксид чорний (E 172), желатин;
склад капсули 20 мг/10 мг:
титану діоксид (Е 171), заліза оксид червоний (E 172), желатин.
Лікарська форма. Капсули тверді.
Основні фізико-хімічні властивості:
Капсули тверді по 10 мг/5 мг
Тверді
желатинові
капсули типу
Coni Snap, самозакривні,
розміром 2,
кришка та
корпус
капсули без
маркування,
корпус
капсули
майже білого
кольору та
кришка
капсули
цегляно-червоного
кольору, що
містять дві
таблетки:
одну круглу,
двоопуклу
таблетку
розувастатину
10 мг, білого
або майже
білого
кольору, без
або майже без
запаху, зі
стилізованим
маркуванням 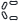 з
одного боку,
без позначки
з іншого
боку; одну
круглу,
двоопуклу
таблетку
раміприлу 5
мг,
блідо-жовтого
кольору, на
поверхні
таблеток
допускаються
плями білого
та
жовтувато-коричневого
кольору, без
або майже без
запаху, без
маркування з
обох боків.
з
одного боку,
без позначки
з іншого
боку; одну
круглу,
двоопуклу
таблетку
раміприлу 5
мг,
блідо-жовтого
кольору, на
поверхні
таблеток
допускаються
плями білого
та
жовтувато-коричневого
кольору, без
або майже без
запаху, без
маркування з
обох боків.
Капсули тверді по 10 мг/10 мг
Тверді
желатинові
капсули типу
Coni Snap, самозакривні,
розміром 0,
кришка та
корпус
капсули без
маркування,
корпус
капсули
рожевого
кольору та
кришка
капсули
цегляно-червоного
кольору, що
містять дві
таблетки:
одну круглу, двоопуклу
таблетку
розувастатину
10 мг, білого
або майже
білого
кольору, без
або майже без
запаху, зі
стилізованим
маркуванням 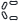 з
одного боку,
без позначки
з іншого
боку; одну
круглу,
двоопуклу
таблетку
раміприлу 10
мг,
блідо-жовтого
кольору, на
поверхні
таблеток
допускаються
плями білого
та
жовтувато-коричневого
кольору, без
або майже без
запаху, без
маркування з
обох боків.
з
одного боку,
без позначки
з іншого
боку; одну
круглу,
двоопуклу
таблетку
раміприлу 10
мг,
блідо-жовтого
кольору, на
поверхні
таблеток
допускаються
плями білого
та
жовтувато-коричневого
кольору, без
або майже без
запаху, без
маркування з
обох боків.
Капсули тверді по 20 мг/5 мг
Тверді
желатинові
капсули типу
Coni Snap, самозакривні,
розміром 0,
кришка та
корпус
капсули без маркування,
корпус
капсули
майже білого
кольору та
кришка
капсули
іржаво-коричневого
кольору, що
містять дві
таблетки:
одну круглу,
двоопуклу
таблетку
розувастатину
20 мг, білого
або майже
білого
кольору, без
або майже без
запаху, зі
стилізованим
маркуванням 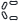 з
одного боку,
без позначки
з іншого
боку; одну
круглу,
двоопуклу
таблетку
раміприлу 5
мг,
блідо-жовтого
кольору, на
поверхні
таблеток
допускаються
плями білого
та жовтувато-коричневого
кольору, без
або майже без
запаху, без
маркування з
обох боків.
з
одного боку,
без позначки
з іншого
боку; одну
круглу,
двоопуклу
таблетку
раміприлу 5
мг,
блідо-жовтого
кольору, на
поверхні
таблеток
допускаються
плями білого
та жовтувато-коричневого
кольору, без
або майже без
запаху, без
маркування з
обох боків.
Капсули тверді по 20 мг/10 мг
Тверді
желатинові
капсули типу
Coni Snap, самозакривні,
розміром 0,
кришка та
корпус
капсули без маркування,
корпус
капсули
рожевого
кольору та
кришка
капсули
іржаво-коричневого
кольору, що
містять дві
таблетки:
одну круглу,
двоопуклу
таблетку
розувастатину
20 мг, білого
або майже
білого
кольору, без
або майже без
запаху, зі
стилізованим
маркуванням 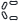 з
одного боку,
без позначки
з іншого
боку; одну
круглу,
двоопуклу
таблетку
раміприлу 10
мг,
блідо-жовтого
кольору, на
поверхні
таблеток
допускаються
плями білого
та жовтувато-коричневого
кольору, без
або майже без
запаху, без
маркування з
обох боків.
з
одного боку,
без позначки
з іншого
боку; одну
круглу,
двоопуклу
таблетку
раміприлу 10
мг,
блідо-жовтого
кольору, на
поверхні
таблеток
допускаються
плями білого
та жовтувато-коричневого
кольору, без
або майже без
запаху, без
маркування з
обох боків.
Фармакотерапевтична група. Гіполіпідемічні засоби, комбінації. Гіполіпідемічні засоби в поєднанні з іншими лікарськими засобами. Розувастатин та раміприл. Код АТХ C10B X17.
Фармакологічні властивості
Фармакодинаміка
Механізм дії
Розувастатин
Розувастатин − це селективний та конкурентний інгібітор ГМГ-КоА-редуктази, ферменту, що обмежує швидкість перетворення 3-гідрокси-3-метилглутарил-коензиму А в мевалонат, попередник холестерину. Основним місцем дії розувастатину є печінка, орган-мішень для зниження рівня холестерину.
Розувастатин збільшує кількість рецепторів ліпопротеїнів низької щільності (ЛПНЩ) на поверхні клітин печінки, посилюючи захоплення та катаболізм ЛПНЩ, та пригнічує печінковий синтез ліпопротеїнів дуже низької щільності (ЛПДНЩ), зменшуючи у такий спосіб загальну кількість ЛПДНЩ та ЛПНЩ.
Раміприл
Раміприлат, активний метаболіт проліків − раміприлу, є інгібітором ферменту дипептидилкарбоксипептидази І (синоніми: ангіотензинперетворювальний фермент; кіназа ІІ). У плазмі крові та тканинах цей фермент каталізує перетворення ангіотензину І на ангіотензин ІІ (активну судинозвужувальну речовину) та розщеплення активного вазодилататора брадикініну. Зменшення утворення ангіотензину II і пригнічення розщеплення брадикініну призводять до розширення судин.
Оскільки ангіотензин II також стимулює вивільнення альдостерону, раміприлат спричиняє зменшення секреції альдостерону. Реакція на монотерапію інгібіторами АПФ в середньому була менш вираженою у пацієнтів негроїдної раси (афро-карибського походження) з артеріальною гіпертензією (популяція, для якої характерний низький рівень реніну при артеріальній гіпертензії), ніж у пацієнтів, які є представниками інших рас.
Фармакодинамічна дія
Розувастатин
Розувастатин знижує підвищений рівень холестерину ЛПНЩ (ХС-ЛПНЩ), загального холестерину (ХС) та тригліцеридів і підвищує рівень холестерину ЛПВЩ (ХС-ЛПВЩ).
Він також знижує рівень аполіпопротеїну В (АпоВ), ХС-неЛПВЩ, ХС-ЛПДНЩ, тригліцеридів ЛПДНЩ (ТГ-ЛПДНЩ) та підвищує рівень АпоА-І (див. таблицю 1). Розувастатин також зменшує співвідношення ХС-ЛПНЩ/ХС-ЛПВЩ, загального ХС/ХС-ЛПВЩ, ХС-неЛПВЩ/ХС-ЛПВЩ та AпoB/AпoA-I.
Таблиця 1
Відповідь на дозу у пацієнтів із первинною гіперхолестеринемією типу ІІа та ІІb (відкоригована середня відсоткова зміна порівняно з вихідним рівнем)
|
Доза |
N |
ХС-ЛПНЩ |
Загальний ХС |
ХС-ЛПВЩ |
ТГ |
ХС-неЛПВЩ |
АпоВ |
АпоА-І |
|
Плацебо |
13 |
-7 |
-5 |
3 |
-3 |
-7 |
-3 |
0 |
|
5 |
17 |
-45 |
-33 |
13 |
-35 |
-44 |
-38 |
4 |
|
10 |
17 |
-52 |
-36 |
14 |
-10 |
-48 |
-42 |
4 |
|
20 |
17 |
-55 |
-40 |
8 |
-23 |
-51 |
-46 |
5 |
|
40 |
18 |
-63 |
-46 |
10 |
-28 |
-60 |
-54 |
0 |
Терапевтичний ефект досягається протягом 1 тижня після початку застосування препарату, 90 % максимального ефекту – через 2 тижні. Максимальний ефект зазвичай досягається через 4 тижні та триває надалі.
Раміприл
Антигіпертензивні властивості. Прийом раміприлу призводить до значного зниження периферичного артеріального опору. Як правило, значних змін ниркового плазмотоку або швидкості клубочкової фільтрації не відбувається. Призначення раміприлу пацієнтам з артеріальною гіпертензією призводить до зниження артеріального тиску як в горизонтальному, так і у вертикальному положенні хворого, що не супроводжується компенсаторним підвищенням частоти серцевих скорочень.
У більшості пацієнтів антигіпертензивний ефект настає через 1−2 години після перорального прийому разової дози препарату. Максимальний ефект після перорального прийому разової дози зазвичай настає через 3−6 годин. Антигіпертензивний ефект після прийому разової дози зазвичай зберігається протягом 24 годин.
При тривалому лікуванні із застосуванням раміприлу максимальний антигіпертензивний ефект досягається через 3−4 тижні. Доведено, що при довготривалій терапії антигіпертензивний ефект зберігається протягом 2 років.
Раптове припинення прийому раміприлу не спричиняє швидкого та надмірного підвищення артеріального тиску (феномен рикошету).
Серцева недостатність. Доведено, що застосований як доповнення до традиційної терапії діуретиками та, якщо необхідно, серцевими глікозидами раміприл є ефективним для пацієнтів із серцевою недостатністю ІІ−IV функціональних класів за NYHA. Раміприл виявляє сприятливий вплив на серцеву гемодинаміку (зниження тиску наповнення лівого і правого шлуночків, загального периферичного судинного опору, підвищення серцевого викиду і покращення серцевого індексу). Він також зменшує нейроендокринну активацію.
Клінічна ефективність та безпека
Розувастатин
Розувастатин ефективний у лікуванні дорослих із гіперхолестеринемією – із гіпертригліцеридемією або без неї – незалежно від раси, статі чи віку, а також пацієнтів особливих груп, таких як хворі на цукровий діабет або пацієнти із сімейною гіперхолестеринемією.
За об’єднаними даними досліджень фази ІІІ розувастатин ефективно знижував рівні холестерину у більшості пацієнтів із гіперхолестеринемією типу IIa та IIb (середній початковий рівень ХС-ЛПНЩ приблизно 4,8 ммоль/л) до цільових значень, встановлених визнаним керівництвом Європейського товариства атеросклерозу (EAS; 1998); приблизно у 80 % пацієнтів, які приймали препарат у дозі 10 мг, вдалося досягти нормативних цільових рівнів ХС-ЛПНЩ за EAS (< 3 ммоль/л).
У великому дослідженні 435 пацієнтів із гетерозиготною сімейною гіперхолестеринемією приймали розувастатин у дозах від 20 до 80 мг за схемою посиленого титрування дози. Сприятливий вплив на показники ліпідів та досягнення цільових рівнів відзначали при всіх дозах. Після титрування до добової дози 40 мг (12 тижнів лікування) ХС-ЛПНЩ знизився на 53 %. У 33 % пацієнтів було досягнуто нормативних рівнів ХС-ЛПНЩ за EAS (< 3 ммоль/л).
У відкритому дослідженні посиленого титрування доз відповідь на застосування розувастатину у дозах 20–40 мг вивчалася у 42 пацієнтів (включаючи 8 дітей) із гомозиготною сімейною гіперхолестеринемією. У загальній популяції рівень ХС-ЛПНЩ знизився в середньому на 22 %.
У клінічних дослідженнях за участю обмеженої кількості пацієнтів спостерігався адитивний ефект розувастатину на зниження рівня тригліцеридів при застосуванні у комбінації з фенофібратом та на підвищення рівнів ХС-ЛПВЩ при застосуванні у комбінації з ніацином (див. розділ «Особливості застосування»).
У багатоцентровому подвійно сліпому плацебо-контрольованому клінічному дослідженні (METEOR) 984 пацієнти віком 45–70 років із низьким ризиком ішемічної хвороби серця (визначеним як ризик за Фрамінгемською шкалою < 10 % протягом 10 років), середнім значенням ХС-ЛПНЩ 4,0 ммоль/л (154,5 мг/дл), але із субклінічним атеросклерозом (визначеним за збільшенням товщини комплексу інтима-медіа сонної артерії (ТКІМСА)) були рандомізовані до двох груп та приймали один раз на добу або 40 мг розувастатину, або плацебо протягом 2 років. Порівняно із плацебо розувастатин значно сповільнював прогресування максимальної ТКІМСА у 12 точках сонної артерії на -0,0145 мм/рік [95 % довірчий інтервал -0,0196, -0,0093; p < 0,0001]. Зміна порівняно з вихідним рівнем становила -0,0014 мм/рік (-0,12 %/рік (статистично незначуща)) у групі розувастатину порівняно із прогресуванням +0,0131 мм/рік (1,12 %/рік (p < 0,0001)) у групі плацебо. Прямої кореляції між зменшенням ТКІМСА та зниженням ризику порушень з боку серцево-судинної системи продемонстровано не було. До дослідження METEOR були залучені пацієнти із низьким ризиком ішемічної хвороби серця, які не є представниками цільової популяції застосування розувастатину у дозі 40 мг.
В інтервенційному дослідженні розувастатину з метою обґрунтування застосування статинів як засобу первинної профілактики (JUPITER) вплив розувастатину на частоту значних атеросклеротичних серцево-судинних захворювань оцінювали у 17 802 чоловіків (≥ 50 років) та жінок (≥ 60 років).
Учасники дослідження були випадковим чином розподілені до груп прийому плацебо (n = 8901) або розувастатину в дозі 20 мг один раз на добу (n = 8901), і за ними спостерігали в середньому протягом 2 років.
Концентрації холестерину-ЛПНЩ зменшились на 45 % (p < 0,001) у групі розувастатину порівняно з групою плацебо.
У ретроспективному аналізі даних підгрупи пацієнтів високого ризику із вихідним значенням > 20 % за Фрамінгемською шкалою (1558 учасників) спостерігалося значне зниження частоти комбінованої кінцевої точки, що охоплювала смерть від серцево-судинних подій, інсульт та інфаркт міокарда (р = 0,028), у групі розувастатину порівняно з плацебо. Абсолютне зниження ризику подій становило 8,8 випадку на 1000 пацієнто-років. Показник загальної смертності лишався незміненим у цій групі високого ризику (р = 0,193).
У ретроспективному аналізі даних підгрупи високого ризику (9302 учасники загалом) із вихідним значенням ≥ 5 % за шкалою SCORE (екстрапольовано з метою включення даних учасників віком понад 65 років) спостерігалося значуще зниження частоти подій комбінованої кінцевої точки, що охоплювала смерть від серцево-судинних подій, інсульт та інфаркт міокарда (р = 0,0003), у групі розувастатину порівняно з плацебо. Зниження абсолютного ризику, вираженого за частотою подій, становило 5,1 випадку на 1000 пацієнто-років. Показник загальної смертності у цій підгрупі високого ризику лишався незміненим (р = 0,076).
У дослідженні JUPITER 6,6 % учасників групи прийому розувастатину та 6,2 % учасників групи плацебо припинили застосування досліджуваного лікарського засобу через небажані явища. Найбільш частими небажаними явищами, що призводили до припинення лікування, були міалгія (0,3 % у групі розувастатину, 0,2 % − плацебо), абдомінальний біль (0,03 % у групі розувастатину, 0,02 % − плацебо) та висип (0,02 % у групі розувастатину, 0,03 % − плацебо). Найбільш частими небажаними явищами, що спостерігалися у групі розувастатину із частотою, більшою або рівною відзначеній у групі плацебо, були інфекції сечових шляхів (8,7 % у групі розувастатину, 8,6 % − плацебо), назофарингіт (7,6 % у групі розувастатину, 7,2 % − плацебо), біль у спині (7,6 % у групі розувастатину, 6,9 % − плацебо) та міалгія (7,6 % у групі розувастатину, 6,6 % − плацебо).
Раміприл
Профілактика серцево-судинних захворювань / нефропротекція
Було проведено превентивне плацебо-контрольоване дослідження (дослідження HOPE) за участю понад 9200 пацієнтів, які додатково до стандартної терапії отримували раміприл. У цьому дослідженні брали участь пацієнти з високим ризиком виникнення серцево-судинного захворювання після перенесеного атеротромботичного серцево-судинного захворювання (наявність в анамнезі ішемічної хвороби серця, інсульту або захворювання периферичних судин) або пацієнти з цукровим діабетом, які мали принаймні ще один додатковий фактор ризику (документально підтверджена мікроальбумінурія, артеріальна гіпертензія, підвищений рівень загального холестерину, низький рівень холестерину ліпопротеїнів високої щільності або паління).
Це дослідження продемонструвало, що раміприл статистично достовірно зменшує частоту виникнення інфаркту міокарда, серцево-судинної смерті та інсульту як окремо, так і у комбінації (первинна комбінована кінцева точка).
Таблиця 2
Дослідження HOPE: основні результати
|
Показник |
Раміприл, % |
Плацебо, % |
Відносний ризик (95 % довірчий інтервал) |
Значення p |
|
Усі пацієнти |
n = 4,645 |
N = 4,652 |
||
|
Первинна комбінована кінцева точка |
14,0 |
17,8 |
0,78 (0,70−0,86) |
< 0,001 |
|
Інфаркт міокарда |
9,9 |
12,3 |
0,80 (0,70−0,90) |
< 0,001 |
|
Серцево-судинна смерть |
6,1 |
8,1 |
0,74 (0,64−0,87) |
< 0,001 |
|
Інсульт |
3,4 |
4,9 |
0,68 (0,56−0,84) |
< 0,001 |
|
Вторинні кінцеві точки |
||||
|
Смерть із будь-якої причини |
10,4 |
12,2 |
0,84 (0,75−0,95) |
0,005 |
|
Потреба у реваскуляризації |
16,0 |
18,3 |
0,85 (0,77−0,94) |
0,002 |
|
Госпіталізація з приводу нестабільної стенокардії |
12,1 |
12,3 |
0,98 (0,87−1,10) |
не достовірно |
|
Госпіталізація з приводу серцевої недостатності |
3,2 |
3,5 |
0,88 (0,70−1,10) |
0,25 |
|
Ускладнення, пов’язані з цукровим діабетом |
6,4 |
7,6 |
0,84 (0,72−0,98) |
0,03 |
У ході дослідження MICRO-HOPE, проведення якого було попередньо заплановано в рамках дослідження HOPE, вивчався ефект, що виникав при додаванні раміприлу у дозі 10 мг до існуючої схеми лікування, порівняно з таким при застосуванні плацебо у 3577 пацієнтів віком від 55 років (верхнього вікового обмеження не було) з нормальним або підвищеним артеріальним тиском, більшість із яких хворіла на цукровий діабет 2-го типу (і мала щонайменше один фактор серцево-судинного ризику).
Результати первинного аналізу продемонстрували, що у 117 (6,5 %) учасників дослідження, які отримували раміприл, та у 149 (8,4 %), які отримували плацебо, розвинулася виражена нефропатія, що відповідає відносному зниженню ризику на 24 %; 95 % ДІ [3–40], p = 0,027.
Дослідження REIN, багатоцентрове рандомізоване подвійно сліпе плацебо-контрольоване дослідження у паралельних групах, проводилося з метою оцінки впливу лікування раміприлом на інтенсивність зниження швидкості клубочкової фільтрації (ШКФ) у 352 пацієнтів з нормальним або підвищеним артеріальним тиском (віком 18−70 років), у яких спостерігалася легка (середня кількість виведеного білка із сечею > 1 та < 3 г/добу) або тяжка (≥ 3 г/добу) протеїнурія внаслідок хронічної недіабетичної нефропатії. Обидві підгрупи були проспективно стратифіковані.
Результати основного аналізу стану пацієнтів з найбільш тяжкою протеїнурією (підгрупа, яка достроково припинила участь у дослідженні, оскільки була доведена користь від лікування у групі раміприлу) продемонстрували, що середня інтенсивність зниження ШКФ за місяць була нижчою при застосуванні раміприлу, ніж при застосуванні плацебо: −0,54 (0,66) порівняно з −0,88 (1,03) мл/хв/місяць, p = 0,038. Таким чином, міжгрупова різниця становила 0,34 [0,03−0,65] на місяць та приблизно 4 мл/хв/рік; 23,1 % пацієнтів групи раміприлу досягли комбінованої вторинної кінцевої точки – подвоєння концентрації креатиніну у плазмі крові та/або термінальна стадія захворювання нирок (необхідність проведення гемодіалізу або трансплантації нирки) – порівняно з 45,5 % у групі плацебо (p = 0,02).
Подвійна блокада ренін-ангіотензин-альдостеронової системи (РААС). У двох масштабних рандомізованих контрольованих дослідженнях [ONTARGET (дослідження впливу телмісартану як монотерапії та у комбінації з раміприлом на загальну кінцеву точку) і VA NEPHRON-D (дослідження діабетичної нефропатії у ветеранів)] вивчалося застосування комбінації інгібітора АПФ з антагоністом рецепторів ангіотензину II.
Дослідження ONTARGET проводилося за участю пацієнтів із серцево-судинними чи цереброваскулярними захворюваннями в анамнезі або із цукровим діабетом 2-го типу із супутніми ознаками ураження органів-мішеней. В дослідженні VA NEPHRON-D взяли участь пацієнти з цукровим діабетом 2-го типу та діабетичною нефропатією.
Ці дослідження не показали значущих переваг комбінованої терапії щодо ниркових і/або серцево-судинних наслідків та смертності, тоді як при цьому спостерігався підвищений ризик гіперкаліємії, гострої ниркової недостатності та/або артеріальної гіпотензії у порівнянні з монотерапією. З огляду на подібні фармакодинамічні характеристики цих препаратів ці результати також застосовні для інших інгібіторів АПФ і антагоністів рецепторів ангіотензину II.
Отже, інгібітори АПФ і антагоністи рецепторів ангіотензину II не можна одночасно застосовувати пацієнтам з діабетичною нефропатією.
Дослідження ALTITUDE (дослідження впливу аліскірену на стан пацієнтів з цукровим діабетом 2-го типу з використанням серцево-судинних та ниркових кінцевих точок) оцінювало переваги додавання аліскірену до стандартної терапії інгібітором АПФ або антагоністом рецепторів ангіотензину II для пацієнтів з цукровим діабетом 2-го типу та хронічним захворюванням нирок, серцево-судинним захворюванням або обома патологіями. Це дослідження було завершено достроково через підвищення ризику небажаних клінічних наслідків. У групі прийому аліскірену у порівнянні із групою прийому плацебо було відмічено більшу частоту випадків смерті з серцево-судинних причин та інсульту, а також підвищення частоти серйозних небажаних явищ, які являли собою особливий інтерес (гіперкаліємії, артеріальної гіпотензії і дисфункції нирок).
Вторинна профілактика після перенесеного гострого інфаркту міокарда. У дослідженні AIRE брали участь понад 2000 пацієнтів з минущими/постійними симптомами серцевої недостатності після перенесеного інфаркту міокарда. Лікування раміприлом розпочинали через 3–10 днів після виникнення гострого інфаркту міокарда. Це дослідження продемонструвало, що після завершення періоду подальшого спостереження, який в середньому становив 15 місяців, смертність у групі, що отримувала раміприл, становила 16,9 %, а у групі плацебо – 22,6 %. Це означає абсолютне зниження смертності на 5,7 % та відносне зниження ризику на 27 % (95 % ДІ [11−40 %]).
Педіатрична популяція
Розувастатин
У подвійно сліпому рандомізованому багатоцентровому плацебо-контрольованому 12- тижневому дослідженні (n = 176, 97 учасників чоловічої та 79 − жіночої статі) із подальшим 40-тижневим періодом (n = 173, 96 учасників чоловічої та 77 − жіночої статі) відкритого титрування дози розувастатину пацієнти віком 10–17 років (II–IV стадії розвитку за Таннером, дівчата, у яких менструації почалися щонайменше 1 рік тому) із гетерозиготною сімейною гіперхолестеринемією протягом 12 тижнів отримували розувастатин у дозі 5, 10 або 20 мг/добу чи плацебо, після чого всі учасники щодня приймали розувастатин протягом 40 тижнів. На початку дослідження приблизно 30 % пацієнтів були віком 10–13 років та приблизно 17 %, 18 %, 40 % та 25 % із них знаходились на ІІ, ІІІ, IV та V стадії розвитку за Таннером відповідно.
Рівень ХС-ЛПНЩ зменшився на 38,3 %, 44,6 % та 50,0 % відповідно у групах прийому розувастатину в дозі 5, 10 та 20 мг порівняно із 0,7 % у групі плацебо.
Наприкінці 40-тижневого періоду відкритого титрування дози для досягнення цільового рівня (максимальна доза становила 20 мг один раз на добу) у 70 зі 173 пацієнтів (40,5 %) вдалося досягти цільового рівня ХС-ЛПНЩ менше 2,8 ммоль/л.
Після 52 тижнів досліджуваного лікування не було виявлено жодного впливу на ріст, масу, ІМТ або статеве дозрівання. Це дослідження (n = 176) не прийнятне для порівняння рідкісних побічних реакцій.
Розувастатин також вивчали у 2-річному відкритому дослідженні із цільовою титрацією дози, проведеному за участю 198 дітей з гетерозиготною сімейною гіперхолестеринемією у віці від 6 до 17 років (88 учасників чоловічої статі та 110 – жіночої статі, стадія розвитку за Таннером < II–V). Початкова доза для всіх пацієнтів становила 5 мг розувастатину один раз на добу. Пацієнтам віком від 6 до 9 років (n = 64) дозу титрували до максимальної дози 10 мг один раз на добу, а пацієнтам віком від 10 до 17 років (n = 134) – до максимальної дози 20 мг один раз на добу.
Після 24 місяців лікування розувастатином середнє зниження від вихідного значення ХС-ЛПНЩ, визначене за методом найменших квадратів, становило -43 % (вихідний рівень: 236 мг/дл, місяць 24: 133 мг/дл). Для кожної вікової групи середнє зниження від вихідного значення ХС-ЛПНЩ, визначене за методом найменших квадратів, становило -43 % (вихідний рівень: 234 мг/дл, місяць 24: 124 мг/дл), -45 % (вихідний рівень: 234 мг/дл, місяць 24: 124 мг/дл) та -35 % (вихідний рівень: 241 мг/дл, місяць 24: 153 мг/дл) у вікових групах від 6 до < 10, від 10 до < 14 і від 14 до < 18 років відповідно.
Результатом застосування розувастатину у дозах 5 мг, 10 мг і 20 мг також були статистично значущі середні зміни у порівнянні з вихідними показниками таких вторинних змінних величин ліпідів і ліпопротеїнів: ХС-ЛПВЩ, загальний ХС, ХС-неЛПВЩ, ХС-ЛПНЩ/ХС-ЛПВЩ, загальний ХС/ХС-ЛПВЩ, ТГ/ХС-ЛПВЩ, ХС-неЛПВЩ/ХС-ЛПВЩ, АпоВ, АпоВ/АпоА-1. Кожна з цих змін демонструвала поліпшення ліпідних реакцій і зберігалася протягом 2 років.
Після 24 місяців лікування жодного впливу на ріст, масу тіла, ІМТ або статеве дозрівання пацієнта виявлено не було.
У рандомізованому подвійно сліпому плацебо-контрольованому багатоцентровому перехресному дослідженні вивчали розувастатин у дозі 20 мг один раз на добу у порівнянні з плацебо за участю 14 дітей та підлітків (віком від 6 до 17 років) з гомозиготною сімейною гіперхолестеринемією. Дослідження включало активну 4-тижневу підготовчу фазу з дотриманням дієти, під час якої пацієнтів лікували розувастатином у дозі 10 мг, перехресну фазу, що складалася з 6-тижневого періоду лікування розувастатином в дозі 20 мг із попереднім або подальшим 6-тижневим лікуванням плацебо, та 12-тижневу підтримуючу фазу, протягом якої всі пацієнти отримували 20 мг розувастатину. Пацієнти, які перебували на терапії езетимібом або аферезом, продовжували отримувати це лікування протягом усього дослідження.
Статистично значуще (p = 0,005) зниження рівня ХС-ЛПНЩ (22,3 %; 85,4 мг/дл, або 2,2 ммоль/л) спостерігали через 6 тижнів лікування розувастатином у дозі 20 мг у порівнянні з плацебо. Спостерігалося статистично значуще зниження загального ХС (20,1 %, р = 0,003), ХС-неЛПВЩ (22,9 %, р = 0,003) і АпоВ (17,1 %, р = 0,024). Також спостерігалося зниження рівнів ТГ, ХС-ЛПНЩ/ХС-ЛПВЩ, загального ХС/ХС-ЛПВЩ, ХС-неЛПВЩ/ХС-ЛПВЩ та АпоВ/АпоА-І після 6 тижнів лікування розувастатином у дозі 20 мг у порівнянні з плацебо. Зниження рівня ХС-ЛПНЩ через 6 тижнів лікування розувастатином у дозі 20 мг з наступними 6 тижнями лікування плацебо зберігалося протягом 12 тижнів безперервної терапії. У одного пацієнта спостерігалося подальше зниження рівня ХС-ЛПНЩ (8,0 %), загального ХС (6,7 %) і ХС-неЛПВЩ (7,4 %) після 6 тижнів лікування з титруванням дози до 40 мг.
Під час продовження відкритого лікування розувастатином у дозі 20 мг у 9 з цих пацієнтів до 90 тижнів зниження рівня ХС-ЛПНЩ зберігалося в межах від -12,1 % до -21,3 %.
У відкритому дослідженні посиленого титрування доз у 7 оцінюваних дітей і підлітків (у віці від 8 до 17 років) з гомозиготною сімейною гіперхолестеринемією (див. вище) відсоток зниження рівня ХС-ЛПНЩ (21,0 %), загального ХС (19,2 %) та ХС-неЛПВЩ (21,0 %) від вихідного рівня після 6 тижнів лікування розувастатином в дозі 20 мг відповідав тому, що спостерігалося у вищезгаданому дослідженні у дітей та підлітків з гомозиготною сімейною гіперхолестеринемією.
Європейське агентство з лікарських засобів відмінило зобов’язання щодо надання результатів досліджень застосування розувастатину у дітей різного віку для лікування гомозиготної сімейної гіперхолестеринемії, первинної комбінованої (змішаної) дисліпідемії та профілактики порушень з боку серцево-судинної системи (див. розділ «Діти»).
Раміприл
В ході рандомізованого подвійно сліпого плацебо-контрольованого клінічного дослідження за участю 244 педіатричних пацієнтів віком 6−16 років з артеріальною гіпертензією (у 73 % з яких була первинна артеріальна гіпертензія) учасники отримували низькі, середні або високі дози раміприлу з метою досягнення у них плазмових концентрацій раміприлату, які відповідають діапазону доз для дорослих 1,25 мг, 5 мг та 20 мг з розрахунку за масою тіла. По закінченні періоду 4 тижні було виявлено, що раміприл був неефективним щодо кінцевої точки – зниження систолічного артеріального тиску, однак він знижував діастолічний тиск при застосуванні найвищої дози досліджуваного діапазону. Було показано, що як середні, так і високі дози раміприлу знижують систолічний і діастолічний артеріальний тиск на статистично значущу величину у дітей з підтвердженою артеріальною гіпертензією.
Такого ефекту не спостерігалося в ході 4-тижневого рандомізованого подвійно сліпого дослідження з підвищенням дози, де оцінювався ефект відміни лікарського засобу і в якому взяли участь 218 педіатричних пацієнтів віком 6−16 років (у 75 % з яких була первинна артеріальна гіпертензія). В ході цього дослідження після відміни препарату спостерігалося помірне рикошетне підвищення як діастолічного, так і систолічного тиску, проте воно не було статистично значущим для повернення тиску до вихідного рівня в усіх групах доз досліджуваного діапазону раміприлу [низькі (0,625–2,5 мг), середні (2,5–10 мг) або високі (5–20 мг) дози] з розрахунку за масою тіла. В досліджуваній педіатричній популяції раміприл не виявляв лінійного дозозалежного ефекту.
Фармакокінетика
Розувастатин
Всмоктування
Максимальна концентрація розувастатину у плазмі досягається приблизно через 5 годин після перорального застосування. Абсолютна біодоступність становить приблизно 20 %.
Розподіл
Розувастатин значним чином захоплюється печінкою, яка є основним місцем синтезу холестерину та кліренсу ХС-ЛПНЩ. Об’єм розподілу розувастатину становить приблизно 134 л. Близько 90 % розувастатину зв’язується з білками плазми крові, переважно з альбуміном.
Метаболізм
Розувастатин зазнає незначного метаболізму (приблизно 10 %). Дослідження метаболізму in vitro із використанням гепатоцитів людини свідчать, що розувастатин є слабким субстратом для метаболізму на основі ферментів цитохрому Р450. Основним задіяним ізоферментом є CYP2C9, дещо меншу роль відіграють 2C19, 3A4 та 2D6. Основними визначеними метаболітами є N-десметиловий та лактоновий метаболіти. N-десметил-метаболіт приблизно на 50 % менш активний, ніж розувастатин, лактоновий метаболіт вважається клінічно неактивним. На розувастатин припадає більше 90 % активності циркулюючого інгібітора ГМГ-КоА-редуктази.
Виведення
Приблизно 90 % дози розувастатину виводиться у незміненому стані з калом (складається з абсорбованої та неабсорбованої діючої речовини), решта виводиться із сечею. Приблизно 5 % виводиться із сечею у незміненій формі. Період напіввиведення із плазми становить приблизно 19 годин і не збільшується при підвищенні дози. Середнє геометричне значення кліренсу розувастатину із плазми крові становить приблизно 50 л/год (коефіцієнт варіації – 21,7 %). Як і щодо інших інгібіторів ГМГ-КоА-редуктази, печінкове захоплення розувастатину відбувається за участю мембранного транспортера OATP-C, який відіграє важливу роль в печінковій елімінації розувастатину.
Лінійність
Системна експозиція розувастатину збільшується пропорційно дозі. При багаторазовому щоденному застосуванні параметри фармакокінетики не змінюються.
Особливі групи пацієнтів
Вік та стать
Не спостерігалося клінічно значимого впливу віку або статі пацієнта на фармакокінетику розувастатину у дорослих.
Раса
Дослідження фармакокінетики виявили, що у пацієнтів монголоїдної раси (японців, китайців, філіппінців, в’єтнамців та корейців) медіанні значення AUC та Cmax приблизно вдвічі вищі, ніж у європейців; у індійців медіанні значення AUC та Cmax підвищені приблизно в 1,3 раза. Аналіз популяційної фармакокінетики не виявив клінічно значущої різниці між пацієнтами європеоїдної та негроїдної рас.
Порушення функції нирок
У дослідженні за участю пацієнтів із різним ступенем порушення функції нирок змін плазмових концентрацій розувастатину або N-десметил-метаболіту у разі слабкої чи помірної ниркової недостатності відзначено не було. У пацієнтів із тяжкими порушеннями функції нирок (кліренс креатиніну < 30 мл/хв) плазмові концентрації розувастатину були в 3 рази, а рівні N-десметил-метаболіту в 9 разів вищими, ніж у здорових добровольців. Рівноважні плазмові концентрації розувастатину у пацієнтів, які перебувають на гемодіалізі, були приблизно на 50 % вищими, ніж у здорових добровольців.
Порушення функції печінки
У дослідженні за участю пацієнтів із різними ступенями порушення печінкових функцій ознак підвищеної експозиції розувастатину не було виявлено у пацієнтів, стан яких оцінювався у 7 або менше балів за шкалою Чайлда – П’ю.
Однак у двох пацієнтів з показниками 8 та 9 за шкалою Чайлда – П’ю системна експозиція була щонайменше вдвічі вищою, ніж у пацієнтів із меншими балами. Досвід застосування розувастатину пацієнтам, стан яких оцінюється у більше ніж 9 балів за шкалою Чайлда – П’ю, відсутній.
Генетичний поліморфізм
Розподіл інгібіторів ГМГ-КоА-редуктази, в тому числі розувастатину, відбувається за участю транспортних білків ОАТР1В1 та BCRP. У пацієнтів із генетичним поліморфізмом SLCO1B1 (OATP1B1) та/або ABCG2 (BCRP) існує ризик підвищеної експозиції розувастатину. При окремих формах поліморфізму SLCO1B1 c.521CC та ABCG2 c.421AA експозиція розувастатину (AUC) підвищена порівняно з генотипами SLCO1B1 c.521TT або ABCG2 c.421СС. Спеціальне генотипування у клінічній практиці не передбачене, але якщо відомо, що пацієнт має такий поліморфізм, рекомендується застосовувати меншу добову дозу розувастатину.
Раміприл
Всмоктування. Після перорального прийому раміприл швидко всмоктується зі шлунково-кишкового тракту. Максимальна концентрація у плазмі крові досягається протягом 1 години. З огляду на кількість речовини, виявленої у сечі, ступінь всмоктування становить щонайменше 56 % і на нього суттєво не впливає наявність їжі у шлунково-кишковому тракті. Біодоступність активного метаболіту раміприлату після перорального застосування раміприлу у дозі 2,5 мг і 5 мг становить 45 %.
Максимальна концентрація у плазмі крові раміприлату, єдиного активного метаболіту раміприлу, досягається через 2−4 години після прийому раміприлу. Після застосування звичайних доз раміприлу 1 раз на добу рівноважна концентрація раміприлату у плазмі крові досягається приблизно на 4 день лікування.
Розподіл. Зв’язування раміприлу з білками плазми крові становить приблизно 73 %, а раміприлату – 56 %.
Метаболізм. Раміприл майже повністю метаболізується до раміприлату, дикетопіперазинового ефіру, дикетопіперазинової кислоти і глюкуронідів раміприлу та раміприлату.
Виведення. Виведення метаболітів відбувається переважно шляхом ниркової екскреції. Зниження концентрації раміприлату у плазмі крові є багатофазним. Через потужне насичувальне зв’язування з АПФ і повільну дисоціацію зі зв’язку з ферментом раміприлат має пролонговану термінальну фазу виведення при дуже низьких концентраціях у плазмі крові.
Після прийому повторних доз раміприлу 1 раз на добу ефективний період напіввиведення становить 13−17 годин для доз 5−10 мг і більше для нижчих доз (1,25−2,5 мг). Різниця зумовлена тим, що здатність ферменту до зв’язування з раміприлатом є насичувальною.
Пацієнти з порушенням функції нирок (див. розділ «Спосіб застосування та дози»). У пацієнтів із порушенням функції нирок ниркова екскреція раміприлату знижена, а нирковий кліренс раміприлату пропорційний кліренсу креатиніну. Це призводить до підвищення концентрації раміприлату у плазмі, яка знижується повільніше, ніж в осіб із нормальною функцією нирок.
Пацієнти з порушенням функції печінки (див. розділ «Спосіб застосування та дози»). У пацієнтів із порушенням функції печінки метаболізм раміприлу з утворенням раміприлату був сповільнений через зниження активності печінкових естераз, а рівні раміприлу у плазмі крові у цих пацієнтів були підвищені. Втім максимальні концентрації раміприлату у цих пацієнтів не відрізнялися від таких в осіб із нормальною функцією печінки.
Годування груддю. Після застосування одноразової дози раміприлу перорально його рівень в материнському молоці був нижчим границі виявлення. Однак ефект при багаторазовому застосуванні невідомий.
Доклінічні дані з безпеки
Розувастатин
Доклінічні дані не виявили особливої небезпеки для людини на основі звичайних досліджень фармакології безпеки, генотоксичності та потенціалу канцерогенності. Специфічні тести впливу на hERG не оцінювались.
Побічні реакції, які не спостерігалися в клінічних дослідженнях, але спостерігалися у тварин при експозиції, подібній до рівнів клінічної експозиції, були такими:
- у дослідженнях токсичності повторних доз гістопатологічні зміни печінки, імовірно, були пов’язані з фармакологічною дією розувастатину і спостерігалися у мишей та щурів;
- меншою мірою спостерігався вплив на жовчний міхур у собак, але не у мавп;
- гонадотоксичність спостерігалася у мавп та собак при застосуванні вищих доз;
- репродуктивна токсичність була очевидною у щурів: мала маса тіла та низька виживаність потомства спостерігалися при застосуванні токсичних для матері доз, коли системна експозиція у кілька разів перевищувала експозицію при застосуванні терапевтичних доз.
Раміприл
При пероральному застосуванні раміприл не спричиняє гострих токсичних явищ у гризунів та собак. Дослідження із тривалим пероральним введенням препарату проводили на щурах, собаках та мавпах. У всіх цих трьох видів тварин спостерігалися зміни електролітного балансу та картини крові. У собак та мавп, які отримували препарат у дозі 250 мг/кг маси тіла на добу, було помічено значне збільшення юкстагломерулярного апарату, що є проявом фармакодинамічної активності раміприлу. У щурів, собак та мавп добові дози препарату 2, 2,5 та 8 мг/кг маси тіла на добу відповідно не призводили до виникнення небажаних ефектів. Необоротне ураження нирок спостерігалося у дуже молодих щурів, які отримали одноразову дозу раміприлу.
Дослідження репродуктивної токсичності, проведені на щурах, кролях та мавпах, не виявили жодних тератогенних властивостей раміприлу. Негативний вплив на фертильність не спостерігався ані у самців, ані у самиць щурів.
Введення раміприлу самицям щурів під час вагітності та лактації призводило до необоротного ураження нирок (розширення ниркової миски) у потомства при застосуванні доз ≥ 50 мг/кг маси тіла на добу.
Численні випробування на мутагенність із застосуванням різних тест-систем не виявили мутагенних або генотоксичних властивостей раміприлу.
Клінічні характеристики
Показання
ХАРТИЛ® РОЗ призначений для лікування артеріальної гіпертензії у дорослих пацієнтів, стан яких належним чином контролюється одночасним застосуванням раміприлу та розувастатину у тих же дозах, що і в фіксованій комбінації, і у яких, крім артеріальної гіпертензії, діагностовано одне з таких захворювань:
- первинна гіперхолестеринемія (тип ІІа, в тому числі із гетерозиготною сімейною гіперхолестеринемією),
- змішана дисліпідемія (тип IІb),
- гомозиготна сімейна гіперхолестеринемія,
а також для профілактики значних серцево-судинних порушень у пацієнтів з високим ризиком розвитку першого випадку серцево-судинного порушення як доповнення до корекції інших факторів ризику.
Протипоказання
Розувастатин
- Підвищена чутливість до розувастатину.
- Активні захворювання печінки, в тому числі стійке підвищення сироваткових трансаміназ невідомої етіології та будь-які підвищення трансаміназ у сироватці, що у 3 рази перевищують верхню межу норми (ВМН).
- Тяжкі порушення функції нирок (кліренс креатиніну < 30 мл/хв).
- Міопатія.
- Пацієнти, які одночасно отримували комбінацію софосбувір/велпатасвір/воксилапревір (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
- Одночасне застосування з циклоспорином.
Раміприл
- Гіперчутливість до раміприлу чи до інших інгібіторів ангіотензинперетворювального ферменту (АПФ).
- Наявність в анамнезі ангіоневротичного набряку (спадкового, ідіопатичного чи раніше перенесеного на тлі застосування інгібіторів АПФ або антагоністів рецепторів ангіотензину ІІ).
- Одночасне застосування з сакубітрилом/валсартаном (див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
- Екстракорпоральне лікування, що призводить до контакту крові з негативно зарядженими поверхнями (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
- Значний двосторонній стеноз ниркових артерій або стеноз ниркової артерії при наявності єдиної функціонуючої нирки.
- Артеріальна гіпотензія або гемодинамічно нестабільні стани.
- Одночасне застосування з препаратами, що містять аліскірен, протипоказане пацієнтам з цукровим діабетом або нирковою дисфункцією (швидкість клубочкової фільтрації (ШКФ) < 60 мл/хв/1,73 м2) (див. розділи «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Фармакодинаміка»).
Протипоказання, пов’язані із застосуванням лікарського засобу ХАРТИЛ® РОЗ
Усі протипоказання, описані вище щодо окремих діючих речовин, також стосуються лікарського засобу ХАРТИЛ® РОЗ.
Підвищена чутливість до будь-якої допоміжної речовини (див. розділ «Склад»).
Лікарський засіб протипоказано застосовувати у період вагітності або годування груддю, а також жінкам репродуктивного віку, які не застосовують належні засоби контрацепції (див. розділи «Особливості застосування» та «Застосування у період вагітності та годування груддю»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Розувастатин
Вплив супутніх препаратів на розувастатин
Інгібітори транспортних білків. Розувастатин є субстратом для деяких транспортних білків, в тому числі печінкового транспортера захоплення ОАТР1В1 та ефлюксного транспортера BCRP. Одночасне застосування розувастатину із лікарськими засобами, що пригнічують ці транспортні білки, може призводити до підвищення концентрацій розувастатину в плазмі крові та збільшення ризику міопатії (див. розділи «Спосіб застосування та дози», «Особливості застосування», таблицю 3).
Циклоспорин. У період супутнього застосування розувастатину та циклоспорину значення AUC розувастатину були в середньому приблизно у 7 разів вищими, ніж ті, які спостерігалися у здорових добровольців (див. таблицю 3). ХАРТИЛ® РОЗ протипоказаний пацієнтам, які одночасно отримують циклоспорин (див. розділ «Протипоказання»). Супутнє застосування не впливало на концентрації циклоспорину в плазмі крові.
Інгібітори протеази. Хоча точний механізм взаємодії невідомий, одночасне застосування інгібіторів протеази може значно збільшувати експозицію розувастатину (див. таблицю 3). Наприклад, у дослідженні фармакокінетики одночасне застосування 10 мг розувастатину та комбінованого лікарського засобу, що містив два інгібітори протеази (300 мг атазанавіру / 100 мг ритонавіру), у здорових добровольців супроводжувалося підвищенням AUC та Cmax розувастатину приблизно в 3 та 7 разів відповідно. Одночасне застосування розувастатину та деяких комбінацій інгібіторів протеази можливе після ретельного обміркування корекції дози розувастатину з огляду на очікуване зростання експозиції розувастатину (див. розділи «Спосіб застосування та дози», «Особливості застосування», таблицю 3).
Гемфіброзил та інші ліпідознижувальні засоби. Одночасне застосування розувастатину та гемфіброзилу призводило до зростання AUC та Cmax розувастатину в 2 рази (див. розділ «Особливості застосування»).
Зважаючи на дані спеціальних досліджень, фармакокінетично значущої взаємодії з фенофібратом не очікується, однак можлива фармакодинамічна взаємодія. Гемфіброзил, фенофібрат, інші фібрати та ліпідознижувальні дози (≥ 1 г/добу) ніацину (нікотинової кислоти) збільшують ризик міопатії при супутньому застосуванні з інгібіторами ГМГ-КоА-редуктази, ймовірно, за рахунок того, що вони можуть спричиняти міопатію, коли їх застосовують окремо.
Езетиміб. Одночасне застосування 10 мг розувастатину та 10 мг езетимібу пацієнтам із гіперхолестеринемією призводило до зростання AUC розувастатину в 1,2 раза (таблиця 3). Не можна виключати фармакодинамічної взаємодії між розувастатином та езетимібом, що може призвести до небажаних явищ (див. розділ «Особливості застосування»).
Антацидні лікарські засоби. Одночасне застосування розувастатину із суспензіями антацидів, що містять гідроксид алюмінію або магнію, знижувало концентрації розувастатину в плазмі крові приблизно на 50 %. Цей ефект був менш вираженим у разі застосування антацидних засобів через 2 години після розувастатину. Клінічна значущість цієї взаємодії не вивчалася.
Еритроміцин. Одночасне застосування розувастатину та еритроміцину знижувало AUC розувастатину на 20 %, а Cmax – на 30 %. Ця взаємодія може бути спричинена посиленою перистальтикою кишечнику внаслідок дії еритроміцину.
Ферменти цитохрому Р450. Результати досліджень in vitro та in vivo свідчать, що розувастатин не інгібує і не стимулює ізоферменти цитохрому Р450. Окрім цього, розувастатин є слабким субстратом цих ізоферментів. Таким чином, взаємодії з лікарськими засобами в результаті метаболізму, опосередкованого Р450, не очікується. Не спостерігалося клінічно значущих взаємодій між розувастатином та флуконазолом (інгібітором CYP2C9 та CYP3A4) або кетоконазолом (інгібітором CYP2A6 та CYP3A4).
Тикагрелор. Тикагрелор може впливати на ниркову екскрецію розувастатину, збільшуючи ризик накопичення розувастатину. Хоча точний механізм невідомий, у деяких випадках одночасне застосування тикагрелору та розувастатину призводило до зниження функції нирок, підвищення рівня креатинфосфокінази та рабдоміолізу.
Взаємодії, що вимагають корекції дози розувастатину (див. таблицю 3). У разі необхідності застосування розувастатину з іншими лікарськими засобами, здатними підвищувати експозицію розувастатину, дозу розувастатину потрібно скоригувати. Якщо очікується, що експозиція лікарського засобу (AUC) зросте приблизно в 2 або більше разів, застосування розувастатину слід починати з дози 5 мг один раз на добу. Максимальну добову дозу розувастатину слід скоригувати таким чином, щоб очікувана експозиція розувастатину не перевищувала експозицію, що відзначається при прийомі дози 40 мг/добу без застосування лікарських засобів, що взаємодіють із препаратом. Наприклад, при застосуванні з гемфіброзилом доза розувастатину становитиме 20 мг (збільшення експозиції в 1,9 раза), при застосуванні із комбінацією ритонавір/атазанавір – 10 мг (збільшення в 3,1 раза).
Якщо лікарський засіб збільшує AUC розувастатину менш ніж у 2 рази, початкову дозу зменшувати не потрібно, але слід дотримуватися обережності при збільшенні дози розувастатину до понад 20 мг.
Таблиця 3
Вплив супутніх лікарських засобів на експозицію розувастатину
(AUC; в порядку зменшення величини) за опублікованими даними клінічних досліджень
|
Збільшення AUC розувастатину в 2 рази або більше ніж у 2 рази |
||
|
Режим дозування супутнього лікарського засобу |
Режим дозування розувастатину |
Зміни AUC розувастатину* |
|
Софосбувір/велпатасвір/воксилапревір (400 мг / 100 мг / 100 мг) + воксилапревір (100 мг) один раз на добу протягом 15 днів |
10 мг, одноразова доза |
↑ 7,4 раза |
|
Циклоспорин від 75 мг до 200 мг двічі на добу, 6 місяців |
10 мг один раз на добу, 10 днів |
↑ 7,1 раза |
|
Даролутамід 600 мг двічі на добу, 5 днів |
5 мг, одноразова доза |
↑ 5,2 раза |
|
Регорафеніб 160 мг один раз на добу, 14 днів |
5 мг, одноразова доза |
↑ 3,8 раза |
|
Атазанавір 300 мг / ритонавір 100 мг один раз на добу, 8 днів |
10 мг, одноразова доза |
↑ 3,1 раза |
|
Велпатасвір 100 мг один раз на добу |
10 мг, одноразова доза |
↑ 2,7 раза |
|
Омбітасвір 25 мг / паритапревір 150 мг / ритонавір 100 мг один раз на добу / дасабувір 400 мг двічі на добу, 14 днів |
5 мг, одноразова доза |
↑ 2,6 раза |
|
Терифлуномід |
Дані відсутні |
↑ 2,5 раза |
|
Гразопревір 200 мг / елбасвір 50 мг один раз на добу, 11 днів |
10 мг, одноразова доза |
↑ 2,3 раза |
|
Глекапревір 400 мг / пібрентасвір 120 мг один раз на добу, 7 днів |
5 мг один раз на добу, 7 днів |
↑ 2,2 раза |
|
Лопінавір 400 мг / ритонавір 100 мг двічі на добу, 17 днів |
20 мг один раз на добу, 7 днів |
↑ 2,1 раза |
|
Капматиніб 400 мг двічі на добу |
10 мг, одноразова доза |
↑ 2,1 раза |
|
Клопідогрель 300 мг навантажувальна доза, після 75 мг через 24 години |
20 мг, одноразова доза |
↑ 2 рази |
|
Фостаматиніб 100 мг двічі на добу |
20 мг, одноразова доза |
↑ 2 рази |
|
Збільшення AUC розувастатину менше ніж у 2 рази |
||
|
Режим дозування супутнього лікарського засобу |
Режим дозування розувастатину |
Зміни AUC розувастатину* |
|
Гемфіброзил 600 мг двічі на добу, 7 днів |
80 мг, одноразова доза |
↑ 1,9 раза |
|
Фебуксостат 120 мг один раз на добу |
10 мг, одноразова доза |
↑ 1,9 раза |
|
Елтромбопак 75 мг один раз на добу, 5 днів |
10 мг, одноразова доза |
↑ 1,6 раза |
|
Дарунавір 600 мг / ритонавір 100 мг двічі на добу, 7 днів |
10 мг один раз на добу, 7 днів |
↑ 1,5 раза |
|
Типранавір 500 мг / ритонавір 200 мг двічі на добу, 11 днів |
10 мг, одноразова доза |
↑ 1,4 раза |
|
Дронедарон 400 мг двічі на добу |
Невідомо |
↑ 1,4 раза |
|
Ітраконазол 200 мг один раз на добу, 5 днів |
10 мг, одноразова доза |
↑ 1,4 раза ** |
|
Езетиміб 10 мг один раз на добу, 14 днів |
10 мг один раз на добу, 14 днів |
↑ 1,2 раза ** |
|
Зниження AUC розувастатину |
||
|
Режим дозування супутнього лікарського засобу |
Режим дозування розувастатину |
Зміни AUC розувастатину* |
|
Еритроміцин 500 мг чотири рази на добу, 7 днів |
80 мг, одноразова доза |
↓ 20 % |
|
Байкалін 50 мг тричі на добу, 14 днів |
20 мг, одноразова доза |
↓ 47 % |
* Дані, представлені як зміна в х разів, являють собою співвідношення показників при застосуванні розувастатину у комбінації та окремо. Дані, представлені у вигляді % зміни, являють собою % різницю відносно показників при застосуванні розувастатину окремо.
Збільшення позначено значком ↑, зменшення – ↓.
** Було проведено кілька досліджень взаємодії при різних дозах розувастатину, у таблиці 3 подано найбільш значуще співвідношення.
Лікарські засоби / комбінації, які не мали клінічно значущого впливу на співвідношення AUC розувастатину при одночасному застосуванні: алеглітазар 0,3 мг, 7 днів; фенофібрат 67 мг 3 рази на добу, 7 днів; флуконазол 200 мг 1 раз на добу, 11 днів; фосампренавір 700 мг / ритонавір 100 мг 2 рази на добу, 8 днів; кетоконазол 200 мг 2 рази на добу, 7 днів; рифампін 450 мг 1 раз на добу, 7 днів; силімарин 140 мг 3 рази на добу, 5 днів.
Вплив розувастатину на супутні лікарські засоби
Антагоністи вітаміну К. Як і щодо інших інгібіторів ГМГ-КоА-редуктази, на початку застосування розувастатину або при підвищенні його дози у пацієнтів, які одночасно застосовують антагоністи вітаміну К (наприклад варфарин або інший кумариновий антикоагулянт), можливе підвищення міжнародного нормалізованого співвідношення (МНС). Припинення застосування розувастатину або зменшення його дози може призвести до зниження МНС. У таких випадках бажаний належний моніторинг МНС.
Пероральні контрацептиви/ гормонозамісна терапія (ГЗТ). Одночасне застосування розувастатину та пероральних контрацептивів призводило до підвищення AUC етинілестрадіолу та норгестрелу на 26 % та 34 % відповідно. Таке підвищення рівнів в плазмі крові слід враховувати при підборі дози пероральних контрацептивів. Даних щодо фармакокінетики лікарських засобів у пацієнтів, які одночасно застосовують розувастатин та ГЗТ, немає, тому не можна виключати подібного ефекту. Однак комбінацію широко застосовували жінкам у рамках клінічних досліджень і вона переносилася добре.
Інші лікарські засоби
Дигоксин. За даними спеціальних досліджень клінічно значущої взаємодії із дигоксином не очікується.
Фузидова кислота. Дослідження взаємодії розувастатину з фузидовою кислотою не проводилися. Ризик міопатії, у т. ч. з рабдоміолізом, може бути збільшений внаслідок супутнього системного застосування фузидової кислоти зі статинами. Механізм цієї взаємодії (фармакодинамічний або фармакокінетичний, або і те й інше) поки не з’ясований. Повідомлялося про рабдоміоліз (зокрема деякі летальні випадки) у пацієнтів, які отримували цю комбінацію.
Пацієнтам, для яких системне застосування фузидової кислоти вважається необхідним, лікування розувастатином слід припинити на весь термін лікування фузидовою кислотою (також див. розділ «Особливості застосування»).
Раміприл
Дані клінічних досліджень продемонстрували, що подвійна блокада ренін-ангіотензин-альдостеронової системи (РААС) шляхом комбінованого застосування інгібіторів АПФ, антагоністів рецепторів ангіотензину II або аліскірену асоціюється з підвищеною частотою виникнення таких небажаних явищ, як артеріальна гіпотензія, гіперкаліємія та погіршення функції нирок (в тому числі гостра ниркова недостатність), у порівнянні із застосуванням лише одного засобу, що впливає на РААС (див. розділи «Фармакодинаміка», «Протипоказання» та «Особливості застосування»).
Протипоказані комбінації
Сакубітрил/валсартан. Одночасне застосування інгібіторів АПФ з сакубітрилом /валсартаном протипоказане через підвищений ризик розвитку ангіоневротичного набряку (див. розділи «Протипоказання» та «Особливості застосування»). Лікування раміприлом слід починати лише через 36 годин після прийому останньої дози сакубітрилу/валсартану. Лікування сакубітрилом/валсартаном слід починати лише через 36 годин після прийому останньої дози раміприлу.
Методи екстракорпоральної терапії. Методи екстракорпоральної терапії, в результаті яких відбувається контакт крові з негативно зарядженими поверхнями, такі як діаліз або гемофільтрація із використанням певних мембран з високою інтенсивністю потоку (наприклад мембран з поліакрилонітрилу) та аферез ліпопротеїнів низької щільності із застосуванням декстрану сульфату, протипоказані з огляду на підвищений ризик розвитку тяжких анафілактоїдних реакцій (див. розділ «Протипоказання»). Якщо таке лікування необхідне, слід розглянути питання про використання іншої діалізної мембрани або застосування іншого класу антигіпертензивних засобів.
Комбінації, що вимагають вжиття запобіжних заходів
Солі калію, гепарин, калійзберігаючі діуретики та інші активні речовини, що збільшують рівень калію у плазмі крові (включаючи антагоністи ангіотензину ІІ, триметоприм та його фіксовані комбінації з сульфаметоксазолом, такролімус, циклоспорин). Може виникнути гіперкаліємія, тому потрібно ретельно контролювати рівень калію у плазмі крові.
Антигіпертензивні лікарські засоби (наприклад діуретики) та інші речовини, здатні знижувати артеріальний тиск (наприклад нітрати, трициклічні антидепресанти, анестетики, алкоголь, баклофен, альфузозин, доксазозин, празозин, тамсулозин, теразозин). Слід очікувати збільшення ризику виникнення артеріальної гіпотензії.
Вазопресорні симпатоміметики та інші речовини (наприклад ізопротеренол, добутамін, допамін, епінефрин), які можуть зменшити антигіпертензивний ефект раміприлу. Рекомендується ретельно контролювати артеріальний тиск.
Алопуринол, імунодепресанти, кортикостероїди, прокаїнамід, цитостатики та інші речовини, що можуть спричиняти зміни картини крові. Підвищена ймовірність виникнення гематологічних реакцій (див. розділ «Особливості застосування»).
Солі літію. Інгібітори АПФ можуть зменшити екскрецію літію, що може призвести до збільшення токсичності літію. Необхідно ретельно контролювати рівень літію.
Протидіабетичні засоби, включаючи інсулін. Можуть виникнути гіпоглікемічні реакції. Рекомендується ретельно контролювати рівень глюкози у крові.
Нестероїдні протизапальні препарати (НПЗП) і ацетилсаліцилова кислота. Очікується зниження антигіпертензивного ефекту раміприлу. Більше того, одночасне застосування інгібіторів АПФ і НПЗП може супроводжуватися підвищеним ризиком погіршення функції нирок та збільшенням рівня калію у крові.
Інгібітори мішені рапаміцину у ссавців (mTOR) або вілдагліптин. Можливе підвищення ризику розвитку ангіоневротичного набряку у пацієнтів, які одночасно отримують такі засоби, як інгібітори mTOR (наприклад темсиролімус, еверолімус, сиролімус) або вілдагліптин. Розпочинати таку терапію слід з обережністю (див. розділ «Особливості застосування»).
Інгібітори неприлізину (НЕП). Повідомлялося про потенційне зростання ризику розвитку ангіоневротичного набряку при одночасному застосуванні інгібіторів АПФ та інгібітора НЕП (нейтральної ендопептидази), наприклад рацекадотрилу (див. розділ «Особливості застосування»).
Сакубітрил/валсартан. Одночасне застосування інгібіторів АПФ з сакубітрилом/ валсартаном протипоказане через підвищений ризик розвитку ангіоневротичного набряку.
Особливості застосування
Розувастатин
Тяжкі шкірні реакції
При застосуванні розувастатину повідомлялося про тяжкі шкірні побічні реакції, включаючи синдром Стівенса − Джонсона (ССД) та лікарську реакцію з еозинофілією та системними проявами (DRESS), які можуть бути небезпечними для життя або летальними. У разі призначення розувастатину пацієнтів слід повідомити про ознаки та симптоми тяжких шкірних реакцій та ретельно спостерігати за станом таких пацієнтів. Якщо з’являються ознаки та симптоми, що свідчать про вищезазначені реакції, потрібно негайно припинити застосування препарату ХАРТИЛ® РОЗ та розглянути альтернативне лікування.
Якщо у пацієнта виникла така серйозна реакція, як ССД або DRESS, під час застосування препарату ХАРТИЛ® РОЗ, лікування пацієнта цим лікарським засобом поновлювати не можна.
Вплив на нирки
Протеїнурія, виявлена у результаті аналізу за тест-смужками та переважно канальцевого походження, спостерігалася у пацієнтів, які лікувалися вищими дозами розувастатину, зокрема 40 мг, і у більшості випадків була тимчасовою або переривчастою. Протеїнурія не була передвісником гострої або прогресуючої хвороби нирок (див. розділ «Побічні реакції»).
Вплив на скелетну мускулатуру
Порушення з боку скелетної мускулатури, наприклад міалгія, міопатія та зрідка рабдоміоліз, спостерігалися у пацієнтів, які приймали розувастатин у будь-яких дозах, особливо більше 20 мг. Дуже рідко випадки рабдоміолізу відзначалися при застосуванні езетимібу у комбінації з інгібіторами ГМГ-КоА-редуктази. Не можна виключати можливість фармакодинамічної взаємодії (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»), а тому таку комбінацію слід застосовувати з обережністю.
Міастенія гравіс, очна міастенія
Повідомлялося, що у деяких випадках статини викликають або загострюють попередньо наявну міастенію гравіс або очну міастенію (див. розділ «Побічні реакції»). У разі загострення симптомів застосування розувастатину слід припинити. Повідомлялося про рецидиви при першому або повторному застосуванні того самого або іншого статину.
Рівень креатинкінази
Рівень креатинкінази (КК) не слід вимірювати після значних фізичних навантажень або за наявності можливих альтернативних причин підвищення КК, що можуть ускладнювати інтерпретацію результатів. Якщо вихідні рівні КК значно підвищені (> 5 разів вище ВМН), протягом 5–7 днів необхідно зробити повторний аналіз, щоб підтвердити результати. Якщо результати повторного аналізу підтверджують, що вихідне значення КК більше ніж в 5 разів перевищує ВМН, застосування лікарського засобу починати не слід.
Перед початком лікування
ХАРТИЛ® РОЗ, як і інші інгібітори ГМГ-КоА-редуктази, слід з обережністю призначати пацієнтам із факторами, що сприяють розвитку міопатії/рабдоміолізу. До таких факторів належать:
– порушення функції нирок;
– гіпотиреоз;
– наявність в особистому або сімейному анамнезі спадкових захворювань м’язів;
– наявність в анамнезі міотоксичності на фоні застосування інших інгібіторів ГМГ-КоА- редуктази або фібратів;
– зловживання алкоголем;
– вік > 70 років;
– ситуації, що можуть призвести до підвищення рівнів розувастатину у плазмі (див. розділи «Спосіб застосування та дози», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Фармакокінетика»);
– супутнє застосування фібратів.
У таких пацієнтів потрібно порівняти можливий ризик та потенційну користь при застосуванні розувастатину; також рекомендований клінічний моніторинг. Не слід розпочинати лікування у разі значно підвищених початкових рівнів КК (> 5 разів вище ВМН).
В період лікування
Пацієнтів слід попросити негайно повідомляти про м’язовий біль, слабкість або судоми невідомої етіології, особливо якщо вони супроводжуються нездужанням або лихоманкою. У таких пацієнтів потрібно вимірювати рівні КК. Застосування лікарського засобу слід припинити, якщо рівні КК значно підвищені (> 5 разів вище ВМН) або якщо симптоми з боку м’язів тяжкі та спричиняють щоденний дискомфорт (навіть якщо рівні КК ≤ 5 разів перевищують ВМН). У разі зникнення симптомів та повернення рівня КК до норми можна поновити терапію розувастатином або альтернативним інгібітором ГМГ-КоА-редуктази у найменшій дозі та під ретельним наглядом. Регулярно перевіряти рівні КК у асимптоматичних пацієнтів немає потреби. Дуже рідко повідомлялося про випадки імуноопосередкованої некротизуючої міопатії (ІОНМ) під час або після терапії статинами, в тому числі розувастатином.
Клінічними проявами ІОНМ є слабкість проксимальних м’язів та підвищення рівня креатинкінази у сироватці, що зберігається навіть після припинення застосування статинів.
У клінічних дослідженнях не було отримано доказів підвищеного впливу на скелетну мускулатуру у невеликої кількості пацієнтів, які приймали розувастатин та супутні лікарські засоби. Однак підвищення частоти міозиту та міопатії відзначалося у пацієнтів, які приймали інші інгібітори ГМГ-КоА-редуктази разом із похідними фіброєвої кислоти, в тому числі гемфіброзилом, циклоспорином, нікотиновою кислотою, азольними протигрибковими препаратами, інгібіторами протеази та макролідними антибіотиками. Гемфіброзил підвищує ризик міопатії при супутньому застосуванні з деякими інгібіторами ГМГ-КоА-редуктази. Тому застосовувати ХАРТИЛ® РОЗ у комбінації із гемфіброзилом не рекомендується. Користь подальшої зміни рівня ліпідів при застосуванні лікарського засобу ХАРТИЛ® РОЗ у комбінації із фібратами або ніацином потрібно ретельно зважувати порівняно із потенційними ризиками, пов’язаними із застосуванням таких комбінацій.
ХАРТИЛ® РОЗ не слід застосовувати спільно із системними лікарськими засобами фузидової кислоти або протягом 7 днів після припинення лікування фузидовою кислотою. Пацієнтам, для яких системне застосування фузидової кислоти вважається необхідним, лікування статинами слід припинити на весь термін лікування фузидовою кислотою. Повідомлялося про рабдоміоліз (в тому числі декілька смертельних випадків) у пацієнтів, які отримували комбінацію фузидової кислоти та статинів (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). Пацієнт повинен негайно звернутися по медичну допомогу, якщо він відчуває будь-які симптоми м’язової слабкості, болю або хворобливої чутливості.
Терапія статинами може бути повторно проведена через 7 днів після останньої дози фузидової кислоти. У виняткових випадках, коли необхідне тривале системне застосування фузидової кислоти, наприклад, для лікування тяжких інфекцій, можливість одночасного застосування препарату ХАРТИЛ® РОЗ та фузидової кислоти слід розглядати тільки в кожному конкретному випадку та за умови ретельного медичного нагляду.
ХАРТИЛ® РОЗ не слід застосовувати пацієнтам із гострими, серйозними станами, що свідчать про міопатію або можливість розвитку ниркової недостатності внаслідок рабдоміолізу (такими як сепсис, гіпотензія, велике хірургічне втручання, травма, тяжкі метаболічні, ендокринні та електролітні розлади або неконтрольовані судоми).
Вплив на печінку
Які і інші інгібітори ГМГ-КоА-редуктази, розувастатин слід з обережністю застосовувати пацієнтам, які зловживають алкоголем та/або мають в анамнезі захворювання печінки.
Рекомендовано перевіряти біохімічні показники функції печінки перед початком лікування та через 3 місяці. Застосування розувастатину слід припинити або зменшити дозу, якщо рівень трансаміназ у сироватці крові більше ніж втричі перевищує верхню межу норми.
У пацієнтів із вторинною гіперхолестеринемією, зумовленою гіпотиреозом або нефротичним синдромом, слід спочатку провести лікування основного захворювання, а потім починати терапію розувастатином.
Расова належність
Дослідження фармакокінетики свідчать про зростання експозиції у пацієнтів монголоїдної раси порівняно з європейцями (див. розділи «Спосіб застосування та дози», «Протипоказання» та «Фармакокінетика»).
Інгібітори протеази
Підвищена системна експозиція розувастатину спостерігалася у осіб, які застосовували розувастатин супутньо із різними інгібіторами протеази у поєднанні із ритонавіром. Слід обміркувати як користь від зниження рівня ліпідів за допомогою лікарського засобу ХАРТИЛ® РОЗ для пацієнтів із ВІЛ, які отримують інгібітори протеази, так і можливість підвищення концентрацій розувастатину у плазмі крові на початку терапії та при підвищенні дози розувастатину у пацієнтів, які отримують інгібітори протеази. Одночасне застосування з деякими інгібіторами протеази не рекомендується, якщо доза препарату ХАРТИЛ® РОЗ не скоригована (див. розділ «Спосіб застосування та дози» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Інтерстиціальна хвороба легень
Під час застосування деяких статинів, особливо при тривалому лікуванні, повідомлялося про виняткові випадки інтерстиціальної хвороби легень (див. розділ «Побічні реакції»). До проявів цієї хвороби можна віднести задишку, непродуктивний кашель та загальне погіршення стану (стомлюваність, зниження маси тіла та гарячка). У разі підозри на інтерстиціальну хворобу легень застосування статинів слід припинити.
Цукровий діабет
Деякі факти свідчать, що статини підвищують рівень глюкози в крові та у деяких пацієнтів, яким загрожує високий ризик розвитку цукрового діабету в майбутньому, можуть спричиняти гіперглікемію такого рівня, за якого необхідне належне лікування цукрового діабету. Цю загрозу, однак, перевищує зниження ризику судинних порушень при застосуванні статинів, і тому вона не має бути підставою для припинення терапії статинами. За пацієнтами групи ризику (рівень глюкози натще 5,6–6,9 ммоль/л, ІМТ > 30 кг/м2, підвищений рівень тригліцеридів, артеріальна гіпертензія) слід встановити як клінічний, так і біохімічний контроль згідно із національними настановами.
У дослідженні JUPITER зареєстрована загальна частота цукрового діабету становила 2,8 % у групі прийому розувастатину та 2,3 % − у групі плацебо, переважно у пацієнтів із рівнем глюкози натще від 5,6 до 6,9 ммоль/л.
Раміприл
Особливі групи пацієнтів
Вагітність
Лікування інгібіторами АПФ (такими як раміприл) або антагоністами рецепторів ангіотензину ІІ не слід розпочинати у період вагітності. За винятком випадків, коли продовження лікування інгібітором АПФ / антагоністами рецепторів ангіотензину ІІ є абсолютно необхідним, пацієнток, які планують завагітніти, слід перевести на інший антигіпертензивний препарат, застосування якого у період вагітності визнано безпечним. Як тільки буде діагностовано вагітність, лікування інгібіторами АПФ/антагоністами рецепторів ангіотензину ІІ слід негайно припинити та у разі необхідності розпочати лікування іншим препаратом (див. розділи «Протипоказання» та «Застосування у період вагітності або годування груддю»).
Пацієнти з високим ризиком розвитку артеріальної гіпотензії
· Пацієнти зі значним підвищенням активності ренін-ангіотензин-альдостеронової системи
У пацієнтів зі значним підвищенням активності ренін-ангіотензин-альдостеронової системи існує ризик раптового значного зниження артеріального тиску та погіршення функції нирок внаслідок пригнічення АПФ, особливо якщо інгібітор АПФ чи супутній діуретик призначають вперше або вперше підвищують дозу.
Суттєвого підвищення активності ренін-ангіотензин-альдостеронової системи, яке потребує медичного нагляду, в тому числі постійного контролю артеріального тиску, можна очікувати, наприклад, у пацієнтів:
- з тяжкою артеріальною гіпертензією;
- з декомпенсованою застійною серцевою недостатністю;
- з гемодинамічно значущою перешкодою для притоку або відтоку крові з лівого шлуночка (наприклад зі стенозом аортального або мітрального клапана);
- з одностороннім стенозом ниркової артерії при наявності другої функціонуючої нирки;
- у яких існує або може розвинутися нестача рідини або електролітів (включаючи тих, хто отримує діуретики);
- із цирозом печінки та/або асцитом;
- яким виконують великі хірургічні втручання або під час анестезії із застосуванням препаратів, що спричиняють артеріальну гіпотензію.
Як правило, рекомендується провести корекцію дегідратації, гіповолемії або нестачі електролітів до початку лікування (однак для пацієнтів із серцевою недостатністю такі коригуючі заходи слід ретельно зважити щодо ризику виникнення перевантаження об’ємом).
· Подвійна блокада ренін-ангіотензин-альдостеронової системи (РААС)
Існують доказові дані на користь того, що одночасне застосування інгібіторів АПФ, антагоністів рецепторів ангіотензину II або аліскірену підвищує ризик артеріальної гіпотензії, гіперкаліємії та погіршення функції нирок (в тому числі розвитку гострої ниркової недостатності). У зв’язку з цим подвійна блокада РААС шляхом комбінованого застосування інгібіторів АПФ, антагоністів рецепторів ангіотензину II або аліскірену не рекомендується (див. розділи «Фармакодинаміка» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Якщо терапія у вигляді такої подвійної блокади розцінюється як абсолютно необхідна, вона має застосовуватися лише під наглядом спеціаліста та за умови частого і ретельного контролю функції нирок, вмісту електролітів та рівня артеріального тиску.
Інгібітори АПФ і антагоністи рецепторів ангіотензину II не можна одночасно застосовувати пацієнтам з діабетичною нефропатією.
· Транзиторна або персистуюча серцева недостатність після інфаркту міокарда
· Пацієнти, у яких існує ризик виникнення серцевої або церебральної ішемії у разі гострої артеріальної гіпотензії
У початковій фазі лікування потрібен особливий медичний нагляд.
· Пацієнти літнього віку
Див. розділ «Спосіб застосування та дози».
Хірургічне втручання
Якщо можливо, лікування інгібіторами АПФ, такими як раміприл, слід припинити за 1 день до проведення хірургічного втручання.
Контроль функції нирок
Функцію нирок потрібно оцінювати до і під час проведення лікування та корегувати дозу, особливо у перші тижні лікування. Особливо ретельний контроль потрібен за пацієнтами з порушенням функції нирок (див. розділ «Спосіб застосування та дози»). Існує ризик погіршення ниркової функції, особливо у пацієнтів із застійною серцевою недостатністю або після трансплантації нирки.
Ангіоневротичний набряк
Повідомляли про ангіоневротичний набряк у пацієнтів, які отримували інгібітори АПФ, включаючи раміприл (див. розділ «Побічні реакції»). Ризик ангіоневротичного набряку (наприклад набряку дихальних шляхів або язика, з порушеннями дихання або без нього) підвищується у пацієнтів, які одночасно отримують лікарські засоби, що можуть спричинити ангіоневротичний набряк, такі як інгібітори мішені рапаміцину у ссавців (mTOR) (наприклад темсиролімус, еверолімус, сиролімус) або вілдагліптин, або інгібітори неприлізину (НЕП) (такі як рацекадотрил). Комбінація раміприлу з сакубітрилом/валсартаном протипоказана через підвищений ризик розвитку ангіоневротичного набряку (див. розділи «Протипоказання» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
У разі розвитку ангіоневротичного набряку застосування препарату ХАРТИЛ® РОЗ слід припинити. Потрібно негайно розпочати невідкладну терапію. Пацієнт повинен знаходитись під медичним наглядом протягом щонайменше 12−24 годин і може бути виписаний після повного зникнення симптомів.
У пацієнтів, які отримували інгібітори АПФ, включаючи раміприл, спостерігалися випадки ангіоневротичного набряку кишечнику (див. розділ «Побічні реакції»). Ці пацієнти скаржилися на біль у животі (з нудотою/блюванням або без них).
Анафілактичні реакції під час десенсибілізації
При застосуванні інгібіторів АПФ імовірність виникнення і тяжкість анафілактичних і анафілактоїдних реакцій на отруту комах та інші алергени збільшується. Перед проведенням десенсибілізації слід тимчасово припинити прийом лікарського засобу ХАРТИЛ® РОЗ.
Контроль електролітної рівноваги. Гіперкаліємія
У деяких пацієнтів, які отримували інгібітори АПФ, включаючи раміприл, спостерігалося виникнення гіперкаліємії. До групи ризику виникнення гіперкаліємії належать пацієнти із нирковою недостатністю, пацієнти віком від 70 років, пацієнти з неконтрольованим цукровим діабетом, пацієнти, які приймають солі калію, калійзберігаючі діуретики, а також інші активні речовини, що підвищують вміст калію у плазмі крові, або пацієнти із такими станами, як дегідратація, гостра серцева декомпенсація, метаболічний ацидоз. Якщо сумісне застосування вищезазначених препаратів вважається доцільним, то рекомендується регулярно контролювати рівень калію у плазмі крові (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Контроль електролітної рівноваги. Гіпонатріємія
У деяких пацієнтів, які отримували раміприл, спостерігався синдром неадекватної секреції антидіуретичного гормону з подальшим розвитком гіпонатріємії. Рекомендується регулярно контролювати рівень натрію у сироватці крові у осіб літнього віку та у інших пацієнтів, які мають ризик розвитку гіпонатріємії.
Нейтропенія/агранулоцитоз
Випадки нейтропенії/агранулоцитозу, а також тромбоцитопенії і анемії спостерігалися рідко. Також повідомлялося про пригнічення функції кісткового мозку. З метою виявлення можливої лейкопенії рекомендується контролювати кількість лейкоцитів у крові. Більш частий контроль бажано проводити на початку лікування та у разі наявності у пацієнта порушення функції нирок, супутнього колагенозу (наприклад системного червоного вовчака або склеродермії) або у разі застосування інших лікарських засобів, які можуть спричинити зміни картини крові (див. розділи «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Побічні реакції»).
Етнічні відмінності
Інгібітори АПФ частіше спричиняють ангіоневротичний набряк у пацієнтів негроїдної раси, ніж у представників інших рас. Як і щодо інших інгібіторів АПФ, гіпотензивна дія раміприлу може бути менш вираженою у пацієнтів негроїдної раси порівняно із представниками інших рас. Це може бути обумовлено тим, що у пацієнтів негроїдної раси з артеріальною гіпертензією частіше спостерігається артеріальна гіпертензія з низькою активністю реніну.
Кашель
При застосуванні інгібіторів АПФ повідомлялося про виникнення кашлю. Характерним є те, що кашель непродуктивний, тривалий і зникає після припинення терапії. При диференціальній діагностиці кашлю слід пам’ятати при можливість виникнення кашлю внаслідок застосування інгібіторів АПФ.
Вміст натрію
Цей лікарський засіб містить менше ніж 1 ммоль (23 мг) натрію на капсулу, тобто є практично вільним від натрію.
Застосування у період вагітності або годування груддю
Лікарський засіб протипоказано застосовувати у період вагітності або годування груддю. Жінки репродуктивного віку повинні використовувати належні засоби контрацепції (див. розділ «Протипоказання»).
Вагітність
Розувастатин
Оскільки холестерин та інші продукти біосинтезу холестерину відіграють істотну роль у розвитку плода, потенційний ризик від пригнічення ГМГ-КоА-редуктази перевищує користь від застосування лікарського засобу в період вагітності. Дані досліджень на тваринах щодо токсичного впливу на репродуктивну функцію обмежені. Якщо під час лікування цим лікарським засобом підтверджується вагітність, його застосування необхідно негайно припинити.
Раміприл
Епідеміологічні дані щодо ризику тератогенності після застосування інгібіторів АПФ у I триместрі вагітності не були переконливими; однак не можна виключити незначне підвищення ризику. Якщо продовження терапії інгібітором АПФ вважається необхідним, пацієнткам, які планують вагітність, необхідно перейти на альтернативний антигіпертензивний препарат, який має встановлений профіль безпеки для застосування у період вагітності. Якщо вагітність діагностовано, лікування інгібіторами АПФ слід негайно припинити і розпочати альтернативну терапію.
Відомо, що застосування інгібіторів АПФ у II і III триместрах вагітності спричиняє у людини фетотоксичність (зниження функції нирок, олігогідрамніон, затримка осифікації черепа) і неонатальну токсичність (ниркова недостатність, артеріальна гіпотензія, гіперкаліємія). Якщо інгібітор АПФ застосовують у ІІ триместрі вагітності, рекомендуюється ультразвукове дослідження функції нирок і черепа плода. Новонароджених, матері яких приймали інгібітори АПФ, слід ретельно обстежувати щодо розвитку артеріальної гіпотензії, олігурії та гіперкаліємії (див. розділи «Протипоказання» та «Особливості застосування»).
Годування груддю
Розувастатин
Розувастатин виділяється у молоко щурів. Даних щодо проникнення розувастатину у грудне молоко людини немає (див. розділ «Протипоказання»).
Раміприл
Через брак інформації щодо застосування раміприлу під час годування груддю (див. розділ «Фармакологічні властивості») не рекомендується призначати цей препарат жінкам, які годують груддю, та бажано надавати перевагу іншим лікарським засобам, застосування яких під час лактації є більш безпечним, особливо при грудному вигодовуванні новонароджених або недоношених немовлят.
Фертильність
Даних щодо впливу на фертильність немає.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Деякі побічні ефекти (наприклад симптоми зниження артеріального тиску, такі як запаморочення) можуть порушувати здатність пацієнта до концентрації уваги і знижувати швидкість його реакції, що є ризикованим у ситуаціях, коли ці якості мають особливо велике значення (наприклад при керуванні транспортними засобами або роботі з іншими механізмами).
Це, як правило, можливе на початку лікування або при переході з терапії іншими препаратами. Після прийому першої дози або подальшого підвищення дози не бажано керувати транспортним засобом або працювати з іншими механізмами протягом кількох годин.
Спосіб застосування та дози
Дозування
Рекомендована доза − 1 капсула на добу з відповідним вмістом діючих речовин.
ХАРТИЛ® РОЗ не підходить для початкової терапії. Початок лікування або, якщо необхідно, зміну дозування слід проводити тільки з титруванням доз кожного з компонентів препарату, а після встановлення відповідних доз можливий перехід на фіксовану комбінацію відповідної концентрації.
Пацієнт повинен дотримуватися стандартної дієти для зниження рівня холестерину, яку слід продовжувати під час лікування.
Лікарський засіб ХАРТИЛ® РОЗ не підходить пацієнтам, яким потрібен розувастатин у дозі 40 мг.
Пацієнти літнього віку
Рекомендована початкова доза для пацієнтів віком > 70 років становить 5 мг розувастатину (див. розділ «Особливості застосування»). Слід розглянути можливість зниження початкової дози раміприлу до 1,25 мг, подальше титрування дози раміприлу має бути більш поступовим, особливо у дуже старих та немічних пацієнтів.
ХАРТИЛ® РОЗ не підходить для початкової терапії. Початок лікування або, якщо необхідно, зміну дозування слід проводити тільки з титруванням доз кожного з компонентів препарату. Після встановлення відповідних доз можливий перехід на фіксовану комбінацію відповідної концентрації.
Пацієнти із порушенням функції нирок
ХАРТИЛ® РОЗ можна застосовувати пацієнтам із легкими або помірними порушеннями функції нирок.
Добова доза для пацієнтів з порушенням функції нирок залежить від показника кліренсу креатиніну (див. розділ «Фармакокінетика»).
Розувастатин:
- для пацієнтів з легкими та помірними порушеннями функції нирок немає необхідності у корекції дози.
Раміприл:
- якщо кліренс креатиніну становить ≥ 60 мл/хв, максимальна добова доза раміприлу – 10 мг;
- якщо кліренс креатиніну становить 30−60 мл/хв, максимальна добова доза раміприлу – 5 мг.
Фіксована комбінація не підходить для початкової терапії. Початок лікування або коригування дози у разі необхідності слід проводити лише з монокомпонентними препаратами.
Застосування препарату ХАРТИЛ® РОЗ пацієнтам з тяжким порушенням функції нирок протипоказано (див. розділ «Протипоказання» та «Фармакокінетика»).
Пацієнти з порушенням функції печінки
ХАРТИЛ® РОЗ не підходить для лікування пацієнтів з порушенням функції печінки, оскільки максимальна добова доза раміприлу у таких випадках повинна становити 2,5 мг.
ХАРТИЛ® РОЗ протипоказаний для пацієнтів з активними захворюваннями печінки (див. розділ «Протипоказання»).
Етнічні відмінності
У пацієнтів монголоїдної раси спостерігалася підвищена системна експозиція розувастатину (див. розділи «Особливості застосування» та «Фармакокінетика»). Рекомендована початкова доза розувастатину для пацієнтів монголоїдної раси становить 5 мг. ХАРТИЛ® РОЗ не підходить для початкової терапії. Початок лікування або коригування дози у разі необхідності слід проводити лише з монокомпонентними препаратами.
Генетичний поліморфізм
Певні типи генетичного поліморфізму можуть призводити до підвищення експозиції розувастатину (див. розділ «Фармакокінетика»). Пацієнтам із відомою наявністю таких типів поліморфізму рекомендується застосовувати меншу добову дозу лікарського засобу ХАРТИЛ® РОЗ.
Пацієнти, схильні до розвитку міопатії
Рекомендована початкова доза розувастатину для пацієнтів із факторами ризику розвитку міопатії становить 5 мг (див. розділ «Особливості застосування»). Фіксована комбінація не підходить для початкової терапії. Початок лікування або коригування дози у разі необхідності слід проводити лише з монокомпонентними препаратами.
Супутнє застосування
Розувастатин є субстратом різних транспортних білків (наприклад ОАТР1В1 та BCRP). Ризик міопатії (в тому числі рабдоміолізу) зростає при супутньому застосуванні препарату ХАРТИЛ® РОЗ із певними лікарськими засобами, що можуть підвищувати концентрацію розувастатину у плазмі внаслідок взаємодії із цими транспортними білками (наприклад циклоспорином та певними інгібіторами протеази, в тому числі комбінаціями ритонавіру з атазанавіром, лопінавіром та/або типранавіром; див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). Якщо можливо, слід розглянути застосування альтернативних лікарських засобів та у разі необхідності тимчасово перервати терапію лікарським засобом ХАРТИЛ® РОЗ. Якщо супутнього застосування цих лікарських засобів із препаратом ХАРТИЛ® РОЗ уникнути неможливо, слід ретельно зважити користь та ризик від супутнього застосування та відповідним чином відкорегувати дозу розувастатину (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Спосіб застосування
Препарат для перорального застосування.
Лікарський засіб ХАРТИЛ® РОЗ рекомендується приймати щодня в один і той самий час незалежно від прийому їжі.
Діти
Безпека та ефективність застосування лікарського засобу ХАРТИЛ® РОЗ дітям (віком до 18 років) не встановлені. Доступні на сьогодні дані представлено в розділі «Фармакодинаміка», але жодних рекомендацій щодо дозування дати не можна. Лікарський засіб ХАРТИЛ® РОЗ не рекомендується застосовувати дітям (віком до 18 років).
Передозування
Розувастатин
Специфічного лікування передозування немає. У разі передозування лікування симптоматичне, у разі необхідності слід вжити підтримуючих заходів. Потрібно контролювати функції печінки та рівні КК. Ефективність гемодіалізу малоймовірна.
Раміприл
Симптоми
Симптоми, спричинені передозуванням інгібіторів АПФ, можуть включати надмірну периферичну вазодилатацію (з вираженою артеріальною гіпотензією, шоком), брадикардію, електролітний дисбаланс, ниркову недостатність.
Лікування
За станом пацієнта слід ретельно спостерігати та проводити симптоматичну та підтримуючу терапію. До запропонованих лікувальних заходів належать первинна детоксикація (промивання шлунка, введення адсорбентів), а також заходи, спрямовані на відновлення стабільної гемодинаміки, в тому числі введення агоністів альфа-1 адренорецепторів або ангіотензину ІІ (ангіотензинаміду). Раміприлат, активний метаболіт раміприлу, погано виводиться з системного кровотоку шляхом гемодіалізу.
Побічні реакції
Розувастатин
Побічні реакції, що відзначаються при застосуванні розувастатину, зазвичай легкі та тимчасові. У контрольованих клінічних дослідженнях зафіксовано менше 4 % пацієнтів, які застосовували розувастатин та вийшли із дослідження через побічні реакції.
Як і при застосуванні інших інгібіторів ГМГ-КоА, частота побічних реакцій має тенденцію залежати від дози.
Вплив на нирки. Протеїнурія, переважно канальцевого походження, була виявлена у результаті аналізу за тест-смужками у пацієнтів, які застосовували розувастатин. Зміни вмісту білка у сечі від нуля або слідів до значення ++ або більше спостерігалися у < 1 % пацієнтів періодично в ході застосування в дозах 10 та 20 мг. Невелике збільшення частоти зміни вмісту від нуля або слідів до значення + спостерігалися при дозі 20 мг. В більшості випадків протеїнурія зменшувалася або зникала спонтанно при продовженні терапії. За даними клінічних досліджень та постмаркетингових спостережень на сьогодні не виявлено причинно-наслідкового зв’язку між протеїнурією та гострим або прогресуючим захворюванням нирок.
За даними клінічних досліджень гематурія дуже рідко спостерігалася у пацієнтів, які отримували розувастатин.
Вплив на скелетну мускулатуру. Ураження скелетної мускулатури, такі як міалгія, міопатія (в тому числі міозит) та зрідка рабдоміоліз із гострою нирковою недостатністю чи без неї, були відзначені при застосуванні будь-яких доз розувастатину, особливо при дозах > 20 мг.
У пацієнтів, які приймали розувастатин, спостерігалося дозозалежне зростання рівнів КК; в більшості випадків явище було слабким, асимптоматичним та тимчасовим. Якщо рівні КК підвищені (> 5 разів вище ВМН), лікування слід припинити (див. розділ «Особливості застосування»).
Вплив на печінку. Як і при застосуванні інших інгібіторів ГМГ-КоА–редуктази, у невеликої кількості пацієнтів, які приймали розувастатин, відзначалося дозозалежне збільшення рівня трансаміназ; у більшості випадків явище було слабким, асимптоматичним та тимчасовим.
На фоні застосування деяких статинів відзначалися такі небажані явища:
· Розлад статевої функції.
· Окремі випадки інтерстиціальної хвороби легень, особливо при тривалому застосуванні (див. розділ «Особливості застосування»).
Раміприл
Профіль безпеки раміприлу містить дані про постійний сухий кашель та реакції, спричинені артеріальною гіпотензією. До серйозних побічних реакцій належать ангіоневротичний набряк, гіперкаліємія, порушення функції печінки або нирок, панкреатит, тяжкі реакції з боку шкіри та нейтропенія/агранулоцитоз.
В таблиці 4 представлено побічні реакції, що спостерігалися при застосуванні розувастатину та раміприлу.
Побічні реакції розподілені за системами органів і частотою виникнення: дуже часто (≥ 1/10); часто (від ≥ 1/100 до < 1/10); нечасто (від ≥ 1/1 000 до < 1/100); рідко (від ≥ 1/10000 до < 1/1000); дуже рідко (< 1/10 000); невідомо (не можна розрахувати за наявними даними).
Таблиця 4
|
Система органів |
Побічні реакції |
Частота |
|
|
Розувастатин |
Раміприл |
||
|
З боку крові та лімфатичної системи |
Еозинофілія |
− |
Нечасто |
|
Тромбоцитопенія |
Рідко |
− |
|
|
Зменшення кількості лейкоцитів (включаючи нейтропенію або агранулоцитоз) |
− |
Рідко |
|
|
Зменшення кількості еритроцитів |
− |
Рідко |
|
|
Зниження рівня гемоглобіну |
− |
Рідко |
|
|
Зменшення кількості тромбоцитів |
− |
Рідко |
|
|
Недостатність кісткового мозку |
− |
Невідомо |
|
|
Панцитопенія |
− |
Невідомо |
|
|
Гемолітична анемія |
− |
Невідомо |
|
|
З боку імунної системи |
Реакції гіперчутливості, включаючи ангіоедему 1 |
Рідко |
Нечасто |
|
Анафілактичні або анафілактоїдні реакції |
− |
Невідомо |
|
|
Підвищення рівня антинуклеарних антитіл |
− |
Невідомо |
|
|
З боку ендокринної системи |
Цукровий діабет2 |
Часто |
− |
|
Синдром неадекватної секреції антидіуретичного гормону |
− |
Невідомо |
|
|
Метаболічні та аліментарні розлади |
Підвищення рівня калію у крові |
− |
Часто |
|
Анорексія |
− |
Нечасто |
|
|
Зниження апетиту |
− |
Нечасто |
|
|
Зниження рівня натрію у крові |
− |
Невідомо |
|
|
З боку психіки |
Зниження настрою |
− |
Нечасто |
|
Тривожність |
− |
Нечасто |
|
|
Нервовість |
− |
Нечасто |
|
|
Неспокій |
− |
Нечасто |
|
|
Порушення сну, включаючи сонливість |
− |
Нечасто |
|
|
Розлади сну (включаючи безсоння та нічні жахи) |
Невідомо |
− |
|
|
Стан сплутаної свідомості |
− |
Рідко |
|
|
Порушення уваги |
− |
Невідомо |
|
|
Депресія |
Невідомо |
− |
|
|
З боку нервової системи |
Головний біль |
Часто |
Часто |
|
Запаморочення |
Часто |
Часто |
|
|
Вертиго |
− |
Нечасто |
|
|
Парестезія |
− |
Нечасто |
|
|
Агевзія |
− |
Нечасто |
|
|
Дисгевзія |
− |
Нечасто |
|
|
Тремор |
− |
Рідко |
|
|
Порушення рівноваги |
− |
Рідко |
|
|
Поліневропатія |
Дуже рідко |
− |
|
|
Втрата пам’яті |
Дуже рідко |
− |
|
|
Церебральна ішемія, у тому числі ішемічний інсульт і транзиторна ішемічна атака |
− |
Невідомо |
|
|
Порушення психомоторних функцій |
− |
Невідомо |
|
|
Відчуття печіння |
− |
Невідомо |
|
|
Паросмія |
− |
Невідомо |
|
|
Периферична нейропатія |
Невідомо |
− |
|
|
Міастенія гравіс |
Невідомо |
− |
|
|
З боку органів зору |
Порушення зору, включаючи нечіткість зору |
− |
Нечасто |
|
Кон’юнктивіт |
− |
Рідко |
|
|
Очна міастенія |
Невідомо |
− |
|
|
З боку органів слуху та лабіринту |
Порушення слуху |
− |
Рідко |
|
Шум/дзвін у вухах |
− |
Рідко |
|
|
З боку серця |
Ішемія міокарда, включаючи стенокардію або інфаркт міокарда |
− |
Нечасто |
|
Тахікардія |
− |
Нечасто |
|
|
Аритмія |
− |
Нечасто |
|
|
Відчуття посиленого серцебиття |
− |
Нечасто |
|
|
Периферичні набряки |
− |
Нечасто |
|
|
З боку судин |
Артеріальна гіпотензія |
− |
Часто |
|
Ортостатичне зниження артеріального тиску |
− |
Часто |
|
|
Синкопе |
− |
Часто |
|
|
Припливи |
− |
Нечасто |
|
|
Стеноз судин |
− |
Рідко |
|
|
Гіпоперфузія |
− |
Рідко |
|
|
Васкуліт |
− |
Рідко |
|
|
Феномен Рейно |
− |
Невідомо |
|
|
З боку дихальної системи, органів грудної клітки та середостіння |
Непродуктивний подразнювальний кашель |
− |
Часто |
|
Бронхіт |
− |
Часто |
|
|
Синусит |
− |
Часто |
|
|
Задишка |
Невідомо |
Часто |
|
|
Бронхоспазм, у тому числі загострення астми |
− |
Нечасто |
|
|
Закладеність носа |
− |
Нечасто |
|
|
Кашель |
Невідомо |
− |
|
|
З боку шлунково-кишкового тракту |
Запальні явища у шлунково-кишковому тракті |
− |
Часто |
|
Розлади травлення |
− |
Часто |
|
|
Діарея |
Невідомо |
Часто |
|
|
Запор |
Часто |
Нечасто |
|
|
Нудота |
Часто |
Часто |
|
|
Блювання |
− |
Часто |
|
|
Абдомінальний біль |
Часто |
− |
|
|
Дискомфорт у животі |
− |
Часто |
|
|
Диспепсія |
− |
Часто |
|
|
Панкреатит3 |
Рідко |
Нечасто |
|
|
Підвищення рівня ферментів підшлункової залози |
− |
Нечасто |
|
|
Ангіоневротичний набряк тонкого кишечнику |
− |
Нечасто |
|
|
Біль у верхній частині живота, у т. ч. асоційований з гастритом |
− |
Нечасто |
|
|
Сухість у роті |
− |
Нечасто |
|
|
Глосит |
− |
Рідко |
|
|
Афтозний стоматит |
− |
Невідомо |
|
|
З боку гепатобіліарної системи |
Підвищення рівня печінкових ферментів і/або кон’югованого білірубіну |
− |
Нечасто |
|
Підвищення рівня печінкових трансаміназ |
Рідко |
− |
|
|
Холестатична жовтяниця |
− |
Рідко |
|
|
Ураження печінкових клітин |
− |
Рідко |
|
|
Жовтяниця |
Дуже рідко |
− |
|
|
Гепатит |
Дуже рідко |
− |
|
|
Гостра печінкова недостатність |
− |
Невідомо |
|
|
Холестатичний або цитолітичний гепатит (у дуже виняткових випадках – з летальним наслідком) |
− |
Невідомо |
|
|
З боку шкіри та підшкірної клітковини |
Висипання, зокрема макуло-папульозні |
− |
Часто |
|
Висип |
Нечасто |
− |
|
|
Свербіж |
Нечасто |
Нечасто |
|
|
Гіпергідроз |
− |
Нечасто |
|
|
Ексфоліативний дерматит |
− |
Рідко |
|
|
Кропив’янка |
Нечасто |
Рідко |
|
|
Оніхолізис |
− |
Рідко |
|
|
Реакція фоточутливості |
− |
Дуже рідко |
|
|
Токсичний епідермальний некроліз |
− |
Невідомо |
|
|
Синдром Стівенса – Джонсона |
Невідомо |
Невідомо |
|
|
Лікарська реакція з еозинофілією та системними проявами (DRESS) |
Невідомо |
− |
|
|
Мультиформна еритема |
− |
Невідомо |
|
|
Пемфігус |
− |
Невідомо |
|
|
Загострення перебігу псоріазу |
− |
Невідомо |
|
|
Псоріатичний дерматит |
− |
Невідомо |
|
|
Пемфігоїдна або ліхеноїдна екзантема або енантема |
− |
Невідомо |
|
|
Алопеція |
− |
Невідомо |
|
|
З боку опорно-рухового апарату та сполучної тканини |
Міалгія |
Часто |
Часто |
|
М’язові спазми |
− |
Часто |
|
|
Міопатія (включно із міозитом) |
Рідко |
− |
|
|
Рабдоміоліз |
Рідко |
− |
|
|
Вовчакоподібний синдром |
Рідко |
||
|
Розрив м’язів |
Рідко |
||
|
Артралгія |
Дуже рідко |
Нечасто |
|
|
Захворювання сухожиль, іноді ускладнені розривом |
Невідомо |
− |
|
|
Імунообумовлена некротична міопатія (IMНМ) |
Невідомо |
− |
|
|
З боку нирок та сечовидільної системи |
Гематурія |
Дуже рідко |
− |
|
Порушення функції нирок, включаючи гостру ниркову недостатність |
− |
Нечасто |
|
|
Збільшення діурезу |
− |
Нечасто |
|
|
Погіршення перебігу фонової протеїнурії |
− |
Нечасто |
|
|
Підвищення рівня сечовини у крові |
− |
Нечасто |
|
|
Підвищення рівня креатиніну у крові |
− |
Нечасто |
|
|
З боку репродуктивної системи та молочних залоз |
Транзиторна еректильна імпотенція |
− |
Нечасто |
|
Зниження лібідо |
− |
Нечасто |
|
|
Гінекомастія |
Дуже рідко |
Невідомо |
|
|
Загальні порушення |
Біль у грудях |
− |
Часто |
|
Втомлюваність |
− |
Часто |
|
|
Пірексія |
− |
Нечасто |
|
|
Астенія |
Часто |
Рідко |
|
|
Набряк |
Невідомо |
− |
|
1 У дуже виняткових випадках – обструкція дихальних шляхів внаслідок ангіоневротичного набряку може мати летальний наслідок.
2 Частота залежить від наявності або відсутності факторів ризику (рівень глюкози крові натще ≥ 5,6 ммоль/л, ІМТ > 30 кг/м2, підвищення рівня тригліцеридів, артеріальна гіпертензія в анамнезі).
3 У поодиноких випадках повідомлялося про летальні наслідки при застосуванні інгібіторів АПФ.
Звітування про підозрювані побічні реакції
Звітування про підозрювані побічні реакції після реєстрації лікарського засобу має велике значення. Це дає змогу проводити безперервне спостереження за співвідношенням користі та ризиків, пов’язаних із застосуванням лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності
3 роки.
Умови зберігання
Зберігати при температурі не вище 25 °C.
Зберігати в оригінальній упаковці для захисту від дії світла та вологи.
Зберігати у недоступному для дітей місці.
Упаковка
По 10 капсул у блістері; по 3 блістери у картонній коробці.
Категорія відпуску. За рецептом.
Виробник
ЗАТ Фармацевтичний завод ЕГІС, Угорщина.
Місцезнаходження виробника та адреса місця провадження його діяльності
1165, м. Будапешт, вул. Бекеньфелді, 118-120, Угорщина.
9900, м. Керменд, вул. Матяш кірай, 65, Угорщина.
