СКАЙРІЗІ
-
Швейцарія ЕббВі Біофармасьютікалз ГмбХФорма выпуска: розчин для ін'єкцій по 150 мг/1 мл; 1 попередньо наповнений скляний шприц, вмонтований у автоінжектор; по одному автоінжектору у картонній коробСостав: 1 автоінжектор містить 150 мг рісанкізумабу в 1 мл розчинуУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/17970/01/02код АТХ: L04AC18Срок годности: 2 роки
-
Швейцарія ЕббВі Біофармасьютікалз ГмбХФорма выпуска: розчин для ін'єкцій по 150 мг/1 мл; 1 попередньо наповнений скляний шприц, вмонтований у автоінжектор; по одному автоінжектору у картонній коробСостав: 1 автоінжектор містить 150 мг рісанкізумабу в 1 мл розчинуУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/17970/01/02код АТХ: L04AC18Срок годности: 2 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
СКАЙРІЗІ
Склад:
діюча речовина: рісанкізумаб;
1 автоінжектор містить 150 мг рісанкізумабу в 1 мл розчину;
допоміжні речовини: натрію ацетат, тригідрат; оцтова кислота, трегалози дигідрат, полісорбат-20, вода для ін’єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: безбарвний або жовтий розчин від прозорого до злегка опалесцентного.
Фармакотерапевтична група.
Імуносупресанти. Інгібітори інтерлейкіну. Рісанкізумаб. Код АТХ L04A C18.
Фармакологічні властивості.
Фармакодинаміка.
Рісанкізумаб – це гуманізоване моноклональне антитіло, імуноглобулін G1 (IgG1), із селективною дією відносно білка інтерлейкіну 23 (IL-23), вироблене з клітин яєчника китайського хом’яка з використанням технології рекомбінантної ДНК.
Механізм дії
Рісанкізумаб – це гуманізоване моноклональне антитіло, імуноглобулін G1 (IgG1), яке з високою спорідненістю зв’язується із субодиницею р19 цитокіну інтерлейкіну 23 (IL-23) людини без зв’язування з IL-12 та інгібує його взаємодію з рецепторним комплексом IL-23. IL-23 – це цитокін, задіяний у запальних та імунних відповідях. Блокуючи IL-23 від зв’язування з його рецептором, рісанкізумаб інгібує IL-23-залежну клітинну сигналізацію і вивільнення прозапальних цитокінів.
Фармакодинамічні ефекти
У дослідженні за участю пацієнтів із псоріазом експресія генів, пов’язаних з віссю IL-23/IL-17, знижувалася в шкірі після одноразових доз рісанкізумабу. Також при псоріатичних ураженнях спостерігали зниження товщини епідермісу, інфільтрації запальних клітин та експресії маркерів псоріатичного захворювання.
У дослідженні за участю пацієнтів із псоріатичним артритом, під час якого рісанкізумаб у дозі 150 мг вводили підшкірно на тижні 0, тижні 4 та надалі кожні 12 тижнів, на 24-му тижні спостерігалося статистично та клінічно значуще зниження рівня IL-23- та IL-17-асоційованих біомаркерів, зокрема рівнів IL-17A, IL-17F та IL-22 в сироватці крові, порівняно з вихідними значеннями.
Клінічна ефективність та безпека
Бляшковий псоріаз
Ефективність та безпеку рісанкізумабу оцінювали за даними 2109 пацієнтів з помірним або тяжким бляшковим псоріазом під час чотирьох багатоцентрових, рандомізованих, подвійно сліпих досліджень (ULTIMMA-1, ULTIMMA-2, IMMHANCE та IMMVENT). Включені у ці дослідження пацієнти були віком від 18 років, мали бляшковий псоріаз на ≥ 10 % площі поверхні тіла (ППТ), статичну Глобальну оцінку лікарем (sPGA) ≥ 3 балів при загальній оцінці псоріазу (товщина бляшок/індурація, еритема і лущення) за шкалою тяжкості від 0 до 4, оцінку за Індексом площі псоріазу та тяжкості стану (PASI) ≥ 12 балів і були кандидатами на системну терапію або фототерапію.
Загалом на момент оцінки вихідного стану пацієнтів медіана оцінки PASI становила 17,8 бала, медіана ураженої ППТ – 20,0 %, а медіана DLQI – 13,0. При оцінці вихідного стану за sPGA стан класифіковано як тяжкий у 19,3 % пацієнтів і як середнього ступеня у 80,7 % пацієнтів. У цілому 9,8 % суб’єктів дослідження мали в анамнезі діагностований псоріатичний артрит.
За даними всіх досліджень 30,9 % пацієнтів не отримували раніше системної терапії (у т. ч. небіологічними та біологічними лікарськими засобами), 38,1 % отримували попередню фототерапію чи фотохіміотерапію, 48,3 % отримували раніше системну терапію небіологічними лікарськими засобами, 42,1 % отримували попередню терапію біологічними лікарськими засобами, а 23,7 % вже проходили лікування щонайменше одним інгібітором ФНП-альфа для лікування псоріазу.
Фармакокінетика.
Фармакокінетика рісанкізумабу була подібною у пацієнтів з бляшковим псоріазом і пацієнтів із псоріатичним артритом.
Абсорбція
Рісанкізумаб демонстрував лінійну фармакокінетику з дозозалежним збільшенням експозиції в межах доз від 18 до 300 мг та від 0,25 до 1 мг/кг при підшкірному введенні, а також від 200 до 1200 мг та від 0,01 до 5 мг/кг при внутрішньовенному введенні.
Після підшкірного застосування рісанкізумабу максимальна концентрація у плазмі крові (Cmax) була досягнута через 3–14 днів після введення дози, при цьому розрахункова абсолютна біодоступність становила 89 %. При застосуванні рісанкізумабу в дозі 150 мг на тижні 0, тижні 4, а потім кожні 12 тижнів розрахункові концентрації рісанкізумабу в плазмі крові при досягненні рівноважного стану та залишкові концентрації рісанкізумабу в плазмі крові становили 12 і 2 мкг/мл відповідно.
Було показано біоеквівалентність введення однократної ін’єкції рісанкізумабу 150 мг та двох ін’єкцій по 75 мг у попередньо наповненому шприці. Також була продемонстрована біоеквівалентність 150 мг рісанкізумабу у попередньо наповненому шприці та автоінжекторі.
Розподіл
Середній (± стандартне відхилення) об’єм розподілу (Vss) рісанкізумабу при досягненні рівноважного стану становив 11,4 (±2,7) л у дослідженнях фази 3 за участю пацієнтів з псоріазом, що свідчить про те, що розподіл рісанкізумабу здебільшого обмежується судинними та інтерстиціальними просторами.
Біотрансформація
Терапевтичні моноклональні антитіла IgG зазвичай розкладаються на малі пептиди і амінокислоти катаболічними шляхами так само, як і ендогенні IgG. Не очікується, що рісанкізумаб метаболізуватиметься ферментами цитохрому Р450.
Виведення
Середній (± стандартне відхилення) системний кліренс (CL) рісанкізумабу становив 0,3 (±0,1) л/добу у дослідженнях фази 3 за участю пацієнтів із псоріазом. Середній період напіввиведення рісанкізумабу варіював від 28 до 29 днів у дослідженнях фази 3 за участю пацієнтів із псоріазом.
Не очікується, що рісанкізумаб як моноклональне антитіло IgG1 фільтруватиметься шляхом клубочкової фільтрації в нирках або виводитиметься у вигляді незміненої молекули із сечею.
Лінійність/нелінійність
Рісанкізумаб демонстрував лінійну фармакокінетику з приблизно дозопропорційним збільшенням системної експозиції (Cmax та AUC) в оцінюваних діапазонах доз від 18 до 300 мг або від 0,25 до 1 мг/кг при підшкірному введенні здоровим добровольцям або пацієнтам із псоріазом.
Взаємодії
Дослідження взаємодії з лікарськими засобами проводили за участю пацієнтів з бляшковим псоріазом з метою оцінки впливу повторного введення рісанкізумабу на фармакокінетику субстратів, чутливих до цитохрому Р450 (CYP). Вплив кофеїну (субстрат CYP1A2), варфарину (субстрат CYP2C9), омепразолу (субстрат CYP2C19), метопрололу (субстрат CYP2D6) та мідазоламу (субстрат CYP3A) після лікування рісанкізумабом був порівнянним з їхньою експозицією до лікування рісанкізумабом, що вказує на відсутність клінічно значущої взаємодії через ці ферменти.
Популяційні фармакокінетичні аналізи показали, що на експозицію рісанкізумабу не впливало супутнє лікування, яке застосовували деякі пацієнти з бляшковим псоріазом або псоріатичним артритом під час клінічних досліджень.
Особливі популяції пацієнтів
Діти
Фармакокінетика рісанкізумабу у дітей встановлена не була.
Пацієнти літнього віку
З 2234 пацієнтів із бляшковим псоріазом, які отримували лікування рісанкізумабом, 243 особи були віком від 65 років, а 24 – віком від 75 років. З 1542 пацієнтів із псоріатичним артритом, які отримували рісанкізумаб, 246 були віком від 65 років, а 34 пацієнти – віком від 75 років. Загальних відмінностей в експозиції рісанкізумабу у пацієнтів старшого та молодшого віку, які отримували рісанкізумаб, не спостерігали.
Пацієнти з нирковою або печінковою недостатністю
Не було проведено жодних спеціальних досліджень для визначення впливу ниркової або печінкової недостатності на фармакокінетику рісанкізумабу. За даними популяційних фармакокінетичних аналізів, рівень креатиніну в сироватці крові, кліренс креатиніну або маркери печінкової функції (АЛТ/АСТ/білірубін) не впливали на кліренс рісанкізумабу у пацієнтів із бляшковим псоріазом чи псоріатичним артритом.
Як моноклональне антитіло IgG1 рісанкізумаб переважно виводиться шляхом внутрішньоклітинного катаболізму, а відтак, не очікується метаболізму через печінкові ферменти цитохрому Р450 або елімінації нирками.
Маса тіла
Кліренс рісанкізумабу та об’єм розподілу підвищуються зі збільшенням маси тіла, що може призвести до зниження ефективності у пацієнтів з великою масою тіла (> 130 кг). Однак це спостереження базується на даних щодо обмеженої кількості пацієнтів. На сьогодні не рекомендовано коригувати дозу з огляду на масу тіла.
Стать або раса
У дорослих пацієнтів із бляшковим псоріазом чи псоріатичним артритом стать або раса суттєво не впливали на кліренс рісанкізумабу. У клінічному фармакокінетичному дослідженні не виявлено клінічно значущих відмінностей експозиції рісанкізумабу у китайців або японців порівняно з представниками європеоїдної раси.
Доклінічні дані з безпеки
На доклінічному етапі не виявлено особливої небезпеки для людини за даними досліджень токсичності, зокрема при вивченні фармакології безпеки, а також репродуктивної токсичності у яванських макак, при повторному застосуванні рісанкізумабу у дозах до 50 мг/кг на тиждень (що забезпечує експозицію, яка в 70 разів перевищує експозицію у людини при максимальній рекомендованій дозі для людини [МРДЛ]).
Дослідження мутагенності та канцерогенності рісанкізумабу не проводили. У 26-тижневому дослідженні токсичності при тривалому застосуванні рісанкізумабу в дозах до 50 мг/кг/тиждень (приблизно в 70 разів перевищує експозицію у людини при МРДЛ) не спостерігалося жодного передракового або неопластичного ураження, несприятливих проявів імунотоксичності або впливу на серцево-судинну систему.
Клінічні характеристики.
Показання.
Бляшковий псоріаз
Лікування помірного або тяжкого бляшкового псоріазу у дорослих, яким показана системна терапія.
Псоріатичний артрит
Лікарський засіб Скайрізі, окремо або в комбінації з метотрексатом (MTX), показаний для лікування псоріатичного артриту в активній фазі у дорослих пацієнтів, у яких відзначалася непереносимість або неадекватна відповідь на один чи декілька хворобомодифікуючих антиревматичних препаратів (ХМАРП).
Протипоказання.
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин лікарського засобу.
Клінічно важливі інфекції в активній формі (наприклад, активна форма туберкульозу).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Не очікується, що рісанкізумаб метаболізується печінковими ферментами або виводиться нирками. Не очікується взаємодії рісанкізумабу з інгібіторами, індукторами чи субстратами ферментів, які метаболізують лікарські засоби, а тому коригування дози не потрібне.
Супутня імуносупресивна терапія або фототерапія
Безпека й ефективність рісанкізумабу при його застосуванні разом з імунодепресантами, зокрема біологічними лікарськими засобами або фототерапією, не оцінювалися.
Особливості застосування.
Відстеження
Для покращення відстеження біологічних лікарських засобів слід чітко документувати назву і номер серії введеного лікарського засобу.
Інфекції
Рісанкізумаб може підвищити ризик інфекції.
Рісанкізумаб слід з обережністю застосовувати пацієнтам із хронічною інфекцією, рецидивуючою інфекцією в анамнезі або відомими факторами ризику інфекції. Лікування рісанкізумабом не слід розпочинати у пацієнтів з будь-якою клінічно важливою інфекцією в активній формі, допоки вона не минула або не була адекватно пролікована.
Пацієнтів, які отримують рісанкізумаб, слід проінструктувати про необхідність звернення до лікаря у разі появи симптомів клінічно важливої хронічної або гострої інфекції. У разі розвитку такої інфекції або за відсутності відповіді на стандартне лікування інфекції стан пацієнта необхідно ретельно контролювати, при цьому рісанкізумаб не призначають, допоки інфекція не минула.
Туберкульоз
Перед початком лікування рісанкізумабом стан пацієнтів слід оцінити на наявність туберкульозу. Стан пацієнтів, які отримують рісанкізумаб, слід контролювати щодо появи симптомів активної форми туберкульозу. До початку лікування рісанкізумабом потрібно розглянути необхідність застосування протитуберкульозної терапії пацієнтам з латентною або активною формою туберкульозу в анамнезі, щодо яких проходження адекватного курсу лікування не підтверджено.
Імунізація
До початку терапії рісанкізумабом необхідно завершити відповідну імунізацію згідно з поточними рекомендаціями щодо її проведення. Якщо пацієнт отримав вакцинацію живою вакциною (вірусною чи бактеріальною), рекомендується почекати щонайменше 4 тижні до початку лікування рісанкізумабом. Пацієнтам, які проходили лікування рісанкізумабом, не слід застосовувати живі вакцини під час лікування, а також протягом щонайменше 21 тижня після лікування рісанкізумабом (див. розділ «Фармакокінетика»).
Підвищена чутливість
У разі розвитку серйозної реакції підвищеної чутливості рісанкізумаб негайно відміняють і розпочинають відповідну терапію.
Допоміжні речовини з відомим ефектом
Цей лікарський засіб містить менше 1 ммоль натрію (23 мг) на дозу 150 мг, тобто практично вільний від натрію.
Застосування у період вагітності або годування груддю.
Жінки репродуктивного віку
Жінкам репродуктивного віку слід використовувати ефективний спосіб контрацепції під час лікування, а також протягом щонайменше 21 тижня після лікування.
Вагітність
Даних щодо застосування рісанкізумабу вагітним жінкам немає або ці дані обмежені (менш ніж 300 результатів вагітності). Дослідження на тваринах не довели прямого або опосередкованого шкідливого впливу з точки зору репродуктивної токсичності. Як запобіжний захід бажано уникати застосування рісанкізумабу під час вагітності.
Годування груддю
Невідомо, чи потрапляє рісанкізумаб у грудне молоко. Відомо, що людські IgG потрапляють у грудне молоко протягом перших декількох днів після народження дитини і незабаром поступово зменшуються до низьких концентрацій. Отже, у цей короткий період не можна виключити ризик для немовляти, що перебуває на грудному вигодовуванні. Необхідно прийняти рішення щодо відміни/відмови від терапії рісанкізумабом, беручи до уваги користь від грудного вигодовування для дитини і користь терапії рісанкізумабом для матері.
Фертильність
Вплив рісанкізумабу на фертильність людини не оцінювався. Дослідження на тваринах не довели прямих або опосередкованих шкідливих наслідків з точки зору фертильності.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Рісанкізумаб не впливає або незначно впливає на здатність керувати транспортними засобами або працювати з іншими автоматизованими системами.
Спосіб застосування та дози.
Лікарський засіб Скайрізі слід застосовувати під керівництвом і наглядом лікаря, який має досвід діагностики та лікування станів, при яких показано застосування Скайрізі.
Дози
Рекомендована доза становить 150 мг, що вводиться шляхом підшкірної ін’єкції у тиждень 0, тиждень 4, а потім кожні 12 тижнів (або дві ін’єкції по 75 мг у попердньо наповнених шприцах, або одна ін’єкція 150 мг у автоінжекторі).
Для пацієнтів, які не відповідають на лікування після 16 тижнів терапії, слід розглянути доцільність відміни цього лікарського засобу. У деяких пацієнтів із бляшковим псоріазом і з частковою відповіддю може згодом спостерігатися покращення при лікуванні понад 16 тижнів.
Пропуск дози
У разі пропуску дози цей лікарський засіб застосовують якнайшвидше. Після цього лікарський засіб застосовують регулярно за звичайною схемою.
Особливі групи пацієнтів
Пацієнти літнього віку (віком від 65 років)
Корегування дози не потрібне.
Інформація про застосування цього лікарського засобу пацієнтам віком ≥ 65 років обмежена.
Пацієнти з нирковою або печінковою недостатністю
Жодних конкретних досліджень для оцінки впливу печінкової або ниркової недостатності на фармакокінетику лікарського засобу Скайрізі проведено не було. Загалом не очікується, що ці стани мають будь-який значний вплив на фармакокінетику моноклональних антитіл, а тому коригування дози не вважається необхідним.
Діти
Безпека та ефективність застосування рісанкізумабу дітям та підліткам віком від 5 до 18 років ще не встановлені. Дані відсутні.
Дані про відповідне застосування рісанкізумабу дітям віком до 6 років за показанням помірний або тяжкий бляшковий псоріаз або дітям віком до 5 років за показанням псоріатичний артрит відсутні.
Пацієнти з надмірною масою тіла
Корегування дози не потрібне.
Спосіб застосування
Лікарський засіб Скайрізі вводять шляхом підшкірної ін’єкції. Ін’єкцію слід робити в стегно або живіт. При введенні ін’єкцій пацієнтам слід уникати ділянок чутливої шкіри, синців, еритематозної, ущільненої чи ураженої псоріазом шкіри.
Пацієнти можуть самостійно вводити собі лікарський засіб Скайрізі після проходження ними навчання техніці підшкірної ін’єкції. Пацієнтів слід проінструктувати про необхідність прочитати інструкцію щодо самостійного введення, яка наведена в інструкції для медичного застосування лікарського засобу Скайрізі.
Введення лікарського засобу Скайрізі у верхню зовнішню частину руки може проводити лише медичний працівник або особа, яка доглядає пацієнта.
Інструкція щодо самостійного введення
Автоінжектор
Зелена кнопка-активатор Контрольне віконце Голка Темно-сірий захисний ковпачок
(не знімати до моменту введення ін’єкції)
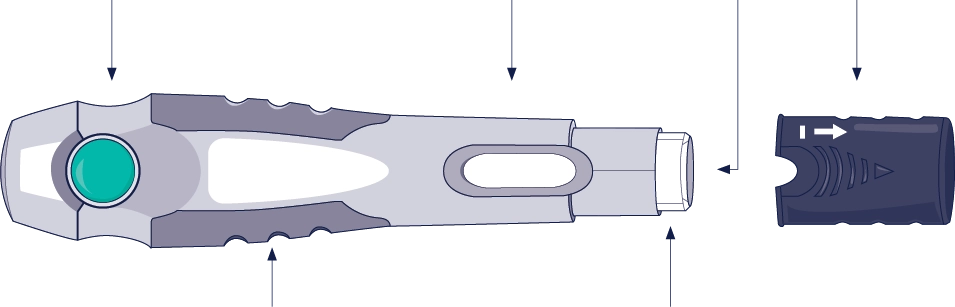
Сірий упор для пальців Білий рукав голки
Важлива інформація, яку необхідно знати до введення лікарського засобу Скайрізі
· Перед ін’єкцією Ви повинні пройти навчання щодо того, як правильно робити ін’єкцію лікарського засобу Скайрізі. Проконсультуйтеся зі своїм лікарем, фармацевтом або медсестрою, якщо Вам потрібна допомога.
· Позначте дати у своєму календарі, щоб знати, коли потрібно ввести лікарський засіб Скайрізі.
· Тримайте лікарський засіб Скайрізі в оригінальній картонній коробці для захисту від світла до моменту його застосування.
· Перед проведенням ін’єкції вийміть картонну коробку з автоінжектором з холодильника та залиште при кімнатній температурі, уникаючи прямих сонячних променів, на 30–90 хвилин перед введенням ін’єкції. Не виймайте автоінжектор з коробки до досягнення ним кімнатної температури. Лікарський засіб Скайрізі не можна нагрівати у жодний інший спосіб (наприклад, у мікрохвильовій пічці або у гарячій воді).
· Не вводьте лікарський засіб, якщо у контрольному віконці Ви бачите, що рідина каламутна або містить пластівці чи великі частинки. Рідина повинна виглядати прозорою або жовтою і може містити дрібні білі або прозорі частинки.
· Не струшуйте автоінжектор.
· Знімайте ковпачок безпосередньо перед введенням.
Не застосовуйте цей лікарський засіб:
· якщо закінчився його термін придатності;
· якщо рідину заморожували (навіть якщо вона розтанула);
· якщо автоінжектор впав чи пошкоджений;
· якщо порушено цілісність картонної упаковки.
Дотримуйтеся покрокової інструкції щоразу, коли застосовуєте лікарський засіб Скайрізі.
|
КРОК 1 Покладіть на чисту рівну поверхню: • 1 автоінжектор; • 1 серветку, просякнуту спиртом, та ватну кульку (не вкладені до картонної коробки). Вимийте і висушіть руки. |
|
|
КРОК 2 Ділянки для ін’єкцій 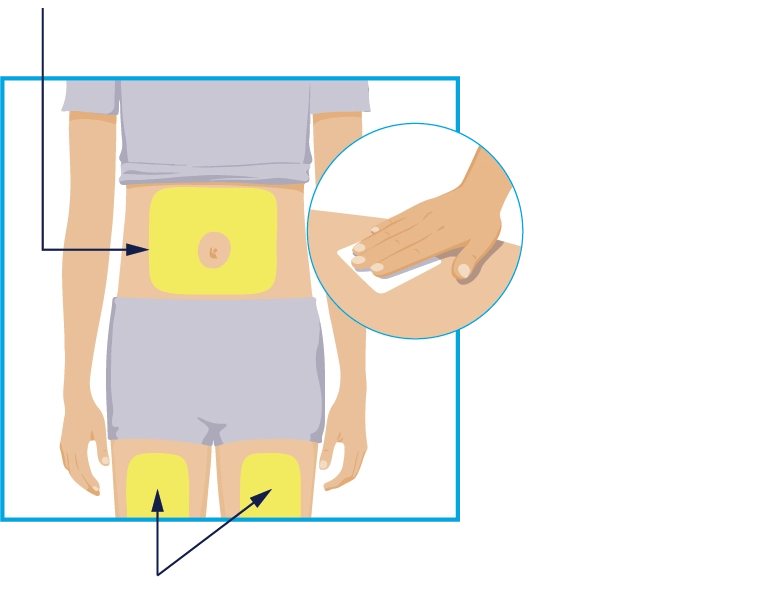
Ділянки для ін’єкцій |
Для введення ін’єкції лікарського засобу оберіть одну з цих 3 ділянок: • передня частина лівого стегна; • передня частина правого стегна; • живіт на відстані не менше 5 см від пупка. Перед ін’єкцією протріть спиртовою серветкою круговими рухами ділянку, куди Ви будете вводити лікарський засіб. • Не торкайтеся та не дмухайте на продезінфіковану ділянку шкіри. Дайте шкірі висохнути перед введенням ін’єкції. • Не вводьте лікарський засіб через одяг. • Не вводьте лікарський засіб у шкіру, яка болить, де є синець, почервоніння, яка є ущільненою чи має шрами або розтяжки. · Не вводьте лікарський засіб у ділянки, уражені псоріазом. |
|
КРОК 3 Перевірте рідину 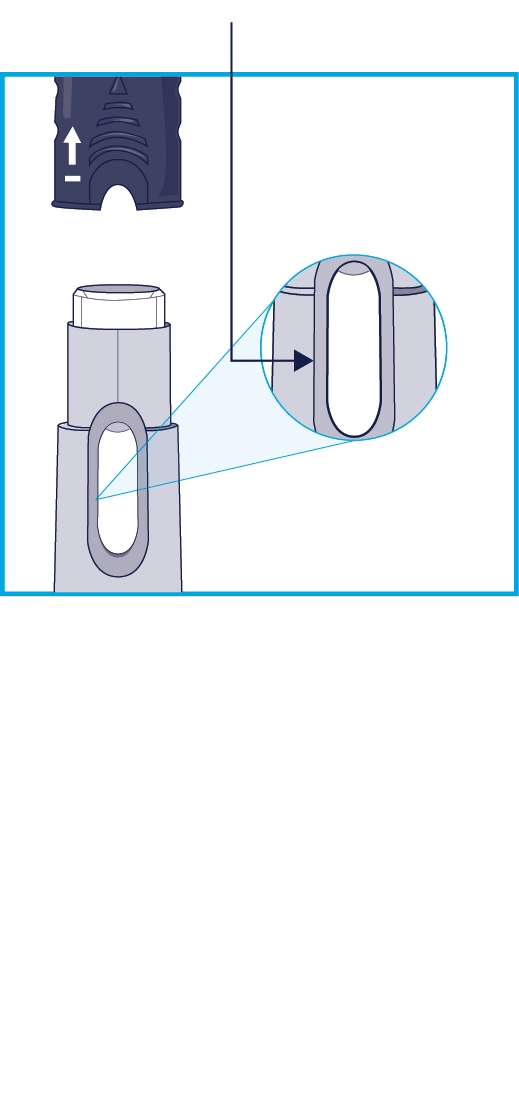
|
Тримайте автоінжектор захисним ковпачком доверху, як показано на рисунку. · Зніміть захисний ковпачок. · Перевірте рідину в автоінжекторі через контрольне віконце. • Нормально бачити бульбашки у віконці. • Рідина має виглядати прозорою або жовтою і може містити дрібні білі або прозорі частинки. • Не застосовуйте лікарський засіб, якщо рідина каламутна або містить пластівці чи великі частинки. |
|
КРОК 4 Стегно або живіт 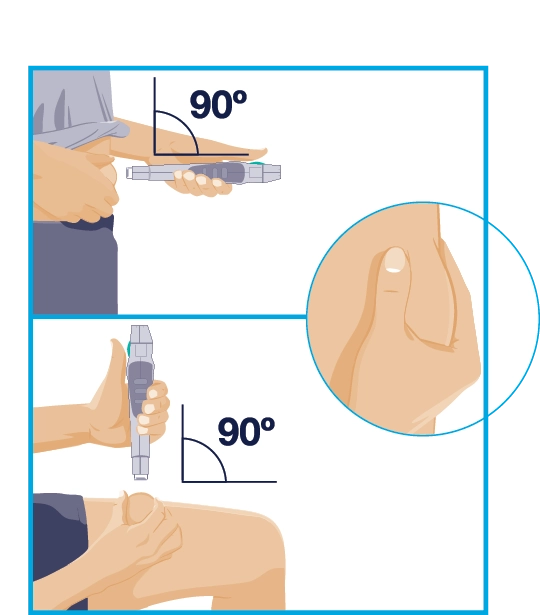
|
Тримайте автоінжектор за упор для пальців та розверніть його таким чином, щоб рукав голки був направлений у місце ін’єкції, а Ви могли бачити зелену кнопку-активатор. Іншою рукою обережно візьміть ділянку очищеної шкіри у складку і міцно утримуйте її. Розташуйте рукав голки під кутом 90º до складки шкіри. |
|
КРОК 5 Перший «клік» 15 секунд 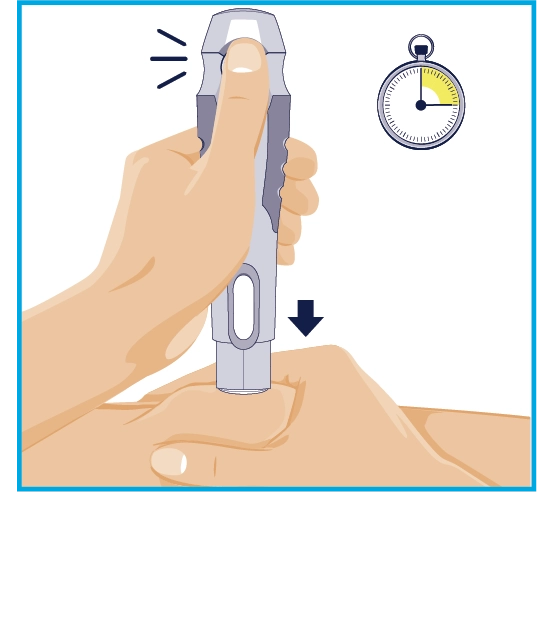
|
Тримайте автоінжектор таким чином, щоб бачити зелену кнопку-активатор та контрольне віконце. Притисніть рукав голки до складки шкіри у місці ін’єкції та утримуйте. • Автоінжектор активується, лише якщо рукав голки притиснутий до місця ін’єкції перед натисканням зеленої кнопки-активатора. Натисніть зелену кнопку-активатор та утримуйте автоінжектор протягом 15 секунд. • Гучний «клік» свідчить про початок введення. |
|
КРОК 6 Другий «клік» 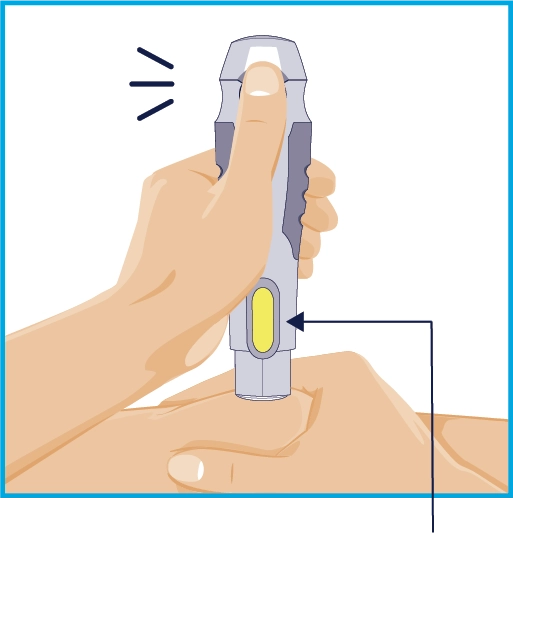
Жовтий індикатор |
Продовжуйте притискати автоінжектор до місця ін’єкції. Ін’єкція завершена, коли: • автоінжектор зробив другий «клік» або • жовтий індикатор заповнив контрольне віконце. Це займає до 15 секунд. |
|
КРОК 7 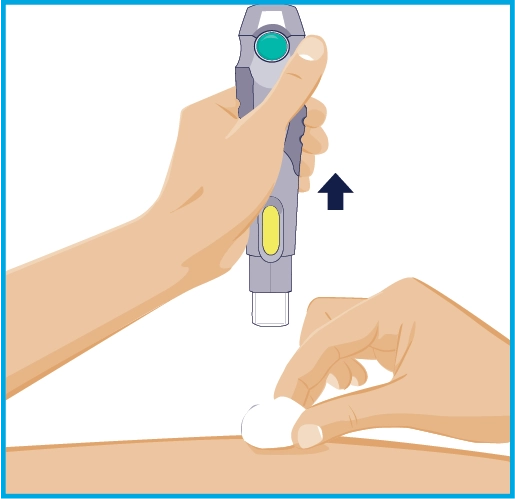
|
Після завершення ін’єкції повільно витягніть голку автоінжектора зі шкіри. Голка сховається в рукаві і зробить ще один «клік». Після завершення ін’єкції покладіть ватну кульку на шкіру в місці ін’єкції. • Не тріть місце ін’єкції. · Невелика кровотеча в місці ін’єкції є нормою. |
|
КРОК 8 • Не викидайте використаний автоінжектор разом із побутовим сміттям. • Ваш лікар, фармацевт або медсестра розкаже Вам, як утилізувати використаний автоінжектор відповідно до вимог чинного законодавства. |
|
Діти.
Безпека й ефективність застосування рісанкізумабу дітям та підліткам віком від 5 до 18 років не встановлені. Дані відсутні.
Дані про відповідне застосування рісанкізумабу дітям віком до 6 років за показанням помірний або тяжкий бляшковий псоріаз або дітям віком до 5 років за показанням псоріатичний артрит відсутні.
Передозування.
У разі передозування рекомендовано контролювати стан пацієнта щодо виникнення будь-яких симптомів побічних реакцій і негайно призначити відповідне симптоматичне лікування.
Побічні реакції.
Короткий опис профілю безпеки
Найчастішими побічними реакціями були інфекції верхніх дихальних шляхів, які спостерігали у 13 % пацієнтів.
Перелік побічних реакцій у формі таблиці
Побічні реакції на рісанкізумаб у клінічних дослідженнях (див. таблицю) застосування при псоріазі та псоріатичному артриті представлено за класами систем органів згідно з термінологією MedDRA і за частотою: дуже часто (≥ 1/10), часто (≥ 1/100 і < 1/10), нечасто (≥ 1/1000 і < 1/100), рідко (≥ 1/10 000 і < 1/1 000), дуже рідко (< 1/10 000), частота невідома (не може бути визначена на основі наявних даних).
Перелік побічних реакцій
|
Клас систем органів |
Частота |
Побічні реакції |
|
Інфекції та інвазії |
Дуже часто |
Інфекції верхніх дихальних шляхів a |
|
Часто |
Лишайні інфекціїb |
|
|
Нечасто |
Фолікуліт |
|
|
З боку нервової системи |
Часто |
Головний більc |
|
З боку шкіри та підшкірної клітковини |
Часто |
Свербіж Висип |
|
Частота невідома |
Кропив’янка |
|
|
Загальні порушення та ускладнення в місці введення |
Часто |
Втомлюваністьd Реакції у місці введенняe |
a Включає інфекцію дихальних шляхів (вірусну, бактеріальну чи неуточнену), синусит (зокрема гострий), риніт, назофарингіт, фарингіт (у т. ч. вірусний), тонзиліт, ларингіт, трахеїт.
b Включає дерматомікоз стопи, паховий дерматомікоз, дерматофітію тулуба, різнобарвний лишай, мікоз кистей, оніхомікоз, грибкові інфекції шкіри.
c Включає головний біль, головний біль напруги, синусний головний біль.
d Включає втомлюваність, астенію.
e Включає крововиливи в місці ін’єкції, еритему, гематому, кровотечу, подразнення, біль, свербіж, реакцію, набряк, ущільнення, висип.
Опис окремих побічних реакцій
Інфекції
Частота інфекцій становила 75,5 випадку на 100 пацієнто-років у клінічних дослідженнях псоріазу та 43,0 випадку на 100 пацієнто-років у клінічних дослідженнях псоріатичного артриту, в тому числі з тривалим застосуванням рісанкізумабу. Більшість випадків були несерйозними, мали легкий чи помірний ступінь тяжкості і не вимагали припинення лікування рісанкізумабом. Частота серйозних інфекцій становила 1,7 випадку на 100 пацієнто-років у дослідженнях псоріазу та 2,6 випадку на 100 пацієнто-років у дослідженнях псоріатичного артриту.
Псоріатичний артрит
Загалом профіль безпеки, що спостерігався у пацієнтів із псоріатичним артритом, які отримували рісанкізумаб, відповідав профілю безпеки, що спостерігався у пацієнтів з бляшковим псоріазом.
Імуногенність
У пацієнтів, які отримували рісанкізумаб у рекомендованій клінічній дозі у період до 52-х тижнів під час клінічних випробувань за участю пацієнтів із псоріазом, антитіла до лікарського засобу та нейтралізуючі антитіла спостерігали у 24 % (263/1079) та у 14 % (150/1079) оцінених суб’єктів відповідно. У пацієнтів, які отримували тривале лікування рісанкізумабом (до 204 тижнів у розширеному дослідженні), спостерігався стійкий імуногенний профіль, порівняно з першими 52 тижнями лікування.
У більшості пацієнтів із псоріазом антитіла до рісанкізумабу, включаючи нейтралізуючі антитіла, не були пов’язані зі змінами клінічної відповіді чи параметрів безпеки. У небагатьох пацієнтів (приблизно 1 %; 7/1000 на тижні 16 та 6/598 на тижні 52) з високими титрами антитіл (> 128) клінічна відповідь виявилася зниженою. Частота реакцій у місці ін’єкції була кількісно вищою у пацієнтів з антитілами до рісанкізумабу порівняно з пацієнтами, у яких не виявили антитіл до рісанкізумабу протягом нетривалої (16 тижнів: 2,7 % порівняно з 1,3 %) і тривалої терапії (> 52 тижні: 5,0 % порівняно з 3,3 %). Реакції у місці ін’єкції були легкими та помірними за ступенем тяжкості. Жодна з них не була серйозною і не призвела до відміни терапії рісанкізумабом.
Під час клінічних досліджень псоріатичного артриту, який лікували рісанкізумабом у рекомендованій клінічній дозі протягом 28 тижнів, антитіла до препарату та нейтралізуючі антитіла, що утворилися під час лікування, були виявлені у 12,1 % (79/652) та 0 % (0/652) оцінюваних пацієнтів відповідно. Поява антитіл до рісанкізумабу при лікуванні псоріатичного артриту не супроводжувалася змінами показників клінічної відповіді або безпеки.
Пацієнти літнього віку
Інформація щодо безпеки застосування пацієнтам віком ≥ 65 років обмежена.
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності. 2 роки.
Не слід застосовувати препарат після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання.
Зберігати у недоступному для дітей та захищеному від світла місці при температурі від 2 до 8 °С (у холодильнику) в оригінальній картонній коробці. Не заморожувати.
Препарат можна зберігати не в холодильнику при температурі не вище 25 °C протягом 24 годин в оригінальній картонній коробці для захисту від дії світла.
Несумісність.
За відсутності досліджень сумісності цей лікарський засіб не слід змішувати з іншими лікарськими засобами.
Упаковка.
1 попередньо наповнений скляний шприц, вмонтований в автоінжектор; по одному автоінжектору в картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Випуск серії.
Еббві Дойчленд ГмбХ і Ко. КГ, Німеччина.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Кнольштрассе, 67061 Людвігсхафен, Німеччина.
