МОНТИКОП
-
Об'єднані Арабські Емірати Скай Фарма ВЗ-ТОВФорма выпуска: таблетки, по 10 мг/5 мг по 10 таблеток у блістері, по 3 блістери у картонній коробціСостав: монтелукаст натрію, левоцетиризину дигідрохлорид;/1 таблетка містить монтелукасту натрію у кількості, що еквівалентна 10 мг монтелукасту, та 5 мг левоцетиризину дигідрохлориду;/Условия отпуска: за рецептомНомер регистрационного свидетельства: UA/20903/01/01код АТХ: R03DC53Срок годности: 2 роки.
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
МОНТИКОП
(MONTICOPE)
Склад:
діюча речовина: монтелукаст натрію, левоцетиризину дигідрохлорид;
1 таблетка містить монтелукасту натрію у кількості, що еквівалентна 10 мг монтелукасту, та 5 мг левоцетиризину дигідрохлориду;
допоміжні речовини: целюлоза мікрокристалічна, кремнію діоксид колоїдний безводний, гідроксипропілцелюлоза, натрію кроскармелоза, магнію стеарат, дихлорметан, заліза оксид жовтий (E 172), бутилгідрокситолуол, гіпромелоза, вода очищена.
Лікарська форма. Таблетки.
Основні фізико-хімічні властивості: Круглі двоопуклі таблетки світло-жовтого кольору з вкрапленнями з одного боку і майже білого кольору з іншого боку, двошарові, з гладкою поверхнею з обох боків.
Фармакотерапевтична група. Лікарські засоби для лікування захворювань респіраторної системи. Інші лікарські засоби для лікування обструктивних захворювань дихальних шляхів для системного застосування. Антагоністи лейкотрієнових рецепторів. Монтелукаст у комбінації з іншими препаратами. Код АТХ R03D C53.
Фармакологічні властивості.
Фармакодинаміка.
Левоцетиризин
Левоцетиризин, R-енантіомер цетиризину, є потужним та селективним антагоністом периферичних Н1-рецепторів. Дослідження показали, що левоцетиризин має високу спорідненість з H1-рецепторами людини (Ki = 3,2 нмоль/л). Левоцетиризин має спорідненість, у 2 рази вищу, ніж цетиризин (Ki = 6,3 нмоль/л). Левоцетиризин дисоціює з Н1-рецепторами з періодом напіввиведення 115 ± 38 хвилин. Після одноразового введення левоцетиризин виявляє заповнення рецепторів на 90 % за 4 години і на 57 % за 24 години.
Фармакодинамічні дослідження за участю здорових добровольців показали, що половина дози левоцетиризину має зіставну з цетиризином активність щодо проявів як на шкірі, так і на слизовій оболонці носа.
Монтелукаст
Цистеїніл-лейкотрієни (LTC4, LTD4, LTE4) є потужними запальними ейкозаноїдами, що виділяються з різних клітин, включаючи опасисті клітини та еозинофіли. Ці важливі проастматичні медіатори зв’язуються з цистеїніл-лейкотрієновими (CysLT) рецепторами. Рецептор CysLT типу 1 (CysLT1) знаходиться в дихальних шляхах людини, зокрема на клітинах гладкої мускулатури дихальних шляхів та макрофагах дихальних шляхів, та на інших прозапальних клітинах (включаючи еозинофіли та певні мієлоїдні стовбурові клітини). CysLT були пов’язані з патофізіологією астми та алергічного риніту. При астмі лейкотрієнопосередковані ефекти проявляються бронхоспазмом, виділенням мокротиння, підвищенням проникності судин і збільшенням кількості еозинофілів.
При алергічному риніті CysLT вивільняються зі слизової оболонки носа після впливу алергенів під час реакцій ранньої та пізньої фаз, що пов’язано із симптомами алергічного риніту. Показано, що інтраназальна проблема, пов’язана із застосуванням CysLT, полягає у збільшенні опору носових дихальних шляхів та посиленні симптомів непрохідності носа.
Фармакодинамічні ефекти
Монтелукаст – перорально активна сполука, яка зв’язується з високою спорідненістю та селективністю з рецептором CysLT1.
У клінічних дослідженнях монтелукаст пригнічує бронхоконстрикцію після інгаляції LTD4 у дозах від 5 мг. Бронходилатація спостерігалася протягом 2 годин після прийому перорально. Ефект бронходилатації, спричинений β-агоністом, був адитивним до ефекту, викликаного монтелукастом. Лікування монтелукастом пригнічувало бронхіальну констрикцію як на ранній, так і на пізній фазі, що була спричинена антигеном. Монтелукаст порівняно з плацебо знижував число еозинофілів в периферичній крові у дорослих та педіатричних пацієнтів. В окремому дослідженні лікування монтелукастом суттєво знижувало число еозинофілів в дихальних шляхах (що вимірюється в мокроті) та в периферичній крові, одночасно покращуючи клінічний контроль астми.
Фармакокінетика.
Левоцетиризин
Фармакокінетика левоцетиризину лінійна, не залежить від дози та часу та має низьку варіабельність між суб’єктами. Фармакокінетичний профіль левоцетиризину є однаковим, якщо його вводять як окремий енантіомер або коли застосовують цетиризин. У процесі абсорбції та елімінації не відбувається хіральної інверсії.
Абсорбція
Левоцетиризин після перорального застосування швидко та інтенсивно поглинається. У дорослих максимальна концентрація у плазмі крові (Сmax) досягається через 0,9 години після прийому дози. Сталий стан досягається через два дні. Сmax зазвичай становить 270 нг/мл і 308 нг/мл після одноразового і повторного прийому 5 мг 1 раз на добу відповідно. Ступінь поглинання не залежить від дози і не змінюється з їжею, але Сmax зменшується і затримується.
Розподіл
Немає даних про розподіл у тканинах людини. Левоцетиризин на 90 % зв’язується з білками плазми крові. Розподіл левоцетиризину обмежений, об’єм розподілу становить 0,4 л/кг.
Біотрансформація
Ступінь метаболізму левоцетиризину у людини становить менше 14 % від дози, тому очікується, що різниці, зумовлені генетичним поліморфізмом або супутнім прийомом інгібіторів ферментів, незначні. Метаболічні шляхи включають ароматичне окислення, N- та О-деалкілування та кон’югацію таурину. Шляхи деалкілування в основному опосередковуються CYP 3A4, тоді як ароматичне окислення передбачає множинні та/або невстановлені ізоформи CYP. Левоцетиризин не впливав на активність ізоферментів CYP 1A2, 2C9, 2C19, 2D6, 2E1 та 3A4 при концентраціях, що значно перевищують пікові концентрації, досягнуті після пероральної дози 5 мг.
Через низький метаболізм та відсутність потенціалу метаболічного гальмування взаємодія левоцетиризину з іншими речовинами чи навпаки малоймовірна.
Виведення
Період напіввиведення з плазми крові у дорослих становить 7,9 ± 1,9 години. Період напіввиведення у дітей коротший. Середній очевидний загальний кліренс у дорослих становить 0,63 мл/хв/кг. Основний шлях виведення левоцетиризину та метаболітів – з сечею (85,4 % від дози). Екскреція через фації становить лише 12,9 % від дози. Левоцетиризин виводиться шляхом як клубочкової фільтрації, так і активної канальцевої секреції.
Особливі популяції
Порушення функції нирок
Очевидний кліренс левоцетиризину в організмі корелює з кліренсом креатиніну. Тому рекомендується коригувати інтервали дозування левоцетиризину залежно від кліренсу креатиніну у пацієнтів з помірною та тяжкою нирковою недостатністю. У пацієнтів з ануричною термінальною стадією ниркової недостатності загальний кліренс зменшується приблизно на 80 % порівняно з таким у пацієнтів з нормальною функцією нирок. Кількість левоцетиризину, видаленого під час стандартної 4-годинної процедури гемодіалізу, становила < 10 %.
Монтелукаст
Поглинання
Монтелукаст швидко всмоктується після перорального прийому. У дорослих після застосування натще таблеток, вкритих плівковою оболонкою, по 10 мг Cmax монтелукасту у плазмі крові досягалася через 3 години (Tmax). Середня біодоступність при пероральному застосуванні складає 64 %. Прийом звичайної їжі не впливав на біодоступність і на Cmax при пероральному застосуванні. Безпека і ефективність були підтверджені під час клінічних досліджень при застосуванні таблеток, вкритих плівковою оболонкою, по 10 мг незалежно від часу прийому їжі.
Після прийому натще таблеток жувальних по 5 мг показник Cmax у дорослих досягався через 2 години. Середня біодоступність при пероральному застосуванні складає 73 % і знижується до 63 % при прийомі зі стандартною їжею.
Розподіл
Понад 99 % монтелукасту зв’язується з білками плазми крові. Об’єм розподілу монтелукасту в стаціонарній фазі в середньому становить від 8 до 11 літрів. У ході досліджень на щурах із застосуванням радіоактивно міченого монтелукасту проходження через гематоенцефалічний бар’єр було мінімальним. Крім того, у всіх інших тканинах концентрації позначеного радіоізотопом матеріалу через 24 години після прийому дози також виявилися мінімальними.
Біотрансформація
Монтелукаст активно метаболізується. Під час досліджень із застосуванням терапевтичних доз концентрації метаболітів монтелукасту у стаціонарному стані плазми крові в дорослих і пацієнтів дитячого віку не визначаються.
Цитохром Р450 2С8 є основним ферментом у метаболізмі монтелукасту. Крім того, цитохроми CYP 3A4 і 2С9 відіграють незначну роль у метаболізмі монтелукасту, хоча ітраконазол (інгібітор CYP 3А4) не змінював фармакокінетичні показники монтелукасту у здорових добровольців, які отримували 10 мг монтелукасту на добу. Згідно з результатами досліджень in vitro з використанням мікросом печінки людини, терапевтичні плазмові концентрації монтелукасту не пригнічують цитохроми Р450 3А4, 2С9, 1А2, 2А6, 2С19 і 2D6. Участь метаболітів у терапевтичній дії монтелукасту є мінімальною.
Виведення
Кліренс монтелукасту в плазмі крові у здорових дорослих добровольців у середньому становить 45 мл/хв. Після перорального прийому монтелукасту, міченого ізотопом, 86 % виводиться з калом протягом 5 днів і менше 0,2 % – із сечею. У сукупності з біодоступністю монтелукасту при пероральному застосуванні цей факт вказує, що монтелукаст і його метаболіти майже повністю виводяться з жовчю.
Фармакокінетика в різних груп пацієнтів
Для пацієнтів із порушенням функції печінки легкого або помірного ступеня тяжкості корекція дози не потрібна. Дослідження за участю пацієнтів з порушенням функції нирок не проводилися. Оскільки монтелукаст і його метаболіти виводяться з жовчю, корекція дози для пацієнтів з порушенням функції нирок не вважається необхідною. Даних про характер фармакокінетики монтелукасту у пацієнтів з порушенням функції печінки тяжкого ступеня (понад 9 балів за шкалою Чайлда – П’ю) немає.
При прийомі великих доз монтелукасту (що в 20 та 60 разів перевищували дозу, рекомендовану для дорослих) спостерігалося зниження концентрації теофіліну в плазмі крові. Цей ефект не спостерігається при прийомі рекомендованої дози 10 мг один раз на добу.
Клінічні характеристики.
Показання.
Для симптоматичного лікування сезонного та цілорічного алергічного риніту.
Протипоказання.
Підвищена чутливість до монтелукасту натрію, левоцетиризину, цетиризину, гідроксизину, до будь-яких інших похідних піперазину або до будь-якої іншої допоміжної речовини препарату.
Тяжка форма хронічної ниркової недостатності (кліренс креатиніну < 15 мл/хв).
Рідкісні спадкові захворювання непереносимості галактози, лактазна недостатність або порушення засвоєння глюкози і галактози.
Дитячий вік до 15 років.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Монтелукаст
При дослідженні взаємодії між лікарськими засобами рекомендована клінічна доза монтелукасту не мала важливого клінічного впливу на фармакокінетику таких лікарських засобів: теофілін, преднізон, преднізолон, пероральні контрацептиви (етинілестрадіол/норетиндрон 35/1), терфенадин, дигоксин та варфарин.
У пацієнтів, які одночасно приймали фенобарбітал, площа під кривою «концентрація–час» (AUC) монтелукасту знижувалася приблизно на 40 %. Оскільки монтелукаст метаболізується за допомогою СYР 3А4, 2C8 і 2C9, необхідно бути обережним, особливо щодо дітей, якщо монтелукаст призначають одночасно з індукторами СYР 3А4, 2C8 і 2C9, наприклад фенітоїном, фенобарбіталом і рифампіцином.
Дослідження in vitro показали, що монтелукаст є потужним інгібітором CYP 2C8. Проте дані клінічного дослідження взаємодії лікарських засобів, що включають монтелукаст і розиглітазон (маркерний субстрат; лікарський засіб, що метаболізується за допомогою CYP 2C8), показали, що монтелукаст не є інгібітором CYP 2C8 in vivo. Таким чином, монтелукаст не впливає значною мірою на метаболізм лікарських засобів, що метаболізуються за допомогою цього ферменту (наприклад паклітакселу, розиглітазону та репаглініду).
Під час досліджень in vitro було встановлено, що монтелукаст є субстратом CYP 2C8 і меншою мірою 2C9 та 3A4. У ході клінічного дослідження взаємодії лікарських засобів із застосуванням монтелукасту і гемфіброзилу (інгібітору CYP 2C8 і 2С9) гемфіброзил підвищував системну експозицію монтелукасту в 4,4 раза. При одночасному застосуванні з гемфіброзилом або іншими потужними інгібіторами CYP 2C8 корекція дози монтелукасту не потрібна, але лікар повинен враховувати підвищений ризик виникнення побічних реакцій.
За результатами досліджень in vitro, не очікується виникнення клінічно важливих взаємодій з менш потужними інгібіторами CYP 2C8 (наприклад з триметопримом). Одночасне застосування монтелукасту з ітраконазолом, сильним інгібітором CYP 3A4, не призводило до істотного підвищення системної експозиції монтелукасту.
Левоцетиризин
Дослідження взаємодії левоцетиризину (у т. ч. з індукторами CYP3A4) не проводилися. Дослідження взаємодії цетиризину (рацемічна сполука) показали, що одночасне застосування з антипірином, азитроміцином, циметидином, діазепамом, еритроміцином, гліпізидом, кетоконазолом або псевдоефедрином не виявляє клінічно значущих несприятливих ефектів. При сумісному застосуванні з теофіліном (400 мг/добу) у дослідженні багаторазового застосування спостерігалося невелике зниження (на 16 %) кліренсу цетиризину (розподіл теофіліну не змінювався).
При дослідженні багаторазового введення ритонавіру (600 мг 2 рази на добу) та цетиризину (10 мг на добу) експозиція цетиризину збільшувалася приблизно на 40 %, тоді як розподіл ритонавіру дещо змінювався (-11 %) при супутньому застосуванні цетиризину.
Прийом їжі не впливає на ступінь всмоктування левоцетиризину, але одночасне вживання їжі знижує швидкість його абсорбції.
Немає даних щодо посилення ефекту седативних засобів при застосуванні у терапевтичних дозах. Але слід уникати застосування седативних засобів під час прийому препарату.
Одночасне застосування цетиризину або левоцетиризину з алкоголем або іншими депресантами ЦНС у чутливих пацієнтів може спричинити додаткове зниження уваги та здатності до виконання роботи.
Особливості застосування.
Монтелукаст
Немає даних, які підтверджують, що дозу пероральних кортикостероїдів можна зменшити при одночасному застосуванні монтелукасту.
У поодиноких випадках у пацієнтів, які отримують монтелукаст, може спостерігатися системна еозинофілія, інколи разом з клінічними проявами васкуліту, так званий синдром Чарга – Строс, лікування якого проводиться за допомогою системної кортикостероїдної терапії. Такі випадки іноді були пов’язані зі зменшенням дози або з відміною кортикостероїдного засобу. Імовірність того, що антагоністи лейкотрієнових рецепторів можуть бути пов’язані з появою синдрому Чарга – Строс, не можна спростувати або підтвердити. Лікарі повинні пам’ятати про можливість виникнення у пацієнтів еозинофілії, васкулітного висипання, погіршення легеневої симптоматики, ускладнення з боку серця та/або нейропатії. Пацієнтів, у яких виникли такі симптоми, слід повторно обстежити і переглянути їхню схему лікування.
Повідомлялося про виникнення психоневрологічних реакцій у дорослих та дітей, які застосовують монтелукаст (див. розділ «Побічні реакції»). Пацієнти та лікарі повинні бути уважними до проявів психоневрологічних реакцій. Пацієнтам та/або їхнім доглядачам слід повідомити про важливість інформування свого лікаря у разі виникнення таких реакцій. Лікарі повинні ретельно оцінювати ризики та переваги продовження застосування лікарського засобу в разі виникнення таких реакцій.
Левоцетиризин
З обережністю застосовувати пацієнтам із хронічною нирковою недостатністю (потрібна корекція режиму дозування) та пацієнтам літнього віку з нирковою недостатністю (можливе зниження клубочкової фільтрації).
Рекомендується з обережністю застосовувати препарат при одночасному прийомі з алкоголем (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Препарат слід з обережністю застосовувати пацієнтам з епілепсією та ризиком виникнення судом, оскільки левоцетиризин може призвести до посилення нападу.
Призначаючи препарат пацієнтам з факторами, що провокують затримку сечі (наприклад, при травмах спинного мозку, гіперплазії передміхурової залози), необхідно брати до уваги, що левоцетиризин збільшує ризик затримки сечі.
Антигістамінні препарати пригнічують відповідь на шкірну алергічну пробу, прийом препарату необхідно припинити за 3 дні до її проведення (період виведення).
Можлива поява свербежу після припинення застосування препарату, навіть якщо цей симптом не був наявний до початку лікування. Симптоми можуть зникнути самостійно. У деяких випадках симптоми можуть бути інтенсивними і може виникнути потреба у повторному прийомі лікарського засобу. Зазвичай симптоми зникають після початку повторного лікування.
Цей лікарський засіб містить менше 1 ммоль (23 мг)/дозу натрію, тобто практично вільний від натрію.
Застосування у період вагітності або годування груддю.
Вагітність
Монтелукаст
Дослідження на тваринах не демонструють шкідливого впливу на вагітність або ембріональний/фетальний розвиток.
Наявні дані з опублікованих проспективних та ретроспективних когортних досліджень із застосуванням монтелукасту вагітними жінками, які оцінюють значущі вроджені вади у дітей, не встановили ризику, пов’язаного із застосуванням лікарського засобу. Наявні дослідження мають методологічні обмеження, включаючи невеликий розмір вибірки, в деяких випадках ретроспективний збір даних і несумісні групи порівняння. Застосування монтелукасту можна розглянути під час вагітності лише за явної потреби.
Левоцетиризин
Дані щодо застосування левоцетиризину вагітним жінкам відсутні або обмежені (менше 300 результатів вагітності). Однак для цетиризину, рацемату левоцетиризину, велика кількість даних (понад 1000 результатів вагітності) щодо вагітних жінок свідчить про відсутність мальформативної або фето/неонатальної токсичності. Дослідження на тваринах не вказують на прямий або непрямий шкідливий вплив на вагітність, розвиток ембріона/плода, пологи або постнатальний розвиток. Застосування левоцетиризину можна розглянути під час вагітності, якщо це необхідно.
Годування груддю
Монтелукаст
Дослідження на щурах продемонстрували, що монтелукаст проникає в молоко. Невідомо, чи виводиться монтелукаст з грудним молоком у жінок. Монтелукаст можна застосовувати в період годування груддю, тільки якщо це вважається безумовно необхідним.
Левоцетиризин
Показано, що цетиризин, рацемат левоцетиризину, екскретується у людини. Тому екскреція левоцетиризину в людське молоко є ймовірною. Побічні реакції, пов’язані з левоцетиризином, можуть спостерігатися у немовлят, яких годують груддю. Тому слід з обережністю призначати левоцетиризин жінкам, які годують груддю.
Фертильність
Левоцетиризин
Немає клінічних даних щодо впливу лікарського засобу на фертильність.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Монтелукаст
Не очікується, що монтелукаст впливатиме на здатність пацієнта керувати автотранспортом або іншими механізмами. Проте дуже рідко повідомлялося про сонливість або запаморочення.
Левоцетиризин
Слід утримуватися від керування автотранспортом або роботи з іншими потенційно небезпечними механізмами на період лікування препаратом.
Спосіб застосування та дози.
Доза для пацієнтів з алергічним ринітом становить 1 таблетку на добу. Для полегшення симптомів алергічного риніту час прийому підбирають індивідуально.
Пацієнти літнього віку
Пацієнтам літнього віку з нормальною функцією нирок застосовувати препарат у звичайній дозі.
Пацієнтам літнього віку з порушенням функцій нирок від помірного до тяжкого ступеня (див. підрозділ «Ниркова недостатність») застосовувати з обережністю.
Ниркова недостатність
Пацієнтам з порушенням функції нирок розрахунок дози необхідно проводити з урахуванням ступеня порушення функції нирок (кліренсу креатиніну) відповідно до таблиці 1.
Для цього потрібно визначити кліренс креатиніну (КЛкр) пацієнта у мл/хв за вмістом креатиніну в сироватці крові (мг/дл), використовуючи таку формулу:
<?mso-application progid="Word.Document"?> 16
КЛкр=140 - вік (роки)×маса тіла (кг)72×креатинін сироватки крові (мг/дл)(×0,85 для жінок)
">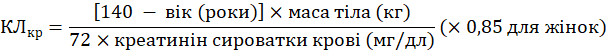
Таблиця 1
Корекція дози препарату для хворих із порушенням функції нирок
|
Функція нирок |
Кліренс креатиніну, мл/хв |
Кількість прийомів |
|
Нормальна функція нирок |
≥ 80 |
1 раз на добу |
|
Порушення легкого ступеня |
50–79 |
1 раз на добу |
|
Порушення помірного ступеня |
30–49 |
1 раз на 2 доби |
|
Порушення тяжкого ступеня |
< 30 |
1 раз на 3 доби |
|
Термінальна стадія захворювання нирок. Пацієнти, які перебувають на діалізі |
< 10 |
Протипоказано |
Дітям із порушеннями функції нирок прийом препарату слід коригувати індивідуально, з урахуванням ниркового кліренсу пацієнта та його маси тіла.
Специфічних даних щодо застосування дітям з порушенням функцій нирок немає.
Печінкова недостатність
Хворим з печінковою недостатністю корекція режиму прийому не потрібна. Хворим із печінковою та нирковою недостатністю слід коригувати режим прийому відповідно до наведеної вище таблиці 1.
Спосіб застосування
Приймати таблетку перорально, незалежно від вживання їжі. Таблетку необхідно ковтати цілою, запиваючи невеликою кількістю води.
Діти. Лікарський засіб показаний дітям віком від 15 років.
Передозування.
За опублікованими даними у ході досліджень хронічної астми монтелукаст призначали в дозах до 200 мг/добу дорослим пацієнтам протягом 22 тижнів, а у короткочасних дослідженнях – до 900 мг/добу протягом приблизно одного тижня, при цьому клінічно важливі побічні реакції не виникали.
Були зафіксовані повідомлення про гостре передозування монтелукастом дорослих і дітей в дозах, що перевищують 1000 мг (приблизно 61 мг/кг у дитини віком 42 місяці). Отримані клінічні і лабораторні дані відповідали профілю безпеки у дорослих пацієнтів і дітей. У більшості випадків передозування про побічні реакції не повідомлялось.
Симптоми передозування монтелукастом
Найчастіше спостерігалися такі побічні реакції: біль у животі, сонливість, спрага, головний біль, блювання та психомоторна гіперактивність.
Симптоми передозування левоцетиризином
Симптоми передозування у дорослих можуть включати сонливість. У дітей спочатку можуть виникнути збудження і підвищена дратівливість з подальшою сонливістю.
Лікування
Жодної спеціальної інформації щодо лікування передозувань монтелукастом немає. Дані щодо виведення монтелукасту за допомогою перитонеального діалізу або гемодіалізу відсутні.
Специфічного антидоту до левоцетиризину немає. У разі появи симптомів передозування рекомендується симптоматична та підтримуюча терапія. Можна розглянути необхідність промивання шлунка через короткий час після застосування препарату. Гемодіаліз для виведення левоцетиризину з організму неефективний.
Побічні реакції.
Монтелукаст
Монтелукаст оцінювався під час клінічних досліджень:
- таблетки, вкриті плівковою оболонкою, по 10 мг – приблизно у 4000 пацієнтів з астмою віком від 15 років;
- таблетки, вкриті плівковою оболонкою, по 10 мг – приблизно у 400 пацієнтів з астмою і сезонним алергічним ринітом віком від 15 років;
- таблетки жувальні по 5 мг – приблизно у 1750 пацієнтів з астмою віком від 6 до 14 років.
У ході клінічних досліджень про нижчезазначені побічні реакції повідомлялося часто (від ≥ 1/100 до < 1/10) у пацієнтів, які отримували лікування монтелукастом, а також з більшою частотою, ніж у пацієнтів, які отримували плацебо.
Таблиця 2
|
Класи систем органів |
Дорослі пацієнти та діти віком від 15 років (два 12-тижневих дослідження; n = 795) |
|
Порушення з боку нервової системи |
Головний біль |
|
Порушення з боку шлунково-кишкового тракту (ШКТ) |
Абдомінальний біль |
Під час клінічних досліджень при пролонгованому лікуванні невеликої кількості дорослих пацієнтів упродовж 2 років і дітей віком від 6 до 14 років упродовж 12 місяців профіль безпеки не змінювався.
Постмаркетинговий період
Побічні реакції, про які повідомлялось у постмаркетинговий період, вказано згідно з класами систем органів і з використанням спеціальних термінів у таблиці 3. Частота встановлена за даними відповідних клінічних досліджень.
Таблиця 3
|
Клас систем органів |
Побічні реакції |
Частота* |
|
Інфекції та інвазії |
Інфекції верхніх дихальних шляхів† |
Дуже часто |
|
Порушення з боку системи крові та лімфатичної системи |
Тенденція до посилення кровоточивості |
Рідко |
|
Тромбоцитопенія |
Дуже рідко |
|
|
Порушення з боку імунної системи |
Реакції гіперчутливості, в тому числі анафілаксія |
Нечасто |
|
Еозинофільна інфільтрація печінки |
Дуже рідко |
|
|
Порушення з боку психіки |
Порушення сну, у тому числі нічні кошмари, безсоння, сомнамбулізм, тривожність, ажитація, включаючи агресивну поведінку або ворожість, депресія, психомоторна гіперактивність (включаючи дратівливість, неспокій, тремор§) |
Нечасто |
|
Порушення уваги, погіршення пам’яті, тик |
Рідко |
|
|
Галюцинації, дезорієнтація, суїцидальні думки та поведінка (суїцидальність), обсесивно-компульсивні розлади, дисфемія |
Дуже рідко |
|
|
Порушення з боку нервової системи |
Запаморочення, млявість, парестезія/гіпоестезія, судоми |
Нечасто |
|
Порушення з боку серця |
Пальпітація |
Рідко |
|
Порушення з боку дихальної системи, органів грудної клітки і середостіння |
Носова кровотеча |
Нечасто |
|
Синдром Чарга – Стросс (див. розділ «Особливості застосування»), легенева еозинофілія |
Дуже рідко |
|
|
Порушення з боку ШКТ |
Діарея‡, нудота‡, блювання‡ |
Часто |
|
Сухість у роті, диспепсія |
Нечасто |
|
|
Порушення з боку гепатобіліарної системи |
Підвищення рівня трансаміназ сироватки (АЛТ, АСТ) |
Часто |
|
Гепатит (включаючи холестатичне, гепатоцелюлярне та змішане ураження печінки) |
Дуже рідко |
|
|
Порушення з боку шкіри і підшкірних тканин |
Висип‡ |
Часто |
|
Гематома, кропив’янка, свербіж |
Нечасто |
|
|
Ангіоневротичний набряк |
Рідко |
|
|
Вузликова еритема, мультиформна еритема |
Дуже рідко |
|
|
Порушення з боку кістково-м’язової системи і сполучної тканини |
Артралгія, міалгія, включаючи м’язові судоми |
Нечасто |
|
Порушення з боку нирок та сечовивідних шляхів |
Енурез у дітей |
Нечасто |
|
Загальні розлади і побічні реакції, викликані прийомом лікарського засобу |
Пірексія‡ |
Часто |
|
Астенія/втома, недомагання, набряк |
Нечасто |
|
|
* Частота визначена згідно з частотою повідомлень у базі даних клінічних досліджень: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто (від ≥ 1/1000 до < 1/100), рідко (від ≥ 1/10000 до < 1/1000), дуже рідко (< 1/10000). † Про цю побічну реакцію повідомлялося з частотою «дуже часто» у пацієнтів, які застосовували монтелукаст, а також у пацієнтів, які отримували плацебо, під час клінічних досліджень. ‡ Про цю побічну реакцію повідомлялось з частотою «часто» у пацієнтів, які застосовували монтелукаст, а також у пацієнтів, які отримували плацебо, під час клінічних досліджень. § Рідко. |
||
Левоцетиризин
Клінічні випробування
Дорослі та діти віком від 12 років
У терапевтичних дослідженнях за участю осіб жіночої та чоловічої статі віком від 12 до 71 року 15,1 % пацієнтів у групі прийому 5 мг левоцетиризину мали принаймні одну побічну реакцію на препарат порівняно з 11,3 % у групі плацебо. 91,6 % цих побічних реакцій на лікарський засіб були легкого та помірного ступеня тяжкості.
У терапевтичних випробуваннях частота відсіву через побічні реакції становила 1,0 % (9/935) при застосуванні 5 мг левоцетиризину та 1,8 % (14/771) при застосуванні плацебо.
Клінічні терапевтичні випробування з левоцетиризином включали 935 осіб, які застосовували препарат у рекомендованій дозі 5 мг на добу. Повідомлялося про випадки побічних реакцій із частотою 1 % або більше (часто ≥ 1/100 до < 1/10) при застосуванні 5 мг левоцетиризину або плацебо.
Таблиця 4
|
Термін, якому надається перевага (WHOART) |
Плацебо (n = 771) |
Левоцетиризин, 5 мг (n = 935) |
|
Головний біль |
25 (3,2 %) |
24 (2,6 %) |
|
Сонливість |
11 (1,4 %) |
49 (5,2 %) |
|
Сухість у роті |
12 (1,6 %) |
24 (2,6 %) |
|
Втома |
9 (1,2 %) |
23 (2,5 %) |
Спостерігалися подальші нечасті випадки побічних реакцій (нечасті ≥ 1/1000 до < 1/100), такі як астенія або біль у животі.
Частота седативних побічних реакцій, таких як сонливість, стомлюваність та астенія, була загалом вищою (8,1 %) при застосуванні 5 мг левоцетиризину, ніж плацебо (3,1 %).
Діти
У двох плацебо-контрольованих випробуваннях за участю педіатричних пацієнтів віком від 6 до 11 місяців та віком від 1 року до 6 років 159 пацієнтів протягом 2 тижнів застосовували відповідно левоцетиризин у дозі 1,25 мг 1 раз на добу та 1,25 мг двічі на добу, а 83 пацієнти отримували плацебо. Про зазначені у таблиці 5 побічні реакції повідомлялось із частотою 1 % або більше при застосуванні левоцетиризину або плацебо.
Таблиця 5
|
Класи систем органів та термін, якому надається перевага |
Плацебо (n = 83) |
Левоцетиризин (n = 159) |
|
З боку шлунково-кишкового тракту |
||
|
Діарея |
0 |
3 (1,9 %) |
|
Блювання |
1 (1,2 %) |
1 (0,6 %) |
|
Запор |
0 |
2 (1,3 %) |
|
З боку нервової системи |
||
|
Сонливість |
2 (2,4 %) |
3 (1,9 %) |
|
З боку психіки |
||
|
Порушення сну |
0 |
2 (1,3 %) |
Проводилися подвійно сліпі плацебо-контрольовані випробування за участю дітей віком 6–12 років, де 243 дитини застосовували 5 мг левоцетиризину щодня протягом змінних періодів від менш ніж 1 тижня до 13 тижнів. Про зазначені у таблиці 6 побічні реакції повідомлялась із частотою 1 % або більше при застосуванні левоцетиризину або плацебо.
Таблиця 6
|
Термін, якому надається перевага |
Плацебо (n = 240) |
Левоцетиризин 5 мг (n = 243) |
|
Головний біль |
5 (2,1 %) |
2 (0,8 %) |
|
Сонливість |
1 (0,4 %) |
7 (2,9 %) |
Постмаркетинговий період
Побічні реакції, отримані в процесі постмаркетингового досвіду, згруповано за класами систем органів та частотою. Частота визначається таким чином: дуже часто (≥ 1/10); часто (≥ 1/100 до < 1/10); нечасто (≥ 1/1000 до < 1/100); рідко (≥ 1/10000 до < 1/1000); дуже рідко (< 1/10 000), невідомо (неможливо оцінити за наявними даними).
· З боку імунної системи
Невідомо: гіперчутливість, у тому числі анафілаксія.
· Порушення харчування та обміну речовин
Невідомо: підвищений апетит.
· З боку психіки
Невідомо: агресія, збудження, галюцинації, депресія, безсоння, суїцидальні думки, кошмарні сновидіння.
· З боку нервової системи
Невідомо: судоми, парестезія, запаморочення, непритомність, тремор, дисгевзія.
· З боку органів слуху та рівноваги
Невідомо: вертиго.
· З боку органів зору
Невідомо: порушення зору, нечіткість зору, окулогірація.
· З боку серця
Невідомо: посилене серцебиття, тахікардія.
· З боку дихальної системи, органів грудної клітки та середостіння
Невідомо: задишка.
· З боку шлунково-кишкового тракту
Невідомо: нудота, блювання, діарея.
· З боку печінки та жовчовивідних шляхів
Невідомо: гепатит.
· З боку нирок та сечовидільної системи
Невідомо: дизурія, затримка сечі.
· З боку шкіри та підшкірних тканин
Невідомо: ангіоневротичний набряк, стійкі медикаментозні висипання, свербіж, висипання, кропив’янка.
· З боку скелетно-м’язової системи, сполучної тканини та кісток
Невідомо: міалгія, артралгія.
· Загальні порушення та побічні реакції, викликані прийомом лікарського засобу
Невідомо: набряк.
· Результати досліджень
Невідомо: збільшення маси тіла, відхилення функціональних печінкових проб від норми.
Опис окремих побічних реакцій
Після припинення прийому левоцетиризину повідомлялося про свербіж.
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua
Термін придатності.
2 роки.
Умови зберігання.
Зберігати при температурі не вище 30 °С у захищеному від світла та вологи місці. Зберігати у недоступному для дітей місці.
Упаковка. По 10 таблеток у блістері, по 3 блістери у картонній коробці.
Категорія відпуску. За рецептом.
Виробник. МАНКАЙНД ФАРМА ЛІМІТЕД, ЮНІТ-ІІ.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Віледж Кішанпура, П.О. Джамнівала, Техсіл Паонта Сахіб, Дістрікт Сірмоур 173025, Хімачал Прадеш, Індія.
