ДЕЦИСАН
-
Індія Сан Фармасьютикал Індастріз ЛімітедФорма выпуска: ліофілізат для розчину для інфузій по 50 мг 1 флакон з ліофілізатом у комплекті з 1 флаконом з розчинником (калію дигідрофосфат, натрію гідроксид, вода для ін'єкцій) по 10 мл у картонній коробціСостав: 1 флакон містить 50 мг децитабінуУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/17360/01/01код АТХ: L01BC08Срок годности: 2 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ДЕЦИСАН
(DECISUN)
Склад:
діюча речовина: децитабін (decitabine);
1 флакон містить 50 мг децитабіну;
склад розчинника: калію дигідрофосфат, натрію гідроксид, вода для ін’єкцій.
Лікарська форма. Ліофілізат для розчину для інфузій.
Основні фізико-хімічні властивості: ліофілізований порошок від білого до майже білого кольору.
Розчинник: безбарвний розчин.
Фармакотерапевтична група. Антинеопластичні засоби. Антиметаболіти. Код АТХ L01B С08.
Фармакологічні властивості.
Фармакодинаміка.
Децитабін (5-аза-2′-дезоксицитидин) є аналогом деоксинуклеозиду цитидину, який у малих дозах селективно інгібує ДНК-метилтрансферази, у результаті чого відбувається гіпометилювання промоторної ділянки генів, що може призводити до реактивації гена-супресора пухлин, індукції клітинної диференціації або старіння з подальшою запрограмованою загибеллю клітин.
Клінічний досвід
Застосування децитабіну вивчалося у відкритому рандомізованому багатоцентровому дослідженні III фази (DACO-016) за участю пацієнтів із вперше діагностованим de novo або вторинною гострою мієлоїдною лейкемією (ГМЛ) згідно з класифікацією ВООЗ. Децитабін (n = 242) порівнювали з вибором лікування (TC, n = 243), який складався з вибору пацієнтом за рекомендацією лікаря лише підтримуючої терапії (n = 28, 11,5 %) або 20 мг/м2 цитарабіну підшкірно 1 раз на добу протягом 10 послідовних днів, що повторюються кожні 4 тижні (n = 215, 88,5 %). Децитабін вводили у вигляді 1-годинної внутрішньовенної інфузії 20 мг/м2 1 раз на добу протягом 5 днів поспіль, повторюючи кожні 4 тижні.
Пацієнти, які вважалися кандидатами на стандартну індукційну хіміотерапію, не були включені в дослідження, як показано наступними базовими характеристиками. Середній вік для популяції, яка мала намір лікуватися (ITT), становив 73 роки (діапазон від 64 до 91 року). Тридцять шість відсотків пацієнтів мали цитогенетику низького ризику на початковому рівні. Решта пацієнтів мали цитогенетику середнього ризику. Пацієнти зі сприятливою цитогенетикою в дослідження не включалися. Двадцять п’ять відсотків пацієнтів мали статус ефективності за ECOG ≥ 2. Вісімдесят один відсоток пацієнтів мали значні супутні захворювання (наприклад, інфекцію, серцеву недостатність, легеневу недостатність). Кількість пацієнтів, які застосовували децитабін, за расовим розподілом становила 209 осіб європеоїдної раси (86,4 %) та 33 особи монголоїдної раси (13,6 %).
Основною кінцевою точкою дослідження було загальне виживання. Вторинною кінцевою точкою був рівень повної ремісії, який оцінював незалежний експертний огляд. Виживаність без прогресування та виживаність без розладів були третинними кінцевими точками.
Середня загальна виживаність у популяції ITT становила 7,7 місяця у пацієнтів, які отримували децитабін, порівняно з 5,0 місяцями у пацієнтів групи ТС (HR (коефіцієнт ризиків) = 0,85; 95 % ДІ: 0,69; 1,04, p = 0,1079). Різниця не досягла статистичної значущості, однак спостерігалася тенденція до покращення виживаності зі зниженням ризику смерті на 15 % для пацієнтів у групі децитабіну (рис. 1). При перевірці подальшої терапії, яка потенційно може модифікувати захворювання (наприклад, індукційна хіміотерапія або гіпометилюючий агент), аналіз загального виживання показав 20 % зниження ризику смерті для пацієнтів у групі децитабіну (HR = 0,80; 95 % ДІ: 0,64; 0,99, p = 0,0437).
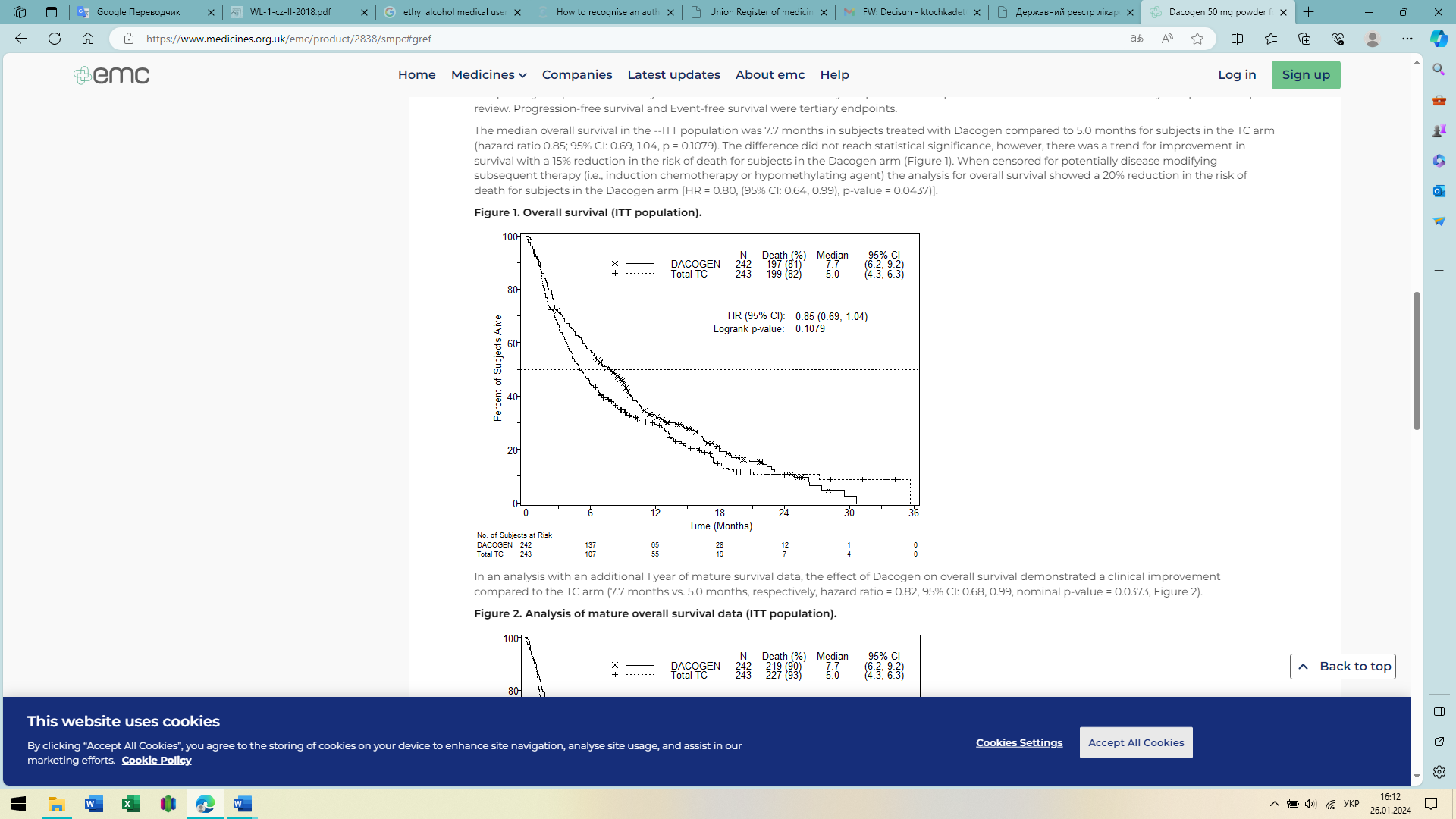
Рисунок 1.
В аналізі з додатковими 1-річними даними про виживаність у зрілому віці ефект децитабіну на загальну виживаність продемонстрував клінічне покращення порівняно з групою TC (7,7 місяця проти 5,0 місяців відповідно, HR = 0,82, 95 % ДІ: 0,68; 0,99, p = 0,0373, рис. 2).
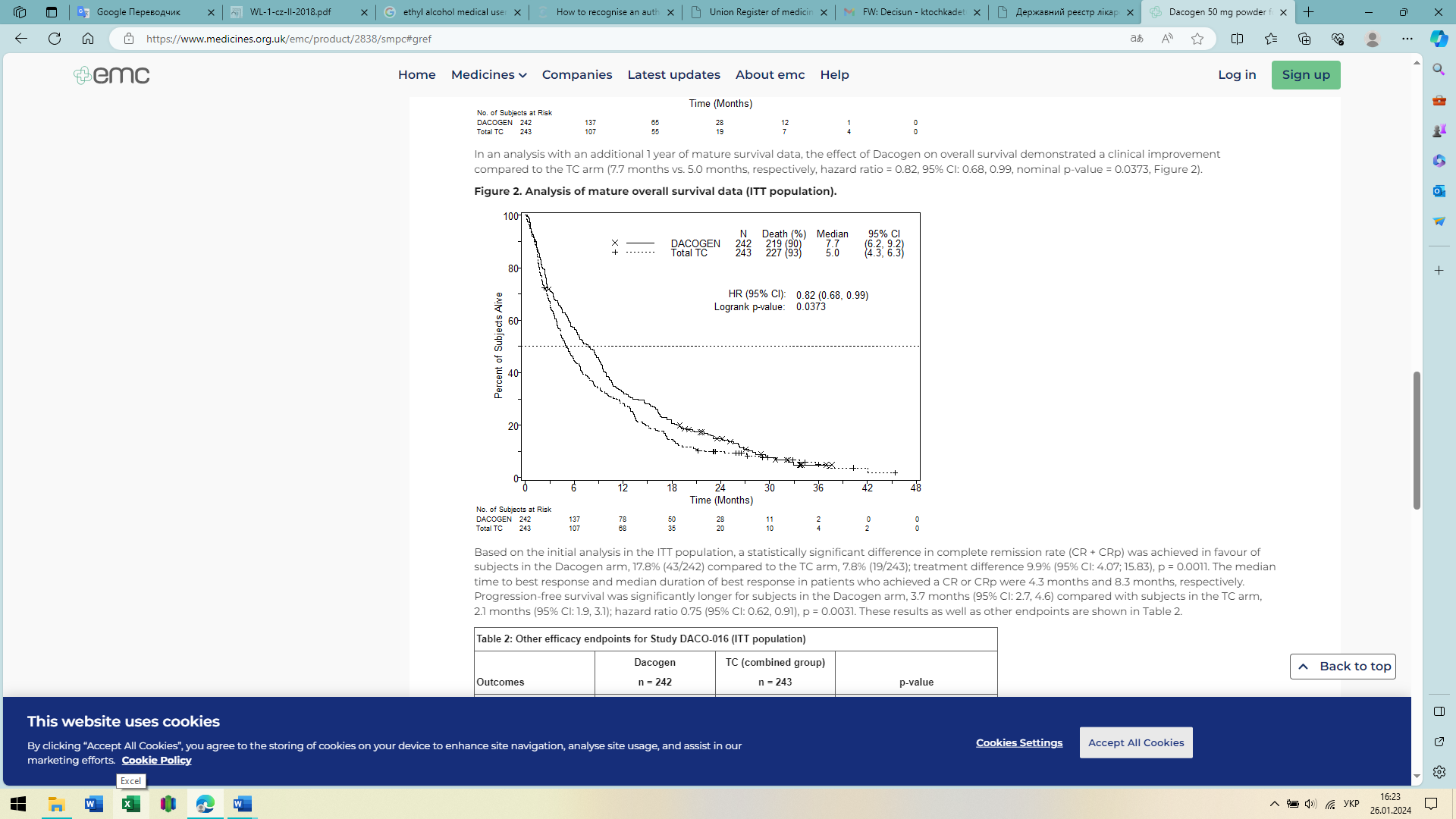
Рисунок 2.
На підставі початкового аналізу в популяції ITT було досягнуто статистично значущої різниці в частоті повної ремісії (CR + CRp) на користь пацієнтів у групі децитабіну, 17,8 % (43/242) порівняно з групою TC, 7,8 % ( 19/243); різниця лікування 9,9 % (95 % ДІ: 4,07; 15,83), p = 0,0011. Середній час досягнення найкращої відповіді та середня тривалість найкращої відповіді у пацієнтів, які досягли CR або CRp, становили 4,3 місяця та 8,3 місяця відповідно. Виживаність без прогресування була значно довшою для пацієнтів у групі децитабіну: 3,7 місяця (95 % ДІ: 2,7; 4,6) порівняно з пацієнтами у групі TC 2,1 місяця (95 % ДІ: 1,9; 3,1); HR = 0,75, 95 % ДІ: 0,62; 0,91, p = 0,0031. Ці результати, а також інші кінцеві точки наведені в таблиці 1.
Таблиця 1
|
Інші кінцеві точки ефективності для дослідження DACO-016 (популяція ITT) |
|||
|
Результати |
Дакоген (n = 242) |
ТК (збірна група) (n = 243) |
p-значення |
|
CR + CRp |
43 (17,8 %) |
19 (7,8 %) |
0,0011 |
|
OR = 2,5 (1,40; 4,78)b |
|||
|
CR |
38 (15,7 %) |
18 (7,4 %) |
- |
|
EFSa |
3,5 (2,5; 4,1)b |
2,1 (1,9; 2,8)b |
0,0025 |
|
HR = 0,75 (0,62; 0,90)b |
|||
|
PFSa |
3,7 (2,7; 4,6)b |
2,1 (1,9; 3,1)b |
0,0031 |
|
HR = 0,75 (0,62; 0,91)b |
|||
CR – повна ремісія.
CRp – повна ремісія з неповним відновленням тромбоцитів.
EFS – виживаність без подій.
PFS – виживаність без прогресування.
OR – відношення шансів.
HR – відношення ризику.
- Не підлягає оцінці.
a Повідомлено як середнє число місяців.
b 95 % довірчий інтервал.
Показники загальної виживаності та повної ремісії у попередньо визначених підгрупах, пов’язаних із захворюванням (тобто цитогенетичний ризик, оцінка Східної кооперативної онкологічної групи [ECOG], вік, тип ГМЛ та вихідна кількість бластів кісткового мозку), відповідали результатам дослідження загальної популяції.
Застосування децитабіну як початкової терапії також оцінювали у відкритому дослідженні II фази з однією групою (DACO-017) за участю 55 пацієнтів віком від 60 років з ГМЛ згідно з класифікацією ВООЗ. Первинною кінцевою точкою була частота повної ремісії (CR), оцінена незалежним експертним оглядом. Вторинною кінцевою точкою дослідження було загальне виживання. Децитабін вводили у вигляді одногодинної внутрішньовенної інфузії 20 мг/м2 1 раз на добу протягом 5 днів поспіль, повторюючи кожні 4 тижні. В аналізі ITT частота CR 23,6 % (95 % ДІ: 13,2; 37) спостерігалася у 13/55 пацієнтів, які отримували дакоген. Середній час до CR становив 4,1 місяця, а середня тривалість CR становила 18,2 місяця. Середня загальна виживаність у популяції ITT становила 7,6 місяця (95 % ДІ: 5,7; 11,5).
Ефективність і безпека застосування децитабіну не оцінювалися у пацієнтів з гострим промієлоцитарним лейкозом або лейкозом ЦНС.
Педіатрична популяція
У процесі відкритого багатоцентрового дослідження фази I/II оцінювали безпеку та ефективність децитабіну при послідовному застосуванні з цитарабіном у дітей віком від 1 місяця до < 18 років з рецидивом або рефрактерним AML. У цьому дослідженні було залучено загалом 17 пацієнтів, які застосовували децитабін у дозі 20 мг/м2, з яких 9 пацієнтів отримували цитарабін 1 г/м2, а 8 пацієнтів отримували цитарабін у максимально допустимій дозі 2 г/м2. Усі учасники припинили прийом дослідного препарату. Причини припинення лікування: прогресування захворювання – 12 пацієнтів (70,6 %); пацієнти продовжували трансплантацію – 3 особи (17,6 %); рішення дослідника – 1 особа (5,9 %); інше –1 особа (5,9 %). Зафіксовані побічні реакції відповідали відомому профілю.
Фармакокінетика.
Популяційні фармакокінетичні параметри децитабіну були зібрані з трьох клінічних досліджень з участю 45 пацієнтів із ГМЛ або мієлодиспластичним синдромом (МДС) із застосуванням п’ятиденного режиму дозування. У кожному дослідженні фармакокінетичні показники оцінювалися на п’ятий день кожного циклу лікування.
Розподіл
Фармакокінетику децитабіну після внутрішньовенного введення шляхом одногодинної інфузії описували лінійною двокомпонентною моделлю, що характеризується швидким виведенням діючої речовини з центрального компонента та відносно повільним розподілом з периферичного компонента. Фармакокінетичні параметри типового пацієнта (маса тіла 70 кг/площа поверхні тіла 1,73 м2) згруповані у таблиці 2.
Таблиця 2
|
Параметра |
Прогнозоване значення |
95 % довірчий інтервал |
|
Cmax (нг/мл) |
107 |
88,5-129 |
|
AUCcum (нг•год/мл) |
580 |
480-695 |
|
t1/2 (min) |
68,2 |
54,2-79,6 |
|
Vdss (л) |
116 |
84,1-153 |
|
CL (л/год) |
298 |
249-359 |
а Загальна доза за цикл становила 100 мг/м2.
У децитабіну лінійна фармакокінетика після внутрішньовенної інфузії та стан рівноважних концентрацій досягається упродовж півгодини. На підставі модельних розрахунків фармакокінетичні параметри були незалежними від часу (не змінювалися від циклу до циклу), при цьому режимі дозування не спостерігалося кумуляції. Зв’язування децитабіну з білками плазми крові є незначним (˂ 1 %). Значення Vdss децитабіну у пацієнтів з раком є високим, що вказує на розподіл лікарського засобу у периферичних тканинах. Не було виявлено залежності від віку, кліренсу креатиніну, загального білірубіну або захворювання.
Біотрансформація
Внутрішньоклітинно децитабін активується шляхом послідовного фосфорилювання з участю фосфокінази до відповідного трифосфату, який потім інкорпорується полімеразою ДНК. Дослідження метаболізму in vitro та результати досліджень балансу мас у людей продемонстрували, що система цитохрому Р450 не бере участі у метаболізмі децитабіну. Основний метаболізм відбувається шляхом дезамінування цитидин-деаміназою у печінці, нирках, епітелії кишечнику та крові. Результати досліджень балансу мас у людей показали, що рівень незміненого децитабіну у плазмі крові становить приблизно 2,4 % від вмісту загального радіоактивного матеріалу у плазмі крові. Вважається, що головні метаболіти не мають фармакологічної активності. Наявність цих метаболітів у сечі разом із високим загальним кліренсом та низьким виведенням активної речовини у незміненому вигляді разом із сечею (~ 4 % від дози) вказує на те, що децитабін значно метаболізується in vivo. Дослідження in vitro вказують на те, що децитабін у концентраціях, вищих від максимальної терапевтичної концентрації у плазмі крові (Cmax) у 20 разів, не пригнічує та не індукує ферменти CYP450. Таким чином, не очікується CYP-опосередкованої взаємодії з лікарськими засобами, які метаболізуються цими шляхами. Також дані досліджень in vitro демонструють, що децитабін є слабким субстратом Р-глікопротеїну.
Виведення
Середній плазмовий кліренс після внутрішньовенного введення у пацієнтів, хворих на рак, становив ˃ 200 л/г з помірною міжсуб’єктною варіабельністю (коефіцієнт варіабельності (CV) – приблизно 50 %). Екскреція активної субстанції у незміненому вигляді відіграє незначну роль у виведенні децитабіну.
Результати досліджень балансу мас із радіоактивним 14С‑міченим децитабіном у пацієнтів, хворих на рак, показали, що 90 % дози децитабіну (4 % у незміненому вигляді) виводиться із сечею.
Особливі категорії пацієнтів
Вплив ниркової або печінкової недостатності, статі, віку або раси на фармакокінетику децитабіну формально не досліджували. Інформацію щодо особливих категорій пацієнтів зібрали з фармакокінетичних даних, отриманих у процесі трьох досліджень, а також із дослідження І фази пацієнтів з МДС (n = 14).
Пацієнти літнього віку
Популяційний фармакокінетичний аналіз показав, що фармакокінетика децитабіну не залежить від віку (діапазон – 40‑87 років, середній вік – 70 років).
Педіатрична популяція
Популяційний фармакокінетичний аналіз децитабіну показав, що після врахування розміру тіла немає різниці між параметрами фармакокінетики децитабіну у педіатричних пацієнтів з ГМЛ та дорослих з ГМЛ або МДС.
Стать
У популяційному фармакокінетичному аналізі не було виявлено клінічно важливої різниці між жінками та чоловіками.
Расова приналежність
Більшість пацієнтів були представниками європеоїдної раси, хоча популяційний фармакокінетичний аналіз не виявив значного впливу на концентрацію децитабіну.
Печінкова недостатність
Фармакокінетика децитабіну формально не досліджувалася у пацієнтів із печінковою недостатністю. Результати досліджень балансу мас та дослідження in vitro, зазначені вище, показали, що ферменти CYP не беруть участі у метаболізмі децитабіну. Також обмежені дані популяційного фармакокінетичного аналізу свідчать про те, що фармакокінетичні показники децитабіну не мають залежності від рівня загального білірубіну. Тому не очікується, що порушення функції печінки впливатимуть на концентрацію децитабіну у плазмі крові.
Ниркова недостатність
Фармакокінетика децитабіну формально не досліджувалася у пацієнтів з нирковою недостатністю. Популяційний фармакокінетичний аналіз на підставі обмежених даних не виявив значної залежності фармакокінетичних показників від кліренсу креатиніну, показників функції нирок. Тому не очікується, що порушення функції нирок впливатимуть на концентрацію децитабіну.
Клінічні характеристики.
Показання.
Лікарський засіб Децисан показаний для лікування дорослих пацієнтів з нещодавно діагностованою de novo або вторинною гострою мієлоїдною лейкемією (ГМЛ) згідно з класифікацією Всесвітньої організації охорони здоров’я (ВООЗ), які не є кандидатами на стандартну індукційну хіміотерапію.
Протипоказання.
Відома гіперчутливість до децитабіну або до будь-якої з допоміжних речовин лікарського засобу.
Вагітність.
Період годування груддю.
Особливі заходи безпеки.
Слід уникати контакту зі шкірою і вдягати рукавички. Необхідно дотримуватися стандартної процедури поводження з протипухлинними засобами та їх утилізації.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Не проводили жодних формальних досліджень щодо взаємодії децитабіну з іншими лікарськими засобами.
Можлива взаємодія з іншими лікарськими засобами, яка також активується послідовним фосфорилюванням (за рахунок активності внутрішньоклітинної фосфокінази) та/або метаболізується ферментами, задіяними в інактивації децитабіну (наприклад, цитидин-деаміназа). Тому слід дотримуватися обережності при одночасному застосуванні лікарських засобів з лікарським засобом Децисан.
Вплив на децитабін інших лікарських засобів
Розвитку метаболічної лікарської взаємодії, опосередкованої системою цитохрому CYP450, не очікується, оскільки метаболізм децитабіну не опосередкований цією системою, а відбувається за допомогою окиснювального дезамінування.
Вплив децитабіну на інші лікарські засоби
Оскільки рівень зв’язування з білками плазми крові in vitro низький (< 1 %), малоймовірно, що децитабін буде витісняти інші лікарські засоби з їх зв’язків з білками плазми крові. Децитабін виявився слабким інгібітором Р‑gp‑опосередкованого транспорту in vitro, тому не очікується, що він буде впливати на Р‑gp‑опосередковане транспортування інших лікарських засобів (див. розділ «Фармакологічні властивості. Фармакокінетика»).
Особливості застосування.
Мієлосупресія
Мієлосупресія та ускладнення мієлосупресії, включаючи інфекції та кровотечі, які спостерігаються у пацієнтів з МДС та ГМЛ, можуть посилюватися під час лікування децитабіном. Тому існує підвищений ризик виникнення серйозних інфекцій (будь-якого патогенезу – бактеріального, грибкового або вірусного) з потенційним летальним наслідком (див. розділ «Побічні реакції»). Слід спостерігати за симптомами інфекцій у пацієнтів та негайно розпочинати лікування.
У процесі клінічних досліджень у більшості пацієнтів була початкова мієлосупресія III - IV ступеня тяжкості. При наявності мієлосупресії II ступеня на початку лікування погіршення спостерігалося у більшості пацієнтів та частіше, ніж у пацієнтів з початковою мієлосупресією I або 0 ступеня. Мієлосупресія, спричинена децитабіном, є оборотною. Слід регулярно проводити повний аналіз крові та аналіз кількості тромбоцитів за клінічними показниками та перед кожним курсом лікування. При мієлосупресії або її ускладненнях терапію Децисаном можна припинити, можна зменшити дозу або розпочати підтримуюче лікування згідно з рекомендаціями (див. розділи «Спосіб застосування та дози» та «Побічні реакції»).
Респіраторні, торакальні розлади та розлади середостіння
У пацієнтів, які застосовували децитабін, повідомлялося про випадки інтерстиціального захворювання легень (ІЗЛ), включаючи легеневі інфільтрати, пневмонію та легеневий фіброз, без ознак інфекційної етіології. Необхідно ретельно обстежити пацієнтів із гострим початком або незрозумілим погіршенням легеневих симптомів, щоб виключити ІЗЛ. Якщо ІЗЛ підтверджено, слід розпочати відповідне лікування (див. розділ «Побічні реакції»).
Порушення функції печінки
Застосування препарату Децисан пацієнтам із порушеннями функції печінки не вивчали. Слід бути обережними при застосуванні препарату Децисан пацієнтам із порушеннями функції печінки; за цими пацієнтами потрібно вести ретельний нагляд. Перед початком терапії та перед кожним циклом лікування, а також за клінічними показаннями слід проводити визначення функції печінки (див. розділи «Фармакологічні властивості. Фармакокінетика» та «Спосіб застосування та дози»).
Порушення функції нирок
Застосування препарату Децисан пацієнтам із тяжкими порушеннями функції нирок не вивчали. Слід бути обережними при введенні препарату Децисан пацієнтам із тяжкими порушеннями функції нирок (кліренс креатиніну < 30 мл/хв), за такими пацієнтами потрібно вести ретельний нагляд. Перед початком терапії та перед кожним циклом лікування, а також за клінічними показаннями слід проводити перевірку функції нирок (див. розділ «Спосіб застосування та дози»).
Захворювання серця
Пацієнти з тяжкою застійною серцевою недостатністю або клінічно нестабільною хворобою серця в анамнезі були виключені з клінічних випробувань, тому безпека та ефективність препарату Децисан для таких пацієнтів не були встановлені. У постмаркетинговому періоді повідомлялося про випадки кардіоміопатії з серцевою декомпенсацією, у деяких випадках оборотною після припинення лікування, зменшення дози або корекції лікування. За пацієнтами, особливо із серцевими захворюваннями в анамнезі, слід спостерігати щодо ознак і симптомів серцевої недостатності.
Диференціювальний синдром
Повідомлялося про випадки диференціювального синдрому (також відомого як синдром ретиноєвої кислоти) у пацієнтів, які застосовували децитабін. Диференціювальний синдром може бути летальним (див. розділ «Побічні реакції»). Лікування високими дозами внутрішньовенних кортикостероїдів та контроль гемодинаміки слід розглядати при перших проявах симптомів або ознак, що свідчать про диференціювальний синдром. Потрібно розглянути питання про тимчасове припинення прийому децитабіну до усунення симптомів, а у разі відновлення застосування препарату рекомендується застосовувати його з обережністю.
Допоміжні речовини
Після розведення розчин для внутрішньовенного введення містить приблизно 1‑10 ммоль калію з розрахунку на 1 дозу, залежно від розчинника. Слід з обережністю застосовувати лікарський засіб пацієнтам із порушеннями функції нирок або пацієнтам, які контролюють вживання калію.
Кількість натрію у флаконі становить 0,29 ммоль. Після розведення розчин для внутрішньовенного введення містить приблизно 0,6‑6 ммоль натрію з розрахунку на 1 дозу, залежно від розчинника. Слід з обережністю застосовувати лікарський засіб Децисан пацієнтам, які контролюють вживання натрію.
Застосування у період вагітності або годування груддю.
Контрацепція у жінок та чоловіків
Жінкам репродуктивного віку рекомендовано використовувати засоби контрацепції та уникати настання вагітності у процесі лікування препаратом Децисан та протягом 6 місяців після завершення лікування. Чоловікам необхідно використовувати ефективні засоби контрацепції та уникати зачаття дитини в процесі лікування Децисаном та впродовж 3 місяців після закінчення лікування.
Одночасне застосування лікарського засобу Децисан та гормональних контрацептивів не досліджували.
Вагітність
Немає достатніх даних щодо застосування препарату Децисан вагітним жінкам. Дослідження показали існування тератогенного ефекту децитабіну у щурів та мишей. Потенційний ризик для людини невідомий. Зважаючи на результати досліджень у тварин та механізм дії препарату, децитабін не можна застосовувати жінкам репродуктивного віку, які не використовують надійні методи контрацепції. Перед початком лікування всім жінкам дітородного віку необхідно провести тест на вагітність. Якщо лікарський засіб Децисан застосовували у період вагітності або якщо жінка завагітніла у процесі лікування, слід поінформувати пацієнта про потенційну небезпеку для плода.
Період годування груддю
Невідомо, чи проникає децитабін або його метаболіти у грудне молоко. Лікарський засіб Децисан протипоказаний у період годування груддю. Якщо призначено лікування Децисаном, годування груддю необхідно припинити.
Фертильність
Дані про вплив децитабіну на здатність до зачаття людей відсутні. Дослідження на тваринах продемонстрували вплив децитабіну на фертильність самців, а також його мутагенність. Оскільки існує ризик настання безпліддя внаслідок лікування децитабіном, чоловікам необхідно розглянути можливість консервації сперми, а жінкам – кріоконсервації ооцитів перед початком терапії Децисаном.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Лікарський засіб Децисан може мати помірний вплив на здатність керувати автотранспортом та працювати з іншими механізмами. Пацієнтів слід проінформувати про те, що під час лікування у них можуть виникати побічні реакції, такі як анемія. Отже, необхідно рекомендувати дотримуватися заходів безпеки при керуванні автомобілем та роботі з іншими механізмами.
Спосіб застосування та дози.
Лікарський засіб Децисан слід вводити під наглядом лікаря з досвідом застосування хіміотерапевтичних засобів.
У циклі лікування децитабін рекомендовано вводити у дозі 20 мг/м2 площі поверхні тіла шляхом внутрішньовенної інфузії тривалістю більше 1 години впродовж 5 послідовних днів (тобто загалом 5 доз у циклі). Загальна добова доза не повинна перевищувати 20 мг/м2, а загальна доза за цикл не повинна перевищувати 100 мг/м2. У разі пропуску введення чергової дози лікування має бути відновлено якомога швидше. Цикл необхідно повторювати кожні 4 тижні, залежно від клінічної відповіді пацієнта та токсичності, що спостерігається. Рекомендується лікувати пацієнтів протягом мінімум 4 циклів, однак повна або часткова ремісія може тривати довше, ніж 4 цикли. Лікування може бути продовжено до тих пір, поки спостерігається відповідь, користь від лікування або стабільність хвороби, тобто за відсутності її явного прогресування.
Якщо після 4 курсів лікування гематологічні показники (такі як кількість тромбоцитів або абсолютна кількість нейтрофілів) не відновлюються до рівня перед лікуванням або захворювання прогресує (збільшення кількості бластних клітин периферичної крові або погіршення показників бластних клітин кісткового мозку), пацієнта можна вважати нечутливим до лікування. Слід розглянути питання про проведення альтернативної терапії.
Премедикація з метою профілактики нудоти та блювання не рекомендована як рутинна процедура, але за необхідності може бути застосована.
Лікування мієлосупресії та асоційованих ускладнень
Мієлосупресія та побічні реакції, пов’язані з мієлосупресією (тромбоцитопенія, анемія, нейтропенія та фебрильна нейтропенія), є частими як у лікованих раніше пацієнтів, так і у пацієнтів, які не отримували лікування. Ускладнення мієлосупресії включають інфекції та кровотечу, а також стани, описані нижче:
- фебрильна нейтропенія (температура ≥ 38,5 °С, абсолютна кількість нейтрофілів < 1000/мкл);
- активна вірусна, бактеріальна або грибкова інфекція (наприклад, та, яка вимагає внутрішньовенного введення антибактеріальних засобів або системної підримувальної терапії);
- крововиливи (шлунково-кишкові, урогенітальні, легеневі з кількістю тромбоцитів < 25000/мкл, або геморагічні ураження ЦНС).
Лікування Децисаном можна відновити, коли стан пацієнта покращиться або стабілізується за допомогою адекватного лікування (протиінфекційної терапії, переливання крові або факторів росту).
У клінічних дослідженнях приблизно одна третина пацієнтів, які отримували децитабін, потребувала відстрочки дози. Зниження дози не рекомендується.
Педіатрична популяція
Лікарський засіб Децисан не слід застосовувати дітям з ГМЛ віком < 18 років, оскільки ефективність не встановлена. Наразі доступні дані описані в розділах «Фармакологічні властивості» та «Побічні реакції».
Пацієнти з печінковою недостатністю
Дослідження з участю пацієнтів із печінковою недостатністю не проводили. Необхідність корекції дози для пацієнтів з печінковою недостатністю не встановлена. Якщо функція печінки погіршується, за пацієнтами слід ретельно наглядати (див. розділи «Фармакологічні властивості» та «Особливості застосування»).
Пацієнти з нирковою недостатністю
Застосування лікарського засобу Децисан пацієнтам з тяжкою нирковою недостатністю не вивчали. Необхідність корекції дози для пацієнтів з порушеннями функції нирок не оцінювали (див. розділи «Фармакологічні властивості» та «Особливості застосування»).
Спосіб застосування
Лікарський засіб Децисан вводять шляхом внутрішньовенної інфузії. Центральний венозний катетер не потрібен.
Рекомендації щодо безпечного поводження
Слід уникати контакту розчину зі шкірою та надягати захисні рукавички. Необхідно прийняти стандартні процедури поводження з цитотоксичними лікарськими засобами.
Інструкції щодо розчинення та розведення лікарського засобу перед застосуванням
Процедура відновлення
Порошок необхідно асептично розвести 10 мл води для ін’єкцій. Після розчинення кожен мілілітр містить приблизно 5 мг децитабіну при рН від 6,7 до 7,3. Протягом 15 хвилин після розчинення розчин необхідно додатково розбавити холодною рідиною для інфузій (розчин натрію хлориду 9 мг/мл [0,9 %] розчин для ін’єкцій або 5 % розчин глюкози для ін’єкцій) до кінцевої концентрації 0,15–1,0 мг/мл.
Термін придатності та застереження щодо зберігання після розчинення
Відновлений і розведений розчин
Протягом 15 хвилин після розчинення концентрат (у 10 мл стерильної води для ін’єкцій) необхідно додатково розвести холодною (2 - 8°C) рідиною для інфузій. Цей приготовлений розведений розчин для внутрішньовенної інфузії можна зберігати при температурі 2 - 8 °C протягом максимум 3 годин, потім до 1 години при кімнатній температурі (20 - 25 °C) перед введенням.
З мікробіологічної точки зору лікарський засіб слід використати протягом рекомендованого вище періоду часу. Користувач несе відповідальність за дотримання рекомендованого часу та умов зберігання та переконання, що відновлення відбувалося в асептичних умовах.
Лікарський засіб Децисан не слід вводити через один і той самий внутрішньовенний доступ/лінію з іншими лікарськими засобами.
Утилізація
Цей лікарський засіб призначений лише для одноразового застосування. Будь-який невикористаний лікарський засіб або відходи слід утилізувати відповідно до місцевих вимог.
Діти.
Лікарський засіб Децисан не слід застосовувати дітям з ГМЛ віком < 18 років, оскільки ефективність не встановлена. Наразі доступні дані описані в розділах «Фармакологічні властивості» та «Побічні реакції».
Передозування.
Прямого досвіду передозування людини немає, специфічного антидоту при передозуванні не існує. Однак дані клінічних досліджень та опублікованої літератури описують посилення мієлосупресії, включаючи відстрочену нейтропенію та тромбоцитопенію при введенні високих доз, що перевищують поточну терапевтичну дозу в 20 разів. Імовірно, що токсичність проявлятиметься як загострення побічних реакцій, переважно мієлосупресії. Терапія при передозуванні повинна бути підтримуючою.
Побічні реакції.
Профіль безпеки
Найчастішими побічними реакціями, про які повідомляли протягом лікування децитабіном (≥ 35 %), є пірексія, анемія та тромбоцитопенія.
Найчастішими побічними реакціями 3‑4 ступеня тяжкості (≥ 20 %) були пневмонія, тромбоцитопенія, нейтропенія, фебрильна нейтропенія та анемія.
У процесі клінічних досліджень у 30 % пацієнтів, які отримували децитабін, та у 25 % пацієнтів у групі порівняння були побічні реакції з летальним наслідком, які виникали упродовж лікування або протягом 30 днів після отримання останньої дози препарату.
У групі децитабіну спостерігалася вища частота переривання лікування через виникнення побічних реакцій у жінок (43 %) порівняно з чоловіками (32 %).
Резюме побічних реакцій
Побічні реакції, що спостерігалися у 293 пацієнтів з ГМЛ, які отримували децитабін, узагальнені в таблиці 3. У таблиці відображені дані клінічних досліджень та післяреєстраційний досвід застосування. Побічні реакції узагальнені та класифіковані таким чином: дуже часто (≥ 1/10), часто (≥ 1/100, < 1/10), нечасто (≥ 1/1000, < 1/100), рідко (≥ 1/10000, < 1/1000), дуже рідко (˂ 1/10000), частота невідома (не може бути визначена на основі наявних даних).
У межах кожної групи за частотою побічні реакції на препарат подаються в порядку зменшення серйозності.
Таблиця 3
|
Побічні реакції, виявлені при застосуванні децитабіну |
||||
|
Системи органів |
Частота (всі ступені) |
Побічна реакція |
Частота |
|
|
Всі ступеніa (%) |
Ступені 3‑4a (%) |
|||
|
Інфекції та інвазії |
дуже часто |
пневмонія* |
24 |
20 |
|
інфекції сечовивідних шляхів* |
15 |
7 |
||
|
інші інфекції (вірусні, бактеріальні, грибкові)*, b, c |
63 |
39 |
||
|
часто |
септичний шок* |
6 |
4 |
|
|
сепсис* |
9 |
8 |
||
|
синусит |
3 |
1 |
||
|
Доброякісні, злоякісні та нез’ясованого походження новоутворення (включаючи кісти та поліпи) |
частота невідома |
диференціювальний синдром |
частота невідома |
частота невідома |
|
З боку системи крові та лімфатичної системи |
дуже часто |
фебрильна нейтропенія* |
34 |
32 |
|
нейтропенія* |
32 |
30 |
||
|
тромбоцитопенія d* |
41 |
38 |
||
|
анемія |
38 |
31 |
||
|
лейкопенія |
20 |
18 |
||
|
часто |
панцитопенія* |
< 1 |
< 1 |
|
|
З боку імунної системи |
часто |
гіперчутливість, включаючи анафілактичу реакціюе |
1 |
< 1 |
|
Метаболізм і порушення харчування |
дуже часто |
гіперглікемія |
13 |
3 |
|
З боку нервової системи |
дуже часто |
головний біль |
16 |
1 |
|
З боку серцево-судинної системи |
нечасто |
кардіоміопатія |
< 1 |
< 1 |
|
З боку дихальної системи, торакальні та медіастинальні порушення |
дуже часто |
носова кровотеча |
14 |
2 |
|
частота невідома |
інтерстиціальна хвороба легенів |
частота невідома |
частота невідома |
|
|
З боку травної системи |
дуже часто |
діарея |
31 |
2 |
|
блювання |
18 |
1 |
||
|
нудота |
33 |
< 1 |
||
|
стоматит |
7 |
1 |
||
|
частота невідома |
ентероколіт, у тому числі нейтропенічний коліт, запалення сліпої кишки* |
частота невідома |
частота невідома |
|
|
Печінкові розлади |
дуже часто |
аномальна функція печінки |
11 |
3 |
|
часто |
гіпербілірубінеміяg |
5 |
< 1 |
|
|
З боку шкіри та підшкірних тканин |
нечасто |
гострий фебрильний нейтрофільний дерматоз (синдром Світа) |
< 1 |
NA |
|
Загальні розлади та порушення у місці введення |
дуже часто |
пірексія |
48 |
9 |
|
a Загальна термінологія критеріїв для ступенів небажаних проявів Національного інституту злоякісних захворювань США. b За винятком пневмонії, інфекцій сечовивідних шляхів, сепсису, септичного шоку та синуситу. с Найчастішими «іншими інфекціями» були герпес ротової порожнини, кандидоз ротової порожнини, фарингіт, інфекції верхніх дихальних шляхів, целюліт, бронхіт, назофарингіт. d Включаючи кровотечу, асоційовану з тромбоцитопенією, у тому числі з летальним наслідком. e Включаючи гіперчутливість, гіперчутливість до діючої речовини, анафілактичну реакцію, анафілактичний шок, анафілактоїдну реакцію, анафілактоїдний шок. f Включаючи гіперчутливість, гіперчутливість до діючої речовини, анафілактичну реакцію, анафілактичний шок, анафілактоїдну реакцію, анафілактоїдний шок. g У клінічних дослідженнях щодо ГМЛ та мієлодиспластичного синдрому (МДС) частота гіпербілірубінемії становила 11 % для всіх класів та 2 % для 3–4 класу. * Включаючи побічні реакції з летальним наслідком. NA – не передбачено. |
||||
Опис вибіркових побічних реакцій
Гематологічні побічні реакції
Найчастіші гематологічні побічні реакції, асоційовані з лікуванням децитабіном, про які повідомляли, включали фебрильну нейтропенію, тромбоцитопенію, нейтропенію, анемію та лейкопенію.
У пацієнтів, які отримували децитабін, зафіксовано розвиток тяжких побічних реакцій, деяких з летальним наслідком, таких як крововилив у мозок (2 %) або шлунково-кишкова кровотеча (2 %), внаслідок тяжкої тромбоцитопенії.
Ведення гематологічних побічних реакцій потрібно здійснювати шляхом моніторингу кількісних показників повного аналізу крові та, у разі необхідності, раннього застосування підтримуючого лікування. Методи підтримуючого лікування включають профілактичне застосування антибіотиків та/або призначення факторів росту (зокрема гранулоцитарного колонієстимулюючого фактора – Г‑КСФ) при нейтропенії і гемотрансфузії при анемії або тромбоцитопенії згідно з прийнятими у лікувальному закладі рекомендаціями (інформацію про ситуації, в яких застосування децитабіну потрібно відкласти, див. у розділі «Спосіб застосування та дози»).
Інфекції та інвазії
У пацієнтів, які отримували децитабін, повідомляли про виникнення тяжких побічних реакцій, пов’язаних з інфекціями, вірогідно – з летальним наслідком, таких як септичний шок, сепсис, пневмонія та інші інфекції (вірусні, бактеріальні та грибкові).
Розлади з боку травної системи
Повідомлялося про виникнення ентероколіту, включаючи нейтропенічний коліт, запалення сліпої кишки під час лікування децитабіном. Ентероколіт може призвести до септичних ускладнень і може бути пов’язаний з летальним наслідком.
Респіраторні, торакальні та медіастинальні розлади
Повідомлялося про випадки інтерстиціальної хвороби легенів (включаючи легеневі інфільтрати, які спричиняють пневмонію та легеневий фіброз) без ознак інфекційної етіології у пацієнтів, які отримували децитабін.
Диференціювальний синдром
Повідомлялося про випадки диференціювального синдрому (також відомого як синдром ретиноєвої кислоти) у пацієнтів, які отримували децитабін. Диференціювальний синдром може бути летальним, а симптоми та клінічні дані включають респіраторний дистрес, легеневі інфільтрати, гарячку, висип, набряк легенів, периферичний набряк, швидке збільшення маси тіла, плевральний випіт, перикардіальний випіт, гіпотонію та ниркову дисфункцію. Диференціювальний синдром може виникнути із супутнім лейкоцитозом або без нього. Також можуть виникати синдром підвищеної проникності капілярів та коагулопатія (див. розділ «Особливості застосування»).
Діти
Оцінка безпеки для дітей ґрунтується на обмежених даних дослідження I/II фази, в якому вивчали фармакокінетику, безпеку та ефективність децитабіну у дітей (віком від 1 до 14 років) з рецидивним або рефрактерним ГМЛ (n = 17) (див. розділ «Фармакодинаміка»). У цьому педіатричному дослідженні нових свідчень щодо безпеки не виявлено.
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності. 2 роки.
Умови зберігання.
Зберігати в оригінальній упаковці при температурі не вище 25 ºС.
Зберігати у недоступному для дітей місці.
Несумісність.
Даний лікарський засіб не можна змішувати з іншими лікарськими засобами, за винятком тих, що зазначені у розділі «Спосіб застосування та дози».
Упаковка.
1 флакон з ліофілізатом у комплекті з 1 флаконом із розчинником по 10 мл у картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
Сан Фармасьютикал Індастріз Лтд.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Барода Хайвей, Халол, Гуджарат, 389350, Індія.
