ГЕМАТЕ® П
-
Німеччина ЦСЛ Берінг ГмбХФорма выпуска: порошок та розчинник для приготування розчину для ін`єкцій або інфузій по 1000 МО/2400 МО у флаконі, в комплекті з розчинником (вода для ін`єкцій) по 15 мл у флаконі та 1 пристроєм для додавання розчинника з вбудованим фільтром 15 мкм ("Міх-2Vial™ 20/20") та 1 картонною коробкою з комплектом для внутрішньовенного введення препарату (1 одноразовий шприц, 1 голка-метелик, 2 дезінфікуючі серветки в індивідуальних герметичних упаковках та 1 нестерильний лейкопластир) в картонній коробціСостав: 1 флакон з лікарським засобом Гемате® П активністю 1000 МО FVIII / 2400 МО VWF містить 1000 МО фактора коагуляції крові людини VIII (FVIII) та 2400 МО фактора фон Віллебранда людини (VWF);/після відновлення шляхом додавання 15 мл води для ін’єкцій розчин містить 66,6 МО/мл FVIII та 160 МО/мл VWFУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/20401/01/03код АТХ: B02BD06Срок годности: 3 роки
-
Німеччина ЦСЛ Берінг ГмбХФорма выпуска: порошок та розчинник для приготування розчину для ін`єкцій або інфузій по 250 МО/600 МО у флаконі, в комплекті з розчинником (вода для ін`єкцій) по 5 мл у флаконі та 1 пристроєм для додавання розчинника з вбудованим фільтром 15 мкм ("Міх-2Vial™ 20/20") та 1 картонною коробкою з комплектом для внутрішньовенного введення препарату (1 одноразовий шприц, 1 голка-метелик, 2 дезінфікуючі серветки в індивідуальних герметичних упаковках та 1 нестерильний лейкопластир) в картонній коробціСостав: 1 флакон з лікарським засобом Гемате® П активністю 250 МО FVIII / 600 МО VWF містить 250 МО фактора коагуляції крові людини VIII (FVIII) та 600 МО фактора фон Віллебранда людини (VWF);/після відновлення шляхом додавання 5 мл води для ін’єкцій розчин містить 50 МО/мл FVIII та 120 МО/мл VWFУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/20401/01/01код АТХ: B02BD06Срок годности: 3 роки
-
Німеччина ЦСЛ Берінг ГмбХФорма выпуска: порошок та розчинник для приготування розчину для ін`єкцій або інфузій по 500 МО/1200 МО у флаконі, в комплекті з розчинником (вода для ін`єкцій) по 10 мл у флаконі та 1 пристроєм для додавання розчинника з вбудованим фільтром 15 мкм ("Міх-2Vial™ 20/20") та 1 картонною коробкою з комплектом для внутрішньовенного введення препарату (1 одноразовий шприц, 1 голка-метелик, 2 дезінфікуючі серветки в індивідуальних герметичних упаковках та 1 нестерильний лейкопластир) в картонній коробціСостав: 1 флакон з лікарським засобом Гемате® П активністю 500 МО FVIII / 1200 МО VWF містить 500 МО фактора коагуляції крові людини VIII (FVIII) та 1200 МО фактора фон Віллебранда людини (VWF);/після відновлення шляхом додавання 10 мл води для ін’єкцій розчин містить 50 МО/мл FVIII та 120 МО/мл VWFУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/20401/01/02код АТХ: B02BD06Срок годности: 3 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
Гемате® П
(Haemate® P)
Склад:
діючі речовини: фактор коагуляції крові людини VIII (FVIII), фактор фон Віллебранда людини (VWF).
1 флакон з лікарським засобом Гемате® П активністю 250 МО FVIII / 600 МО VWF містить 250 МО фактора коагуляції крові людини VIII (FVIII) та 600 МО фактора фон Віллебранда людини (VWF);
після відновлення шляхом додавання 5 мл води для ін’єкцій розчин містить 50 МО/мл FVIII та 120 МО/мл VWF.
1 флакон з лікарським засобом Гемате® П активністю 500 МО FVIII / 1200 МО VWF містить 500 МО фактора коагуляції крові людини VIII (FVIII) та 1200 МО фактора фон Віллебранда людини (VWF);
після відновлення шляхом додавання 10 мл води для ін’єкцій розчин містить 50 МО/мл FVIII та 120 МО/мл VWF.
1 флакон з лікарським засобом Гемате® П активністю 1000 МО FVIII / 2400 МО VWF містить 1000 МО фактора коагуляції крові людини VIII (FVIII) та 2400 МО фактора фон Віллебранда людини (VWF);
після відновлення шляхом додавання 15 мл води для ін’єкцій розчин містить 66,6 МО/мл FVIII та 160 МО/мл VWF;
допоміжні речовини: альбумін людини, амінооцтова кислота, натрію хлорид, натрію цитрат, натрію гідроксид або хлористоводнева кислота (у невеликих кількостях для регулювання значення рН).
Розчинник: вода для ін’єкцій – по 5 мл, 10 мл та 15 мл.
Активність FVIII (МО) визначають за допомогою хромогенного аналізу відповідно до Європейської фармакопеї. Питома активність FVIII препарату Гемате® П становить приблизно 2–6 МО FVIII/мг білка.
Активність VWF (МО) вимірюють відповідно до ристоцетин-кофакторної активності (VWF:RCo) у порівнянні з міжнародним стандартним зразком концентрату фактора фон Віллебранда (ВООЗ). Питома активність VWF препарату Гемате® П становить приблизно 5–17 МО VWF:RCo/мг білка.
Гемате® П виробляють з донорської плазми людини.
Лікарська форма. Порошок та розчинник для розчину для ін’єкцій або інфузій.
Основні фізико-хімічні властивості: білий порошок та прозорий безбарвний розчинник для розчину для ін’єкцій/інфузій.
Фармакотерапевтична група.
Гемостатичні засоби. Фактори згортання крові. Фактор фон Віллебранда в комбінації з фактором згортання VIII.
Код АТХ B02B D06.
Фармакологічні властивості.
Фармакодинаміка.
Фактор фон Віллебранда
Гемате® П діє так само, як і ендогенний VWF.
Крім функції білка, що захищає фактор VIII, фактор Віллебранда опосередковує адгезію тромбоцитів у місцях ушкодження судин та відіграє головну роль в агрегації тромбоцитів.
Застосування VWF дає змогу коригувати порушення гемостазу у пацієнтів з дефіцитом VWF (VWD) на двох рівнях:
- VWF відновлює адгезію тромбоцитів до васкулярного субендотелію у місці ушкодження судин (оскільки він зв’язується як із васкулярним субендотелієм, так і з мембраною тромбоцита), забезпечуючи первинний гемостаз, про що свідчить зменшення часу кровотечі. Цей ефект виникає негайно і, як відомо, значною мірою залежить від високого вмісту високомолекулярних VWF-мультимерів.
- VWF сприяє відстроченій корекції асоційованого дефіциту FVIII. При внутрішньовенному введенні VWF зв’язує ендогенний FVIII (який зазвичай виробляється у пацієнта) і, стабілізуючи цей фактор, перешкоджає його швидкій деградації.
Через це введення чистого VWF (препарату VWF з низьким рівнем FVIII) відновлює рівень FVIII:C до нормального як вторинний ефект після першої інфузії з невеликою затримкою.
Введення препарату FVIII:C, що містить VWF, відновлює рівень FVIII:C до нормального відразу після першої інфузії.
Фактор VIII
Гемате® П діє так само, як і ендогенний FVIII.
Комплекс фактор VIII/ фактор фон Віллебранда складається з двох молекул (фактора VIII та фактора фон Віллебранда) з різними фізіологічними функціями.
При введенні пацієнту з гемофілією фактор VIII зв’язується з фактором фон Віллебранда в системі кровообігу пацієнта.
Активований фактор VIII діє як кофактор для активованого фактора IX, прискорюючи перетворення фактора X в активований фактор X. Активований фактор X перетворює протромбін на тромбін. Тромбін, у свою чергу, перетворює фібриноген на фібрин і сприяє утворенню тромбу. Гемофілія А є спадковим, пов’язаним зі статтю розладом згортання крові внаслідок зниження рівня фактора VIII, що призводить до профузних кровотеч у суглоби, м’язи або внутрішні органи, спонтанно або внаслідок випадкової травми чи хірургічного втручання. Замісна терапія підвищує рівень фактора VIII у плазмі крові, що дає змогу тимчасово усунути дефіцит фактора та скоригувати схильність до кровотеч.
Слід зазначити, що річна частота кровотеч (ABR) не порівнювана при застосуванні різних концентратів факторів та в різних клінічних дослідженнях.
Фармакокінетика
Фактор фон Віллебранда
Фармакокінетику препарату Гемате® П оцінювали у 28 пацієнтів з VWD [тип 1, n = 10; тип 2А, n = 10; тип 2M, n = 1; тип 3, n = 7] у стані без кровотечі. Медіана кінцевого періоду напіввиведення VWF:RCo (двокамерна модель) становила 9,9 год (діапазон 2,8–51,1 год). Медіана початкового періоду напіввиведення становила 1,47 год (діапазон 0,28–13,86 год). Медіана відновлення in vivo для активності VWF:RCo становила 1,9 (МО/дл)/(МО/кг) [діапазон 0,6–4,5 (МО/дл)/(МО/кг)]. Медіана AUC становила 1664 МО/дл·год (діапазон 142–3846 МО/дл·год), медіана MRT становила 13,7 год (діапазон 3,0–44,6 год), а середній кліренс становив 4,81 мл/кг/год (діапазон 2,08–53,0 мл/кг/год).
Максимальний рівень VWF у плазмі крові зазвичай спостерігається приблизно через 50 хв після введення. Максимальний рівень FVIII спостерігається через 1-1,5 год після введення.
Фактор VIII
Після внутрішньовенної ін’єкції спостерігається швидке підвищення активності фактора VIII (FVIII:C) у плазмі крові з подальшим швидким зниженням активності та наступним повільним зниженням активності. Дослідження за участю пацієнтів з гемофілією А продемонстрували середній період напіввиведення 12,6 год (діапазон 5,0–27,7 год). Загальна медіана відновлення FVIII in vivo становила 1,73 МО/дл на 1 МО/кг (діапазон 0,5-4,13). В одному дослідженні було встановлено, що середній час утримання (MRT) становив 19,0 год (діапазон 14,8–40,0 год), середня площа під кривою (AUC) становила 36,1 (% * год)/(МО/кг) (діапазон 14,8–72,4 (% * год)/(МО кг)), середній кліренс становив 2,8 мл/год/кг (діапазон 1,4–6,7 мл/год/кг).
Діти
Немає фармакокінетичних даних щодо пацієнтів віком до 12 років.
Доклінічні дані з безпеки
Гемате® П містить фактор VIII і фактор фон Віллебранда як діючі речовини, що отримуються з плазми людини та діють як ендогенні складові плазми. При введенні одноразової дози препарату Гемате® П у різних видів тварин не було виявлено токсичних ефектів. Доклінічні дослідження із застосуванням багаторазових доз (хронічна токсичність, канцерогенність та мутагенність) не можуть бути обґрунтовано проведені на звичайних тваринних моделях через розвиток антитіл після застосування гетерологічних білків людини.
Клінічні характеристики.
Показання.
Хвороба Віллебранда (VWD)
Для профілактики та лікування кровотеч або кровотеч при хірургічному втручанні, якщо монотерапія десмопресином (DDAVP) неефективна чи протипоказана.
Гемофілія А (вроджений дефіцит фактора VIII)
Для профілактики та лікування кровотеч у пацієнтів з гемофілією А.
Препарат можна використовувати для контролю перебігу набутого дефіциту фактора VIII та для лікування пацієнтів з наявністю антитіл до фактора VIII.
Протипоказання.
Підвищена чутливість до діючої речовини або до будь-яких допоміжних речовин (див. розділ «Склад»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Взаємодія VWF та FVIII з іншими лікарськими засобами не досліджувалася.
Особливості застосування.
Відстеження
Щоб покращити відстеження біологічних лікарських засобів, назву та номер серії препарату, що вводиться, потрібно чітко зафіксовувати.
Гіперчутливість
Можливі реакції гіперчутливості алергічного типу. При появі симптомів гіперчутливості пацієнтам рекомендується негайно припинити застосування препарату та звернутися до лікаря. Пацієнтам слід повідомити про ранні ознаки реакцій гіперчутливості, зокрема про висип, генералізовану кропив’янку, стиснення в грудях, хрипи, гіпотензію та анафілаксію. У разі розвитку шокового стану слід дотримуватись чинних медичних стандартів щодо лікування шоку.
Хвороба Віллебранда
Існує ризик виникнення тромботичних ускладнень, включно з тромбоемболією легеневої артерії, особливо у пацієнтів з відомими клінічними або лабораторними факторами ризику (наприклад, за відсутності профілактики тромбоутворення у періопераційний період, при відсутності ранньої мобілізації, ожирінні, передозуванні, онкологічних захворюваннях). Тому стан пацієнтів групи ризику необхідно контролювати щодо появи ранніх ознак тромбозу. Профілактику венозної тромбоемболії слід проводити відповідно до чинних рекомендацій.
При використанні препарату VWF лікар повинен знати, що тривале лікування може призвести до надмірного підвищення FVIII:C. У пацієнтів, які отримують препарати VWF, що містять фактор VIII, слід контролювати рівень FVIII:C у плазмі крові, щоб уникнути тривалого підвищення рівня FVIII:C у плазмі крові, яке пов’язане з підвищеним ризиком розвитку тромботичних ускладнень, а також слід розглянути проведення антитромботичних заходів.
У пацієнтів з VWF, особливо у пацієнтів з VWD 3 типу, можуть вироблятися нейтралізуючі антитіла (інгібітори) до VWF. Якщо не вдається досягти очікуваного рівня активності VWF:RCo у плазмі крові або якщо не вдається припинити кровотечу за допомогою відповідної дози, необхідно провести аналіз на наявність інгібіторів VWF. У пацієнтів із високим рівнем інгібіторів терапія може бути неефективною, тому слід розглянути інші варіанти лікування.
Гемофілія А
Інгібітори
Утворення нейтралізуючих антитіл (інгібіторів) до фактора VIII є відомим ускладненням при лікуванні пацієнтів з гемофілією А. Ці інгібітори зазвичай є імуноглобулінами IgG, спрямованими проти прокоагуляційної активності фактора VIII, які кількісно вимірюються в одиницях Бетезда (БО) на 1 мл плазми за допомогою модифікованого аналізу. Ризик утворення інгібіторів корелює з тяжкістю захворювання, а також із впливом фактора VIII. Цей ризик є найвищим протягом перших 50 днів експозиції, але зберігається протягом усього життя, хоча є нечастим.
Клінічне значення розвитку інгібітора буде залежати від титру інгібітора, при цьому низький титр створює менший ризик недостатньої клінічної відповіді, ніж високий титр інгібітора.
Загалом у всіх пацієнтів, які отримують лікування препаратами фактора згортання крові VIII, слід ретельно контролювати розвиток інгібіторів шляхом відповідних клінічних спостережень та лабораторних досліджень. Якщо не вдається досягти бажаного рівня активності фактора VIII у плазмі крові або якщо кровотеча не припиняється при введенні відповідної дози, необхідно провести аналіз на наявність інгібітора FVIII. У пацієнтів із високим рівнем інгібітора терапія фактором VIII може бути неефективною, тому слід розглянути інші варіанти лікування. Лікування таких хворих повинен проводити лікар, що має досвід лікування пацієнтів з гемофілією А та пацієнтів з інгібіторами фактора VIII.
Серцево-судинні ризики
У пацієнтів із наявними факторами серцево-судинного ризику замісна терапія FVIII може підвищити серцево-судинний ризик.
Ускладнення, пов’язані із застосуванням катетера
Якщо потрібен пристрій центрального венозного доступу (CVAD), слід враховувати ризик ускладнень, пов’язаних з CVAD, таких як місцеві інфекції, бактеріємія та тромбоз у місці введення катетера.
Вірусна безпека
Стандартні заходи щодо запобігання передачі інфекції внаслідок застосування лікарських препаратів, виготовлених з людської крові або плазми, полягають у виборі донорів, тестуванні індивідуальних донацій та пулів плазми на специфічні маркери інфекції, а також у виконанні ефективних виробничих операцій для інактивації/елімінації вірусів. Незважаючи на це, при введенні препаратів, виготовлених з крові або плазми людини, не можна цілком виключити можливість передачі збудників інфекції. Це також стосується невідомих або нових на сьогодні вірусів та інших патогенів.
Заходи, яких вживають, вважаються ефективними щодо оболонкових вірусів, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту В (HBV) і вірус гепатиту С (HCV), а також для безоболонкових вірусів, таких як вірус гепатиту А (HAV).
Ці заходи можуть мати обмежену ефективність щодо безоболонкових вірусів, таких як парвовірус В19.
Інфікування парвовірусом В19 може мати серйозні наслідки для вагітних жінок (інфікування плода) і людей з імунодефіцитом або підвищеним еритропоезом (наприклад, при гемолітичній анемії).
Слід розглянути відповідне проведення щеплення (від гепатиту A і B) пацієнтам, яким регулярно/повторно застосовують препарати FVIII/VWF, отримані з плазми крові людини.
Натрій.
Препарат Гемате® П з активністю 250 МО FVIII / 600 МО VWF містить менше 1 ммоль натрію (23 мг) на одиницю дозування, тобто його можна вважати таким, що не містить натрію.
Препарат Гемате® П з активністю 500 МО FVIII / 1200 МО VWF містить 26 мг натрію на флакон, що еквівалентно 1,3 % від рекомендованої ВООЗ максимальної добової норми споживання, яка становить 2 г натрію для дорослої людини.
Препарат Гемате® П з активністю 1000 МО FVIII / 2400 МО VWF містить 52,5 мг натрію на флакон, що еквівалентно 2,6 % від рекомендованої ВООЗ максимальної добової норми споживання, яка становить 2 г натрію для дорослої людини.
Застосування у період вагітності або годування груддю.
Дослідження репродуктивної токсичності на тваринах із використанням препарату Гемате® П не проводилися.
Гемофілія А
У зв’язку з тим, що гемофілія А рідко зустрічається у жінок, досвід застосування фактора VIII під час вагітності та лактації відсутній.
Хвороба Віллебранда
Хвороба Віллебранда успадковується аутосомно. У жінок це захворювання є частішим, ніж у чоловіків, через додатковий ризик, пов’язаний із втратою крові під час менструації, вагітності, пологів та при розвитку гінекологічних захворювань. На підставі досвіду післяреєстраційного застосування можна рекомендувати використання замінників VWF для лікування та профілактики гострих кровотеч. Клінічні дані щодо замісної VWF-терапії під час вагітності та лактації відсутні.
Таким чином, у період вагітності та лактації VWF та FVIII слід застосовувати лише за наявності безперечних показань.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Не спостерігалося жодного впливу препарату Гемате® П на здатність керувати автотранспортом або працювати з іншими механізмами.
Спосіб застосування та дози.
Спосіб застосування
Препарат вводиться внутрішньовенно.
Лікування слід проводити під наглядом лікаря, який має досвід у лікуванні хворих на гемофілію.
Слід відновити препарат згідно з «Інструкцією для приготування препарату перед застосування», представленою нижче. Перед застосуванням відновлений препарат слід нагріти до кімнатної температури або температури тіла. Слід вводити внутрішньовенно повільно, зі швидкістю, комфортною для пацієнта. Після того, як препарат було перенесено у шприц, його слід використати негайно.
У разі необхідності введення більшої кількості фактора, це також можна зробити шляхом інфузії. Для цього слід перенести відновлений препарат у прийнятну інфузійну систему.
Швидкість ін’єкції або інфузії не повинна перевищувати 4 мл на хвилину. Необхідно вести спостереження за пацієнтом для виявлення будь-якої алергічної реакції негайного типу. Якщо виникає будь-яка реакція, що може бути пов’язана із застосуванням препарату Гемате® П, слід зменшити швидкість інфузії або припинити застосування залежно від клінічного стану пацієнта.
Дозування
Хвороба Віллебранда
Важливо розрахувати дозу, використовуючи вказану кількість МО VWF:RCo.
Як правило, 1 МО/кг VWF:RCo підвищує рівень циркулюючого у крові VWF:RCo на 0,02 МО/мл (2 %).
Необхідно досягти рівнів VWF:RCo > 0,6 МО/мл (60 %) та FVIII:C > 0,4 МО/мл (40 %).
Зазвичай для досягнення гемостазу рекомендується 40–80 МО/кг фактора Віллебранда (VWF:RCo) та 20–40 МО FVIII:C/кг маси тіла.
Може бути потрібна початкова доза 80 МО/кг фактора фон Віллебранда, особливо для пацієнтів із хворобою Віллебранда 3 типу, коли підтримання адекватного рівня може вимагати більших доз, ніж при інших типах хвороби Віллебранда.
Профілактика кровотеч в разі хірургічного втручання або важкої травми
Для запобігання надмірній кровотечі під час або після операції введення слід починати за 1–2 години до хірургічного втручання.
Відповідну дозу слід повторно вводити кожні 12–24 години. Доза та тривалість лікування залежать від клінічного стану пацієнта, типу та тяжкості кровотечі, а також рівнів VWF:RCo та FVIII:C.
При використанні фактора фон Віллебранда, що містить FVIII, лікар повинен знати, що тривале лікування може призвести до надмірного підвищення FVIII:C. Після 24–48 годин лікування, щоб уникнути неконтрольованого підвищення FVIII:C, слід розглянути можливість зниження дози та/або подовження інтервалу між застосуванням.
Діти
Дозування для дітей залежить від маси тіла, тому в основному ґрунтується на тих самих рекомендаціях, що й для дорослих. Для визначення частоти введення слід завжди орієнтуватися на клінічну ефективність у кожному конкретному випадку.
Гемофілія А
Дозування
У ході лікування необхідно визначати рівень фактора VIII для розрахунку доз і частоти повторних інфузій. Окремі пацієнти можуть відрізнятися у своїй реакції на фактор VIII, досягаючи різних рівнів відновлення in vivo та демонструючи різні періоди напіввиведення. Пацієнтам із недостатньою або надлишковою масою тіла може бути потрібне коригування дози залежно від маси тіла. У разі великих хірургічних втручань особливо важливим є точний моніторинг замісної терапії за допомогою коагуляційніх тестів (на активність фактора VIII).
Необхідно стежити за появою інгібітора фактора VIII, див. також розділ «Особливості застосування».
Важливо розрахувати дозу, використовуючи вказану кількість МО FVIII:RCo.
Дозування і тривалість замісної терапії залежать від ступеня недостатності фактора VIII, локалізації та інтенсивності кровотечі, а також клінічного стану хворого.
Кількість фактора VIII виражають у міжнародних одиницях (МО), що розраховуються відповідно до поточного міжнародного стандарту ВООЗ препаратів, що містять фактор коагуляції крові VІІІ. Активність фактора VIII в плазмі крові виражається або у відсотках (відповідно до нормальної плазми крові людини), або переважно в МО (відповідно до міжнародного стандарту фактора VIII в плазмі крові).
1 МО активності фактора VIII еквівалентна кількості фактора VIII в 1 мл нормальної плазми людини.
Лікування на вимогу
Необхідна доза фактора VIІІ розраховується на основі емпіричного досвіду, згідно з яким 1 МО фактора VІІІ на 1 кг маси тіла підвищує активність фактора VІІІ у плазмі приблизно на 2 % (2 МО/дл) від нормальної активності. Необхідна доза розраховується за такою формулою:
Необхідна кількість одиниць = маса тіла [кг] × бажане підвищення фактора VIII [% або МО/дл] × 0,5.
Для визначення кількості і частоти введення слід орієнтуватися на клінічну ефективність у кожному індивідуальному випадку.
У разі виникнення нижчезазначених геморагічних явищ активність фактора VІІІ за відповідний період не повинна бути нижча рівня активності плазми (у % від нормального рівня або в МО/дл).
Наведену нижче таблицю 1 можна використовувати для визначення дозування при кровотечах та хірургічних втручаннях.
Таблиця 1
|
Тип кровотечі / тип хірургічного втручання |
Необхідний рівень фактора VIII (% або МО/дл) |
Частота введення (год) / тривалість лікування (дні) |
|
Кровотеча |
||
|
Ранній гемартроз, м’язова або ротова кровотеча |
20–40 |
Повторна інфузія кожні 12–24 год. Принаймні 1 день, поки не буде зупинена кровотеча (за больовими відчуттями) або поки не відбудеться загоєння. |
|
Більш обширний гемартроз, м’язова кровотеча або гематома |
30–60 |
Повторна інфузія кожні 12–24 год. Протягом 3–4 днів або довше, до зникнення болю і відновлення рухливості. |
|
Кровотечі, що становлять загрозу для життя |
60–100 |
Повторна інфузія кожні 8–24 год, до зникнення загрози життю. |
|
Хірургічні втручання |
||
|
Незначні, включаючи видалення зуба |
30–60 |
Кожні 24 год. Не менше 1 доби, до одужання. |
|
Суттєві |
80–100 (до і після операції) |
Повторна інфузія кожні 8–24 год, до адекватного загоєння рани. Потім 7 днів терапії для підтримання активності фактора VIII на рівні 30–60 % (МО/дл). |
Профілактика
Для тривалого профілактичного лікування тяжкої форми гемофілії А рекомендовано дозування 20–40 МО фактора VIII на 1 кг маси тіла кожні 2–3 дні. Іноді, особливо при лікуванні молодих пацієнтів, може виникнути потреба скоротити інтервали між введеннями або збільшити дозу.
Діти
Немає даних клінічних досліджень щодо дозування препарату Гемате® П для дітей.
Інструкція для приготування препарату перед застосуванням
Загальні інструкції
· Розчин має бути прозорим або дещо опалесцентним. Після фільтрації/забору (див. нижче) відновлений препарат необхідно візуально перевірити на наявність механічних включень та зміну забарвлення перед його введенням. Навіть якщо рекомендації щодо проведення процедури відновлення точно дотримуються, нерідко залишається кілька пластівчастих часток або включень. Фільтр, що входить до складу пристрою для додавання розчинника «Mix-2Vialтм 20/20», повністю видаляє ці частки. Фільтрація не впливає на розрахунок дозування. Не можна використовувати каламутний розчин або розчин, який все ще містить пластівчасті частки або механічні включення після фільтрації.
· Відновлення розчину та його забір повинні проводитися в асептичних умовах.
Відновлення
Доведіть розчинник до кімнатної температури. Зніміть ковпачки з флаконів з препаратом і розчинником, пробки слід обробити антисептичним розчином і дати висохнути перед відкриттям упаковки із вбудованим фільтром «Mix-2Vialтм 20/20».
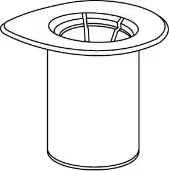 1
1
|
1. Відкрити блістерну упаковку «Mix-2Vialтм 20/20», знявши верхній шар. Не виймати «Mix-2Vialтм 20/20» із блістерної упаковки! |
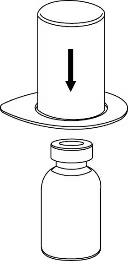 2
2
|
2. Розмістити флакон з розчинником на рівну чисту поверхню і міцно тримати флакон. Взяти «Mix-2Vialтм 20/20» разом із блістерною упаковкою і гострим стрижнем синьої частини адаптера проткнути прямо вниз пробку флакона з розчинником. |
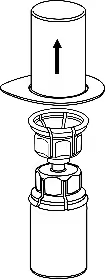 3
3
|
3. Обережно зняти блістерну упаковку з пристрою для додавання розчинника «Mix-2Vialтм 20/20», тримаючи його за край і тягнучи вертикально вгору. Переконатися, що знято лише тільки блістерну упаковку, а не витягнутий сам пристрій «Mix-2Vialтм 20/20». |
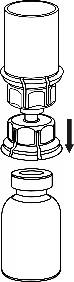 4
4
|
4. Помістити флакон з препаратом на рівну тверду поверхню. Перевернути флакон з розчинником з приєднаним до нього пристроєм «Mix-2Vialтм 20/20», потім гострим стрижнем прозорої частини адаптера проткнути прямо вниз пробку флакона з препаратом. Розчинник автоматично переміститься до флакона з препаратом. |
 5
5
|
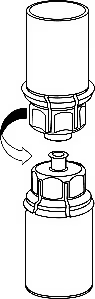
5. Однією рукою тримати пристрій «Mix-2Vialтм 20/20» з боку флакона з препаратом, а іншою – з боку флакона з розчинником і, обережно повертаючи, роз’єднати набір на дві частини, щоб уникнути надмірного утворення піни під час розчинення препарату. Відкласти убік флакон з розчинником з приєднаним синім адаптером «Mix-2Vialтм 20/20». |
 6
6
|
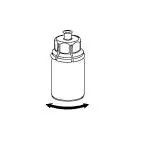
6. Обережно обертати круговими рухами флакон з препаратом з приєднаним прозорим адаптером, поки речовина не розчиниться повністю. Не струшувати. |
 7
7
|
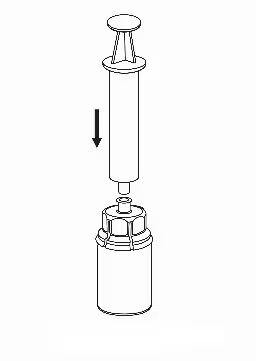
7. Втягнути повітря в порожній стерильний шприц. Тримаючи флакон з препаратом вертикально, приєднати шприц до наконечника Luer пристрою «Mix-2Vialтм 20/20». Ввести повітря всередину флакона з препаратом. |
Забір та відʼєднання
 8
8
|
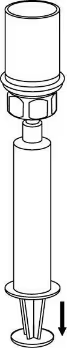
8. Тримаючи поршень шприца натиснутим, перевернути систему догори дном і втягнути розчин у шприц, повільно відтягуючи поршень назад. |
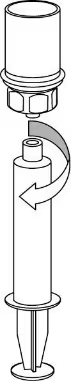 9
9
|
9. Тепер, коли розчин набраний у шприц, міцно тримати циліндр шприца (поршень шприца має бути спрямований униз) і від’єднати прозорий адаптер «Mix-2Vialтм 20/20» від шприца. |
Для ін’єкцій препарату Гемате® П рекомендується використовувати одноразові пластикові шприци, оскільки розчини цього типу можуть прилипати до стінок цільноскляних шприців.
Повільно ввести розчин внутрішньовенно (див. розділ «Спосіб застосування та дози»), звертаючи увагу на те, щоб у шприц з препаратом не потрапила кров.
Будь-який невикористаний препарат або відходи слід утилізувати відповідно до національних вимог.
Діти.
Препарат застосовують відповідно до рекомендацій, зазначених у розділі «Спосіб застосування та дози».
Передозування.
Про симптоми передозування VWF та FVIII не повідомлялося. Однак ризик тромбозу не можна виключити у разі надзвичайно високої дози, особливо препаратів VWF, що містять FVIII, з високим вмістом FVIII.
Побічні реакції.
Наведені нижче побічні реакції відомі з досвіду післяреєстраційного застосування.
Висновки профілю безпеки
Під час лікування препаратом Гемате® П у дорослих і підлітків можуть виникнути такі побічні реакції: гіперчутливість або алергічні реакції, тромбоемболічні ускладнення та пірексія. Крім того, у пацієнтів можуть з’явитися інгібітори FVIII та VWF.
Зведена таблиця побічних реакцій
Таблицю 2 складено відповідно до класифікації системам органів за MedDRA.
Категорії частоти визначалися згідно з такими критеріями: дуже часто (≥ 1/10); часто (від ≥ 1/100 до < 1/10); нечасто (від ≥ 1/1 000 до < 1/100); рідко (від ≥ 1/10 000 до < 1/1 000); дуже рідко (< 1/10 000); частота невідома (не можна оцінити на основі наявних даних).
Таблиця 2
|
Система органів |
Побічна реакція |
Частота |
|
Порушення з боку крові та лімфатичної системи |
Гіперволемія Гемоліз Інгібування VWF Інгібування FVIII |
Частота невідома Частота невідома Дуже рідко Нечасто (PTP)* Дуже часто (PUP)* |
|
Загальні розлади та порушення в місці введення |
Лихоманка |
Дуже рідко |
|
Порушення з боку імунної системи |
Гіперчутливість (алергічні реакції) |
Дуже рідко |
|
Порушення з боку судин |
Тромбоз Тромбоемболічні ускладнення |
Дуже рідко Дуже рідко |
* Частоту визначено на основі досліджень з усіма препаратами FVIII, в які включали пацієнтів з тяжкою гемофілією A.
PTP – пацієнти, які раніше отримували лікування.
PUP – пацієнти, які раніше не отримували лікування.
Опис деяких побічних реакцій
Порушення з боку крові та лімфатичної системи
Коли необхідні дуже великі або часто повторювані дози або коли наявні інгібітори, або коли залучається до- та післяопераційний догляд, стан усіх пацієнтів слід контролювати щодо ознак гіперволемії. Крім того, стан пацієнтів з групами крові А, В і АВ слід контролювати щодо ознак внутрішньосудинного гемолізу та/або зниження показників гематокриту.
Загальні розлади та порушення в місці введення
Дуже рідко спостерігалася лихоманка.
Порушення з боку імунної системи
Гіперчутливість або алергічні реакції (які можуть включати ангіоневротичний набряк, відчуття печіння і поколювання у місці інфузії, озноб, почервоніння, генералізовану кропив’янку, головний біль, висип, гіпотензію, млявість, нудоту, неспокій, тахікардію, стиснення в грудях, відчуття пощипування, блювання, хрипи) спостерігалися дуже рідко; в деяких випадках вони можуть прогресувати до тяжкої анафілаксії (включно з шоком).
Хвороба Віллебранда
Порушення з боку крові та лімфатичної системи.
У пацієнтів з VWF, особливо у пацієнтів з VWD 3 типу, можуть дуже рідко вироблятися нейтралізуючі антитіла (інгібітори) до VWF. Якщо такі інгібітори з’являються, стан буде проявлятися неадекватною клінічною відповіддю. Такі антитіла викликають преципітацію і можуть з’являтися одночасно з анафілактичними реакціями. Тому пацієнтів, у яких виникла анафілактична реакція, слід обстежити на наявність інгібітора.
У всіх таких випадках рекомендується звертатися до спеціалізованих центрів з гемофілії.
Порушення з боку судин
Дуже рідко існує ризик тромботичних/тромбоемболічних ускладнень (включно з емболією легеневої артерії).
У пацієнтів, які отримують препарати VWF, у плазмі крові спостерігається високий рівень FVIII:C, що може підвищити ризик тромботичних ускладнень (див. також розділ «Особливості застосування»).
Гемофілія А
Порушення з боку крові та лімфатичної системи
У пацієнтів з гемофілією А, які лікуються фактором VIII, у тому числі препаратом Гемате® П, можливий розвиток нейтралізуючих антитіл (інгібіторів). Якщо такі інгібітори з’являються, стан може проявлятися неадекватною клінічною відповіддю. У таких випадках рекомендується звертатися до спеціалізованих центрів з гемофілії.
З питань безпеки щодо збудників інфекції див. розділ «Особливості застосування».
Діти
Очікується, що частота, тип та тяжкість побічних реакцій у дітей є подібними до реакцій у дорослих.
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua/.
Термін придатності. 3 роки.
Була продемонстрована хімічна та фізична стабільність відновленого препарату протягом 8 годин при температурі 25 °C. З мікробіологічної точки зору та оскільки лікарський засіб не містить консервантів, відновлений розчин слід застосовувати негайно. Якщо препарат не був застосований одразу, час його зберігання при кімнатній температурі не повинен перевищувати 8 годин.
Якщо препарат було перенесено в шприц, слід використати його негайно.
Умови зберігання.
Зберігати при температурі не вище 25 ºС. Не заморожувати. Зберігати в оригінальній упаковці. Зберігати в недоступному для дітей місці.
Несумісність.
Цей лікарський засіб не можна змішувати з іншими лікарськими засобами, речовинами для розведення та розчинниками, окрім води для ін’єкцій, яка додається в комплекті.
Упаковка.
По 1 флакону з порошком у комплекті з 1 флаконом з розчинником (вода для ін’єкцій) та 1 пристроєм для додавання розчинника з вбудованим фільтром 15 мкм («Mix-2Vialтм 20/20») та 1 картонною упаковкою з набором для внутрішньовенного введення (1 одноразовий шприц, 1 голка-метелик, 2 дезінфікуючі серветки в індивідуальних герметичних упаковках та 1 нестерильний лейкопластир) у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
ЦСЛ Берінг ГмбХ.
CSL Behring GmbH.
Місцезнаходження виробника та його адреса місця провадження діяльності.
Еміль-фон-Берінг-Штрассе 76, 35041 Марбург, Німеччина.
Emil-von-Behring-Strasse 76, Marburg, 35041, Germany.
