БРІНЕЙРА
-
Ірландія БіоМарин Інтернешнл ЛімітедФорма выпуска: розчин для інфузій, 30 мг/мл; по 5 мл розчину для інфузій у прозорому скляному флаконі (скло I типу), закупореному пробкою (бутилкаучук) з фторполімерним покриттям та обтиснутому алюмінієвою кришкою типу flip-off seal з пластиковим ковпачком зеленого кольору; по 2 флакони з розчином для інфузій у комплекті з 1 флаконом з розчином для промивання (по 5 мл розчину для промивання у прозорому скляному флаконі (скло I типу), закупореному пробкою (бутилкаучук) з фторполімерним покриттям та обтиснутому алюмінієвою кришкою типу flip-off seal з пластиковим ковпачком жовтого кольору) в картонній коробціСостав: 1 мл розчину для інфузій містить 30 мг церліпонази альфа; /1 флакон містить 150 мг церліпонази альфаУсловия отпуска: за рецептомНомер регистрационного свидетельства: UA/16841/01/01код АТХ: A16AB17Срок годности: 2 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
БРІНЕЙРА
(BRINEURA)
Склад:
діюча речовина: сerliponase alfa;
1 мл розчину для інфузій містить 30 мг церліпонази альфа;
1 флакон містить 150 мг церліпонази альфа;
допоміжні речовини: натрію гідрофосфат, гептагідрат; натрію дигідрофосфат, моногідрат; натрію хлорид; калію хлорид; магнію хлорид, гексагідрат; кальцію хлорид, дигідрат; вода для ін’єкцій.
Флакон з 5 мл розчину для промивання містить: натрію гідрофосфат, гептагідрат; натрію дигідрофосфат, моногідрат; натрію хлорид; калію хлорид; магнію хлорид, гексагідрат; кальцію хлорид, дигідрат; воду для ін’єкцій.
Лікарська форма. Розчин для інфузій.
Основні фізико-хімічні властивості: рідина від прозорої до злегка опалесціюючої, від безбарвної до блідо жовтого кольору, практично вільна від часток, може містити ендогенні білкові частки, які спостерігаються у вигляді напівпрозорих волокон або непрозорих часток;
розчин для промивання: прозора безбарвна рідина, практично вільна від часток.
Фармакотерапевтична група. Засоби, що впливають на функцію травної системи та обмін речовин. Ферменти. Код АТХ А16А В17.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Церліпоназа альфа – це рекомбінантна форма людської трипептидилпептидази-1 (rhTPP1), що виробляється в клітинах яєчників китайських хом’яків.
Церліпоназа альфа являє собою протеолітичний неактивний профермент (зимоген), що активується в лізосомах. Церліпоназа альфа захоплюється клітинами-мішенями і переміщується в лізосоми через катіоннезалежний манозо-6-фосфатний рецептор (CI- MPR, також відомий як рецептор M6P/IGF2). Профіль глікозилювання церліпонази альфа забезпечує стабільне поглинання клітинами та потрапляння в лізосоми для активації.
Активований протеолітичний фермент (rhTPP1) відщеплює трипептиди від N-кінця білка-мішені з невідомою специфічністю субстрату. Недостатні рівні TPP1 спричиняють нейрональний цероїдний ліпофусциноз 2 типу (CLN2), що призводить у хворих до нейродегенерації, втрати неврологічних функцій та смерті в дитинстві.
Імуногенність
У сироватці крові та спинномозковій рідині (СМР) дуже часто виявляли антитіла до лікарського засобу (ADA). Не спостерігалось ознак впливу ADA на фармакокінетику, ефективність або безпеку застосування лікарського засобу. Однак дані обмежені.
Клінічна ефективність та безпека
Безпеку та ефективність препарату Брінейра оцінювали у трьох відкритих клінічних дослідженнях за участю загалом 38 хворих на CLN2 віком від 1 до 9 років на вихідному рівні порівняно з нелікованими хворими на CLN2, дані щодо яких брали з історичної бази даних природного перебігу захворювання (контрольна група з природним перебігом). Щоб оцінити прогресування захворювання (так звана оцінка ML за шкалою клінічної оцінки CLN2), в цих дослідженнях використовували сукупність рухових та мовних доменів хворобоспецифічної шкали клінічного оцінювання (див. таблицю 1). Кожний домен передбачає оцінки від 3 (загалом нормально) до 0 (виражене порушення) із загальною можливою оцінкою 6; зменшення оцінки відповідає важливим явищам втрати раніше досягнутих функцій здатності пересуватися та розмовляти.
Таблиця 1. Оцінка рухливості та мовлення – шкала клінічного оцінювання при CLN2
|
Домен |
Бали |
Оцінювання |
|
Рухова функція |
3 |
Загалом нормальна хода. Виражена атаксія та патологічні падіння відсутні. |
|
2 |
Самостійна хода, що визначається за здатністю пройти без допомоги 10 кроків. Спостерігається явна нестабільність, час від часу можливі падіння. |
|
|
1 |
Потребує сторонньої допомоги при ходьбі або може лише повзати. |
|
|
0 |
Більше не може ходити або повзати. |
|
|
Мова |
3 |
Видимо нормальна мова. Розбірлива й загалом відповідна до віку. Відхилень поки що не спостерігається. |
|
2 |
Мова стає помітно порушеною: деякі слова нерозбірливі, пацієнт може формувати короткі речення для опису явищ, питань або потреб. Ця оцінка означає зниження порівняно з попереднім рівнем здатності (від максимального індивідуального досягнутого дитиною рівня). |
|
|
1 |
Тяжка для розуміння. Окремі розбірливі слова. |
|
|
0 |
Відсутність розбірливих слів або вигуків. |
В основному дослідженні 190-201 усього 24 пацієнти віком від 3 до 9 років на вихідному рівні отримували лікування препаратом Брінейра в дозі 300 мг через тиждень. З них 23 пацієнти отримували лікування протягом 48 тижнів (1 пацієнт вибув після першого тижня через нездатність продовжувати дослідницькі процедури). Середня початкова оцінка ML становила 3,5 (стандартне відхилення (СВ) 1,20) з діапазоном від 1 до 6; пацієнти з прогресуванням поширеного захворювання не брали участі в дослідженні (критерії включення − легке або помірної тяжкості прогресування CLN2-захворювання).
Загалом у 20 з 23 (87 %) пацієнтів, які отримували лікарський засіб Брінейра протягом 48 тижнів, не спостерігалося необоротного зниження оцінки на 2 бали порівняно з прогнозованим зниженням на 2 бали за 48 тижнів у групі пацієнтів, які не отримували лікування (p = 0,0002, біноміальний критерій припущення p0 = 0,50). Загалом у 15 пацієнтів з 23 (65 %) не спостерігалося загального зниження оцінки ML незалежно від вихідного показника, а у 2 з цих 15 пацієнтів показник збільшився на один бал протягом періоду лікування. У 5 пацієнтів спостерігалося зниження на 1 бал, а у 3 пацієнтів – на 2 бали.
Усі 23 пацієнти завершили дослідження 190-201 і продовжили участь у розширеному дослідженні 190-202, отримуючи лікування лікарським засобом Брінейра в дозі 300 мг через тиждень, загальною тривалістю 288 тижнів. Результати щодо ефективності досліджень 190-201 та 190-202 об’єднали та порівнювали з контрольною групою природного перебігу захворювання, що включала пацієнтів, які задовольняли критеріям включення для досліджень 190-201 та 190-202.
Медіана часу до необоротного зниження на 2 бали або до оцінки ML 0 у пацієнтів, які отримували лікарський засіб Брінейра (N = 23), становила 272 тижні порівняно з 49 тижнями в контрольній групі з природним перебігом захворювання (N = 42) (відношення ризиків 0,14, 95 % ДІ: 0,06–0,33; p < 0,0001). Медіана часу до оцінки ML 0, що свідчить про повну втрату здатності пересуватися та спілкуватися, не була досягнута у пацієнтів, які отримували лікарський засіб Брінейра, порівняно зі 109 тижнями в контрольній групі з природним перебігом захворювання (відношення ризиків 0,01; 95 % ДІ: 0,00–0,08; p < 0,0001).
Дослідницький аналіз виживаності показав, що середній вік настання летального наслідку в контрольній групі з природним перебігом захворювання становив 10,4 року; 95 % ДІ: 9,5–12,5 року. Протягом дослідження не зареєстровано летальних випадків у групі пацієнтів, які отримували лікування лікарським засобом Брінейра, середній (мінімальний, максимальний) вік на момент останнього оцінювання становив 10,3 (7,8, 13,1) року (N = 23).
Середня швидкість зниження оцінки захворювання (швидкість погіршення) пацієнтів, які отримували лікування препаратом Брінейра в дозі 300 мг через тиждень, становила 0,38 бала за 48 тижнів. Порівняно з розрахованою швидкістю погіршення в разі природного перебігу захворювання, яка становить 2,13 бала за 48 тижнів, результати дослідження є статистично значущими (p < 0,0001) (див. таблицю 2). Ефект лікування, що спостерігався, вважається клінічно значущим у світлі природного перебігу CLN2-захворювання без лікування.
Таблиця 2. Клінічна шкала оцінювання рухової та мовної функцій при захворюванні на CLN2 від 0 до 6 балів: швидкість погіршення протягом 48 тижнів (популяція пацієнтів, яким призначали досліджуване лікування (ІТТ))
|
Швидкість погіршення (балів/48 тижнів)а |
Учасники досліджень 190-201/202 Усього (n=23) |
Контрольна група з природним перебігом захворювання (n = 42) |
р-значенняb |
|
Середнє значення (СВ) |
0,38 (0,499)c |
2,13 (0,952)c |
<0,0001 |
|
Медіана |
0,30 |
2,08 |
|
|
Мін., макс. |
0,00, 2,18 |
0,45, 4,27 |
|
|
Межі 95 % ДІ |
0,16, 0,59 |
1,84, 2,43 |
a Швидкість зниження оцінки функцій у пацієнта за 48 тижнів (початкова оцінка CLN2 – остання оцінка CLN2) / (час, що минув, у відрізках 48-тижневого періоду).
b p-значення на основі порівняння швидкості зниження оцінки зі значенням 2 за допомогою 1-вибіркового Т-критерію.
c Позитивний показник вказує на клінічне погіршення; негативний показник вказує на клінічне покращення.
Розрахована середня зміна від вихідного рівня у пацієнтів, які отримують лікування препаратом Брінейра, порівняно з контрольною групою природного перебігу захворювання (N=42 пацієнти), продемонструвала уповільнення прогресування захворювання та стійкий ефект лікування до останнього оцінювання (321-й тиждень) (див. рисунок 1).
Рисунок 1. Середня зміна оцінки від початкового рівня 0–6-бальної оцінки функцій руху та мовлення (контрольна група природного перебігу захворювання порівняно з пацієнтами, які отримують лікування препаратом Брінейра в дозі 300 мг через тиждень)
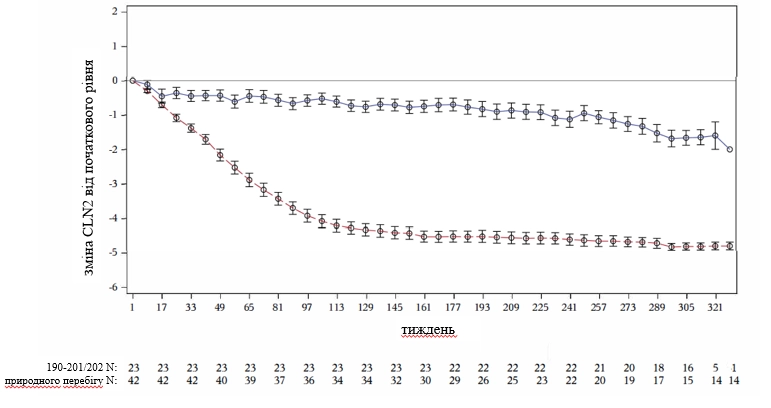
Вертикальні стовпчики на рис.1 відповідають стандартній похибці середнього значення.
Суцільна лінія − клінічні дослідження 190-201 та 190-202.
Пунктирна лінія − контрольна група природного перебігу захворювання 190-901.
Показники, визначені за допомогою МРТ-волюметрії, свідчать про сповільнення погіршення.
У дослідженні 190-203 загалом 14 хворих на CLN2 віком від 1 до 6 років на вихідному рівні (8 з 14 пацієнтів – віком до 3 років) отримували лікування лікарським засобом Брінейра протягом 142,6 тижня (1 пацієнт вибув з дослідження, щоб отримувати лікування на комерційній основі) з подальшим спостереженням для оцінки безпеки протягом 24 тижнів. Середня (СВ) оцінка ML на вихідному рівні становила 4,6 (1,69) з діапазоном від 1 до 6.
Пацієнтів, які отримували лікарський засіб Брінейра, порівнювали з відповідними за віком, оцінкою функцій руху та мовлення при CLN2 та об’єднаним генотипом пацієнтами групи з природним перебігом захворювання. Середня (± СВ) швидкість зниження оцінки ML становила 0,15 (0,243) бала за 48 тижнів для відповідних пацієнтів, які отримували лікарський засіб Брінейра (N = 12), та 1,30 (0,857) бала за 48 тижнів для відповідних пацієнтів з природним перебігом захворювання групи порівняння (N = 29). Середня різниця швидкості зниження між групами становила 1,15 бала (середня похибка 0,174), 95 % ДІ: 0,80, 1,50 бала; p < 0,0001.
Медіана часу до необоротного зниження на 2 бали або до оцінки 0 у пацієнтів, які отримували лікарський засіб Брінейра, не була досягнута до останнього оцінювання (169-й тиждень) порівняно зі 103 тижнями в групі порівняння з природним перебігом захворювання (відношення ризиків 0,091; 95 % ДІ: 0,021, 0,393; p < 0,0001). Медіана часу до оцінки ML 0 у пацієнтів, які отримували лікарський засіб Брінейра, не була досягнута порівняно зі 163 тижнями у відповідних пацієнтів з природним перебігом захворювання групи порівняння (відношення ризиків 0,00; 95 % ДІ: 0,00, 0,00; р = 0,0032). Загалом у 10 з 12 (83 %) пацієнтів, які отримували лікування, спостерігалося зниження менш ніж на 2 бали оцінки ML від вихідного рівня до останнього оцінювання. У 8 пацієнтів (67 %) не спостерігалося клінічного прогресування за шкалою ML, 2 (17 %) втратили 1 бал і 2 (17 %) втратили 2 бали. Жоден з пацієнтів, які отримували лікування, не досяг нульової оцінки ML порівняно з 10 з 29 (34 %) відповідних пацієнтів з природним перебігом захворювання групи порівняння.
Серед пацієнтів віком до 3 років середня (СВ) швидкість зниження оцінки ML становила 0,04 (0,101) бала за 48 тижнів для пацієнтів, які отримували лікування (N = 8), порівняно з 1,09 (0,562) бала за 48 тижнів для відповідних пацієнтів з природним перебігом захворювання групи порівняння (N = 20) (різниця 1,05 бала; p < 0,0001). У 7 з пролікованих пацієнтів віком до 3 років з оцінкою ML 6 балів на вихідному рівні залишилася оцінка ML 6 балів на момент останнього вимірювання, що свідчить про загалом нормальну ходу та мовлення. У трьох з цих 7 пацієнтів на 145-му тижні не спостерігалось інших симптомів CLN2, що визначалося за шкалою клінічної оцінки CLN2, за результатами візуалізації головного мозку та небажаними явищами, тоді як у всіх відповідних пацієнтів групи порівняння з’явилися симптоми захворювання. У цій популяції пацієнтів, які отримували лікарський засіб Брінейра, спостерігалося відтермінування початку захворювання.
Виняткові обставини
Цей лікарський засіб зареєстровано на умовах застосування за виняткових обставин. Це означає, що, з огляду на рідкісність захворювання, неможливо отримати повну інформацію про цей лікарський засіб.
Європейське агентство лікарських засобів щороку розглядатиме будь-яку нову інформацію, що може з’явитися, й за потреби оновлюватиме цю інструкцію для медичного застосування.
Фармакокінетика.
Фармакокінетику церліпонази альфа оцінювали в пацієнтів, хворих на CLN2, які отримували інтрацеребровентрикулярні інфузії по 300 мг протягом приблизно 4,5 години через тиждень.
Усі фармакокінетичні показники були однаковими після початкової інфузії у день 1 та після наступних інфузій на тижні 5 та тижні 13, що вказує на відсутність явного накопичення або залежності від часу фармакокінетики церліпонази альфа в спинно-мозковій рідині (СМР) або плазмі після введення в дозі 300 мг через тиждень. Фармакокінетичні показники в СМР було визначено в 17 пацієнтів; зведений огляд представлено у таблиці 3. Фармакокінетику церліпонази альфа в плазмі крові було оцінено в 13 пацієнтів; медіана Tmax дорівнювала 12 годин (від початку інфузії), середня Cmax − 1,39 мкг/мл, а середня AUC0-t − 24,1 мкг-год/мл. Явного впливу антитіл до лікарського засобу в сироватці або СМР на фармакокінетику препарату в плазмі крові або СМР не спостерігалося.
Таблиця 3. Фармакокінетичні показники після першої інтрацеребровентрикулярної інфузії (тривалістю близько 4 годин) 300 мг церліпонази альфа у СМР
|
Показник |
СМР (N=17) Середнє значення (СВ) |
|
Tmax*, год |
4,50 [4,25, 5,75] |
|
Cmax, мкг/мл |
1490 (942) |
|
AUC0-t, мкг-год/мл |
9510 (4130) |
|
Vz, мл |
435 (412) |
|
CL, мл/год |
38,7 (19,8) |
|
t1/2, год |
7,35 (2,90) |
*Tmax виражено як час від початку ~4-годинної інфузії і представлено як медіану [мін., макс.], відповідає першій часовій точці взяття зразків після інфузії.
Розподіл
Розрахунковий об’єм розподілу церліпонази альфа після інтрацеребровентрикулярної інфузії 300 мг (Vz = 435 мл) перевищує типовий об’єм СМР (100 мл), що свідчить про розподіл в інші тканини, крім СМР. Значні відношення СМР/плазма за показниками Cmax та AUC0-t (приблизно 1000 і 400 відповідно) свідчать, що більшість введеної церліпонази альфа локалізується в межах ЦНС. Немає підстав очікувати, що інтрацеребровентрикулярне введення церліпонази альфа зумовить терапевтичні концентрації в тканинах ока з огляду на обмежений доступ із СМР в уражені клітини сітківки та наявність гематоретинального бар’єра.
Виведення
Церліпоназа альфа являє собою білок, що, як очікується, метаболічно деградуватиме шляхом гідролізу пептидів. Відповідно прогнозується, що порушення функції печінки не впливатиме на фармакокінетику церліпонази альфа.
Виведення церліпонази альфа нирками вважається незначним шляхом кліренсу.
Діти віком від 0 до 3 років
Педіатричним пацієнтам з CLN2 віком від 1 до < 2 років (n = 2) та від 2 до < 3 років (n = 6) вводили церліпоназу альфа згідно з рекомендованим педіатричним режимом дозування протягом 144 тижнів. Експозиція у СМР знаходилася в межах діапазону, що характеризувався як безпечний та ефективний у основному дослідженні. Експозиція у плазмі крові пацієнтів молодшого віку мала тенденцію до перевищення діапазону, охарактеризованого в основному дослідженні, однак більша експозиція у плазмі крові не була пов’язана з чіткими змінами профілю безпеки. Фармакокінетичні дані щодо пацієнтів віком до 1 року відсутні.
Доклінічні дані з безпеки
Обмежені доклінічні дані з безпеки церліпонази альфа отримано у дослідженнях токсичності після одноразового введення на мавпах та досліджень токсичності після багаторазового введення на собаках-таксах, яких використовували для створення моделі класичного інфантильного нейронального цероїдного ліпофусцинозу 2 типу. Цю модель захворювання використовували, в першу чергу, для вивчення фармакодинамічних та фармакокінетичних властивостей церліпонази альфа, але також і для оцінювання токсичності речовини. Однак результати цих досліджень на таксах не дають змоги достовірно прогнозувати безпеку препарату для людини, оскільки режим інфузій церліпонази альфа був іншим і значно різнився навіть в межах одного дослідження через труднощі зі встановленням порожнинного катетера та виражені реакції гіперчутливості. Крім того, ці дослідження включали дуже малу кількість тварин, в яких досліджували переважно одноразове введення, та не передбачали належного контролю. Таким чином, доклінічні дослідження препарату не дають змоги зробити остаточні висновки щодо клінічної безпеки церліпонази альфа. Дослідження генотоксичності, канцерогенності та репродуктивної токсичності не проводилися.
Клінічні характеристики.
Показання.
Препарат Брінейра показаний для лікування нейронального цероїдного ліпофусцинозу 2 типу (CLN2), також відомого як дефіцит трипептидилпептидази 1 (TPP1).
Протипоказання.
Анафілактична реакція, що становить загрозу для життя, на діючу речовину або будь-яку з допоміжних речовин, зазначених у розділі «Склад», якщо проба з повторним введенням препарату неуспішна (див. розділ «Особливості застосування»).
Вентрикуло-перитонеальні шунти у хворих на CLN2.
Препарат Брінейра не можна вводити доти, доки наявні ознаки сильного підтікання з пристрою для інтрацеребровентрикулярного доступу, несправності пристрою або пов’язаної з пристроєм інфекції (див. розділи «Особливості застосування» та «Спосіб застосування та дози»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження взаємодії не проводилися. Церліпоназа альфа – рекомбінантний людський білок, і його системна експозиція обмежена через інтрацеребровентрикулярний шлях введення, тому взаємодія між церліпоназою альфа та лікарськими засобами, що метаболізуються за участю ферментів цитохрому Р450, є малоймовірною.
Особливості застосування.
Відстежуваність
З метою покращення відстежуваності біологічних лікарських засобів назва та номер серії продукту, що вводиться, повинні бути чітко записані.
Ускладнення, пов’язані з пристроєм
Щоб зменшити ризик інфекції, необхідно вводити препарат Брінейра, дотримуючись правил асептики. У пацієнтів, яких лікували препаратом Брінейра, спостерігалися випадки інфекцій, пов’язаних із застосуванням пристрою для інтрацеребровентрикулярного доступу, зокрема, субклінічні інфекції та менінгіт (див. розділ «Побічні реакції»). Менінгіт може проявлятися такими симптомами: лихоманка, головний біль, ригідність м’язів шиї, чутливість до світла, нудота, блювання та зміна психічного стану. Необхідно регулярно надсилати зразки спинномозкової рідини на аналіз для виявлення субклінічних інфекцій, пов’язаних із застосуванням пристрою. У клінічних дослідженнях призначали антибіотики, здійснювали заміну пристрою для інтрацеребровентрикулярного доступу та продовжували лікування препаратом Брінейра.
Медичні працівники повинні перевіряти волосисту частину голови пацієнта щодо цілісності шкіри перед кожною інфузією, щоб переконатися у справності пристрою для інтрацеребровентрикулярного доступу. До загальних ознак підтікання пристрою і його несправності належать набряк, еритема шкіри волосистої частини голови, екстравазація рідини або здуття шкіри волосистої частини голови навколо місця інтрацеребровентрикулярного доступу чи над ним. Однак ці ознаки можуть також виникати як симптоми пов’язаних із застосуванням пристрою інфекцій.
Перш ніж починати інфузію препаратом Брінейра, необхідно перевірити місце інфузії та прохідність пристрою для інтрацеребровентрикулярного доступу, щоб виявити підтікання та/або несправність (див. розділи «Протипоказання» та «Спосіб застосування та дози»). Ознаки та симптоми пов’язаних із застосуванням пристрою інфекцій можуть бути неявними, тому необхідно регулярно надсилати зразки спинномозкової рідини на аналіз для виявлення субклінічних інфекцій, пов’язаних із застосуванням пристрою. Щоб підтвердити цілісність пристрою, може бути необхідним звернутися за консультацією до нейрохірурга. Лікування препаратом Брінейра слід перервати у разі несправності пристрою, перед наступною інфузією може бути необхідно замінити пристрій доступу.
Після тривалого періоду використання резервуара пристрою для інтрацеребровентрикулярного доступу може статися суттєве погіршення його стану згідно з попередніми результатами контрольних тестувань, що спостерігалося під час клінічних досліджень після приблизно 4 років використання резервуара. У двох клінічних дослідженнях пристрій для інтрацеребровентрикулярного доступу не мав ознак несправності під час інфузії, однак після його видалення були видимі ознаки псування пристрою, які узгоджувалися з даними контрольного тестування пристрою для інтрацеребровентрикулярного доступу. Пристрій доступу був замінений, а пацієнт відновив лікування препаратом Брінейра.
Пристрій інтрацеребровентрикулярного доступу необхідно замінити до завершення 4-річного періоду регулярного введення Брінейри, однак слід завжди бути впевненими, що пристрій для інтрацеребровентрикулярного доступу застосовується згідно з рекомендаціями відповідного виробника медичного виробу.
У разі розвитку пов’язаних з пристроєм для інтрацеребровентрикулярного доступу ускладнень слід ознайомитися з додатковими вказівками, наведеними в документації виробника.
У разі лікування пацієнтів, схильних до ускладнень у зв’язку з інтрацеребровентрикулярним введенням лікарських засобів, в тому числі пацієнтів з обструктивною гідроцефалією, необхідно проявляти обережність.
Клінічний та лабораторний моніторинг
Основні життєві показники слід перевіряти в умовах медичної установи до початку інфузії, періодично під час інфузії та після інфузії. Після завершення інфузії слід здійснити клінічне оцінювання стану пацієнта та забезпечити більш тривале спостереження за наявності клінічних показань, особливо щодо пацієнтів віком до 3 років.
Електрокардіографічний (ЕКГ) моніторинг під час інфузії слід здійснювати пацієнтам з брадикардією, порушенням провідності або структуральними вадами серця в анамнезі, оскільки в деяких пацієнтів із CLN2 можуть розвинутися порушення провідності або хвороба серця. У пацієнтів зі здоровим серцем регулярне ЕКГ обстеження у 12 відведеннях слід виконувати кожні 6 місяців.
Зразки СМР слід відправляти на дослідження у плановому порядку з метою виявлення субклінічних, пов’язаних із пристроєм інфекцій (див. розділ «Спосіб застосування та дози»).
Педіатричні пацієнти
Існують обмежені дані щодо пацієнтів з прогресуванням поширеного захворювання на момент початку лікування. Також відсутні клінічні дані стосовно дітей віком < 1 року. Новонароджені можуть мати знижену цілісність гематоенцефалічного бар’єру. У дітей віком до 3 років вплив потенційно підвищеної експозиції лікарського засобу на периферичні відділи організму не був пов’язаний з чіткою зміною профілю безпеки (див. розділи «Фармакокінетика» та «Побічні реакції»).
Анафілактичні реакції
Під час застосування препарату Брінейра повідомлялося про випадки анафілактичних реакцій. Як запобіжний захід слід забезпечити засоби надання невідкладної медичної допомоги під час введення препарату Брінейра. У разі появи анафілактичних реакцій негайно припиніть інфузію препарату та почніть необхідне медичне лікування. Уважно спостерігайте за пацієнтами під час і після інфузії препарату.
Якщо спостерігається анафілаксія, слід проявляти обережність при повторному введенні препарату.
Вміст натрію та калію
Цей лікарський засіб містить 17,4 мг натрію в одному флаконі препарату Брінейра та розчину для промивання, що еквівалентно 0,87 % максимального щоденного споживання 2 г натрію дорослими, як рекомендовано ВООЗ.
Цей лікарський засіб містить калій. Кожен флакон містить менше 1 ммоль (39 мг) калію, тобто практично вільний від калію.
Препарат Брінейра та розчин для промивання слід використовувати одразу після розморожування. Препарат слід набирати із закритого флакона безпосередньо перед використанням. Якщо неможливо використати негайно, закриті флакони препарату Брінейра або розчину для промивання слід зберігати при температурі 2−8 °C і використати протягом 24 годин.
Доведено хімічну та фізичну стабільність в процесі використання протягом 12 годин при кімнатній температурі (19−25 °C). З мікробіологічної точки зору, відкриті флакони або набраний у шприц лікарський препарат слід використати одразу. Відповідальність за час та умови зберігання в процесі використання препарату, що не застосований негайно, несе користувач.
Застосування у період вагітності або годування груддю.
Вагітність
Дані щодо застосування препарату Брінейра вагітним жінкам відсутні. Дослідження впливу препарату Брінейра на репродуктивну функцію тварин не проводилися. Невідомо, чи може препарат Брінейра завдати шкоди плоду у разі введення препарату вагітній жінці або впливати на репродуктивну функцію. Препарат Брінейра слід призначати вагітним жінкам тільки у разі нагальної потреби.
Годування груддю
Недостатньо інформації щодо екскреції церліпонази альфа/метаболітів у грудне молоко людини. Ризик для новонароджених/немовлят не можна виключити. Під час лікування препаратом Брінейра годування груддю слід припинити.
Фертильність
Дослідження впливу церліпонази альфа на фертильність тварин або людини не проводилися.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Дослідження впливу препарату Брінейра на здатність керувати транспортними засобами та працювати з іншими механізмами не проводилися.
Спосіб застосування та дози.
Препарат Брінейра повинен вводити тільки спеціально підготовлений медичний працівник, який володіє методикою інтрацеребровентрикулярного введення, в умовах лікувального закладу.
Дозування
Рекомендована доза становить 300 мг церліпонази альфа, що вводиться один раз кожні два тижні (через тиждень) шляхом інтрацеребровентрикулярної інфузії.
Для пацієнтів віком до 2 років рекомендуються нижчі дози (див. розділ «Педіатричні пацієнти»).
За 30−60 хвилин до початку інфузії рекомендується проведення премедикації антигістамінними засобами з антипіретиками або без.
Продовження тривалого лікування вимагає регулярного клінічного оцінювання співвідношення користі та потенційних ризиків для конкретного пацієнта.
Корекція дозування
Якщо пацієнт не може переносити інфузію, слід розглянути можливість корекції дозування. Дозу можна знизити на 50 % та/або зменшити швидкість інфузії.
Якщо інфузію довелося перервати через реакцію гіперчутливості, її слід поновити зі швидкістю, що приблизно дорівнює половині початкової швидкості інфузії, на фоні якої розвинулася реакція гіперчутливості.
Слід перервати інфузію та/або зменшити її швидкість, якщо, на думку лікаря, в пацієнта під час інфузії може підвищуватися внутрішньочерепний тиск, на що вказують такі симптоми, як головний біль, нудота, блювання або погіршення стану свідомості. Такі запобіжні заходи мають особливе значення для пацієнтів віком до 3 років.
Педіатричні пацієнти
У клінічних дослідженнях лікування препаратом Брінейра починали в дітей віком від 1 до 9 років. Клінічні дані щодо застосування дітям віком до 1 року відсутні (див. розділ «Фармакодинаміка»). Дозування, що пропонується для дітей віком до 2 років, розраховане на основі маси головного мозку. Рішення щодо лікування приймають на основі співвідношення між користю та ризиками за оцінкою лікаря. Важливо розпочати лікування пацієнтів якомога раніше.
Вибір дозування для пацієнтів здійснюють залежно від віку на момент лікування й відповідно коригують (див. таблицю 4).
Таблиця 4. Доза та об’єм препарату Брінейра
|
Вікові групи |
Загальна доза, що вводиться через тиждень (мг) |
Об’єм розчину препарату Брінейра (мл) |
|
Від народження до < 6 місяців |
100 |
3,3 |
|
Від 6 місяців до < 1 року |
150 |
5 |
|
Від 1 року до < 2 років |
200 (перші 4 дози) 300 (подальші дози) |
6,7 (перші 4 дози) 10 (подальші дози) |
|
2 роки та старші |
300 |
10 |
Спосіб застосування
Інтрацеребровентрикулярне застосування.
Запобіжні заходи, яких слід вжити перед роботою з цим лікарським засобом або його введенням
Під час підготовки та введення препарату необхідно суворо дотримуватися правил асептики.
Препарат Брінейра та розчин для промивання можна вводити виключно інтрацеребровентрикулярним шляхом. Кожний флакон препарату Брінейра та розчину для промивання призначений виключно для одноразового використання.
Препарат Брінейра вводять у спинномозкову рідину (СМР) шляхом інфузії через імплантований хірургічно резервуар та катетер (пристрій для інтрацеребровентрикулярного доступу). Перед першою інфузією необхідно імплантувати пристрій для інтрацеребровентрикулярного доступу. Імплантований пристрій для інтрацеребровентрикулярного доступу повинен підходити для доступу до шлуночків головного мозку для введення лікарських засобів.
Після інфузії препарату Брінейра необхідно використати розраховану кількість розчину для промивання, щоб промити компоненти інфузійної системи, в тому числі пристрій для інтрацеребровентрикулярного доступу, з метою повного введення препарату Брінейра та підтримання прохідності пристрою для інтрацеребровентрикулярного доступу. Перед введенням слід розморозити флакони з препаратом Брінейра та розчином для промивання. Швидкість інфузії препарату Брінейра та розчину для промивання становить 2,5 мл/годину. Повний час інфузії, тобто введення препарату Брінейра й необхідної кількості розчину для промивання, становить приблизно 2−4,5 години залежно від дози та введеного об’єму.
Інтрацеребровентрикулярна інфузія препарату Брінейра
Слід вводити препарат Брінейра перед введенням розчину для промивання.
1. Позначити інфузійну систему як «Тільки для інтрацеребровентрикулярної інфузії».
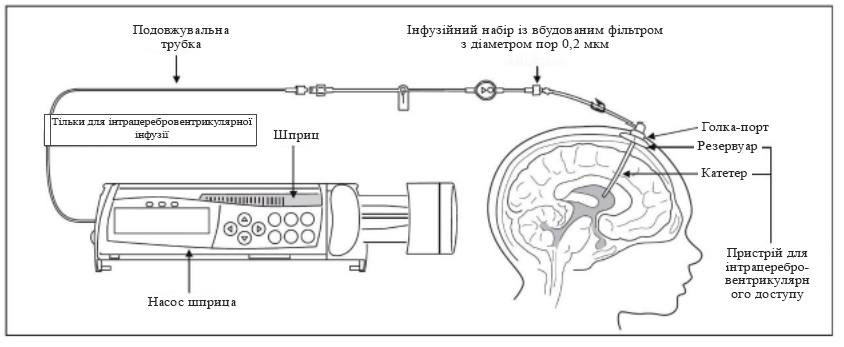
2. Під’єднати шприц із препаратом Брінейра до подовжувальної трубки, якщо вона використовується, або до інфузійної системи. Інфузійна система повинна бути обладнана вбудованим фільтром з діаметром пор 0,2 мкм (див. рисунок 2).
3. Заповнити компоненти інфузійної системи препаратом Брінейра.
4. Оглянути волосисту частину голови щодо ознак підтікання з пристрою для інтрацеребровентрикулярного доступу або несправності та щодо можливих ознак інфекції. Не вводити препарат Брінейра, якщо наявні ознаки сильного підтікання з пристрою для інтрацеребровентрикулярного доступу, несправності пристрою або симптоми пов’язаної з пристроєм інфекції (див. розділи «Протипоказання» та «Особливості застосування»).
5. Підготувати волосисту частину голови для інтрацеребровентрикулярної інфузії, дотримуючись правил асептики згідно зі стандартами надання допомоги у медичній установі.
6. Вставити голку-порт у пристрій для інтрацеребровентрикулярного доступу.
7. Під’єднати окремий порожній стерильний шприц (ємністю не більше ніж 3 мл) до голки-порту. Витягнути 0,5−1 мл СМР, щоб перевірити прохідність пристрою для інтрацеребровентрикулярного доступу.
- Не повертати СМР назад у пристрій для інтрацеребровентрикулярного доступу. Зразки СМР слід відправити в бактеріологічну лабораторію у плановому порядку з метою моніторингу інфекцій (див. розділ «Особливості застосування»).
8. Під’єднати інфузійну систему до голки-порту (див. рисунок 2).
- Зафіксувати компоненти згідно зі стандартами надання допомоги медичного закладу.
9. Помістити шприц із препаратом Брінейра в насос шприца та запрограмувати насос для введення препарату зі швидкістю інфузії 2,5 мл на годину.
- Запрограмувати сигнали насоса звучати при найменшому відхиленні від меж тиску, швидкості та об’єму. Детальну інформацію можна знайти в інструкціях з експлуатації, наданих виробником насоса.
- Не вводити препарат болюсно або вручну.
10. Розпочати інфузію препарату Брінейра зі швидкістю 2,5 мл на годину.
11. Періодично перевіряти інфузійну систему під час інфузії щодо ознак підтікання або проблеми з доставкою препарату.
12. Після завершення інфузії переконатися, що шприц «Брінейра» у насосі шприца порожній. Від’єднати та витягнути порожній шприц з насоса та від’єднати його від трубки. Утилізувати порожній шприц згідно з місцевими вимогами.
Рисунок 2. Налаштування інфузійної системи
Інтрацеребровентрикулярна інфузія розчину для промивання
Вводити наданий розчин для промивання після завершення інфузії препарату Брінейра.
1. Під’єднати шприц із розрахованим об’ємом розчину для промивання до компонентів інфузійної системи.
2. Помістити шприц із розчином для промивання в насос шприца та запрограмувати насос на введення зі швидкістю інфузії 2,5 мл на годину.
- Запрограмувати сигнали насоса звучати при найменшому відхиленні від меж тиску, швидкості та об’єму. Детальну інформацію можна знайти в інструкціях з експлуатації, наданих виробником насоса.
- Не вводити розчин болюсно або вручну.
3. Розпочати інфузію розчину для промивання зі швидкістю 2,5 мл на годину.
4. Періодично перевіряти інфузійну систему під час інфузії щодо ознак підтікання або проблеми з доставкою препарату.
5. Після завершення інфузії переконатися, що шприц «Розчин для промивання» у насосі шприца порожній. Від’єднати та витягнути порожній шприц з насоса та від’єднати його від інфузійної системи.
6. Витягнути голку-порт. Обережно притиснути та накласти пов’язку на місце інфузії згідно зі стандартами надання допомоги медичної установи.
7. Утилізувати компоненти інфузійної системи, голки, невикористані розчини та інші відходи згідно з місцевими вимогами.
Підготовка препарату Брінейра та розчину для промивання до введення
Для введення препарату Брінейра слід використовувати інфузійну систему, хімічну та фізичну сумісність якої з препаратом Брінейра та розчином для промивання доведено. Для введення препарату Брінейра слід використовувати пристрої для інтрацеребровентрикулярного доступу та витратні компоненти, перелічені нижче або еквівалентні, що мають маркування СЕ.
До пристроїв для інтрацеребровентрикулярного доступу, сумісність яких з препаратом Брінейра доведено, належать пристрої, виготовлені із силіконового корпусу з основою з нержавіючої сталі або поліпропілену, прикріпленого до силіконового катетера.
Для правильної підготовки препарату Брінейра та розчину для промивання потрібні такі компоненти, не включені в комплект поставки (див. рисунок 2). Усі компоненти інфузійної системи повинні бути стерильними. Препарат Брінейра та розчин для промивання постачаються й зберігаються в замороженому стані (див. розділ «Умови зберігання»).
- Програмований насос шприца з відповідним діапазоном доставки, точністю швидкості введення та сигналами в разі неправильного введення чи оклюзії системи. Насос повинен бути програмованим для введення лікарського засобу з постійною швидкістю 2,5 мл/год.
- Два одноразові шприци, сумісні з насосним обладнанням. Рекомендований об’єм шприца від 10 до 20 мл.
- Дві одноразові голки для шприца для підшкірного введення (21 G, 25,4 мм).
- Один одноразовий інфузійний набір. За потреби можна додати подовжувальну трубку. Рекомендована довжина від 150 до 206 см (не більш як 400 см) та внутрішній діаметр 0,1 см.
- Необхідний прохідний фільтр з діаметром пор 0,2 мкм. Прохідний фільтр може бути вмонтовано в інфузійний набір. Прохідний фільтр слід помістити якомога ближче до голки-порту.
- Голка-порт, спеціально оброблена для зниження ризику закупорювання просвіту, діаметром 22 або менше та рекомендованою довжиною 16 мм. Ознайомтеся з рекомендаціями виробника пристрою для інтрацеребровентрикулярного доступу щодо вибору голки-порту.
- Один порожній стерильний одноразовий шприц (для забору СМР з метою перевірки прохідності системи).
Розморожування препарату Брінейра та розчину для промивання
Залишити флакони препарату Брінейра та розчину для промивання розморожуватися при кімнатній температурі приблизно на 60 хвилин. Не розтоплювати й не нагрівати флакони жодним іншим способом. Не струшувати флакони. В процесі розморожування відбувається конденсація. Рекомендується для розморожування витягти флакони з картонної коробки.
Брінейра та розчин для промивання повинні повністю розтанути, після чого їх слід одразу використати.
Не заморожувати флакони повторно й не заморожувати шприци з препаратом Брінейра або розчином для промивання.
Перевірка флаконів з розмороженими препаратом Брінейра та розчином для промивання
Перевірити флакони, щоб переконатися, що препарати повністю розтанули. Препарат Брінейра повинний бути прозорим або злегка опалесціюючим і безбарвним або блідо-жовтим. Іноді флакони з препаратом Брінейра можуть містити прозорі волокна або непрозорі частки. Ці утворені природним шляхом частки є церліпоназою альфа. Частки затримуються вбудованим фільтром з діаметром пор 0,2 мкм без суттєвого впливу на чистоту чи активність препарату Брінейра.
Розчин для промивання може містити частки, що розчиняються після повного розморожування флакона. Розчин для промивання повинен бути прозорим та безбарвним.
Не використовувати препарати, якщо колір розчинів змінився або якщо в розчинах присутні сторонні тверді частки.
Набір препарату Брінейра
Позначити один невикористаний стерильний шприц «Брінейра» й під’єднати голку. Зняти зелений знімний ковпачок з обох флаконів препарату Брінейра. Дотримуючись правил асептики, набрати розчин препарату Брінейра в об’ємі, що відповідає потрібній дозі (див. таблицю 4) у стерильний шприц з позначкою «Брінейра». Не розводити препарат Брінейра. Не змішувати препарат Брінейра з будь-якими іншими лікарськими засобами. Утилізувати голку та порожні флакони згідно з місцевими вимогами.
Набір розчину для промивання
Визначити об’єм розчину для промивання, необхідний для забезпечення повного потрапляння препарату Брінейра в шлуночки головного мозку. Розрахувати об’єм розчину для промивання, додаючи об’єм заповнення усіх компонентів інфузійної системи, в тому числі пристрою для інтрацеребровентрикулярного доступу.
Позначити один невикористаний стерильний шприц «Розчин для промивання» й під’єднати голку. Зняти жовтий знімний ковпачок з флакона з розчином для промивання. Дотримуючись правил асептики, набрати потрібну кількість розчину для промивання з флакона в новий стерильний шприц «Розчин для промивання». Утилізувати голку та флакон з рештою розчину згідно з місцевими вимогами.
Утилізація
Будь-який невикористаний лікарський засіб або його відходи слід утилізувати відповідно до місцевих вимог.
Діти.
У клінічних дослідженнях лікування лікарським засобом Брінейра починали в дітей віком від 1 до 9 років. Клінічні дані щодо застосування дітям віком до 1 року відсутні (див. розділ «Фармакокінетика»). Дозування, що пропонується для дітей віком до 2 років, розраховане на основі маси головного мозку. Рішення щодо лікування слід приймати на основі співвідношення користь-ризики для окремого пацієнта за оцінкою лікаря. Важливо розпочати лікування пацієнтів якомога раніше.
Передозування.
Інформація відсутня.
Побічні реакції.
Стислий огляд профілю безпеки
Небажані реакції, описані в цьому розділі, оцінювались у 38 пацієнтів із CLN2, які отримали принаймні одну дозу препарату Брінейра в клінічних дослідженнях тривалістю до 309 тижнів або протягом постреєстраційного застосування. Найбільш частими (> 20 %) небажаними реакціями, що спостерігалися на фоні лікування препаратом Брінейра в клінічних дослідженнях, були гіпертермія, судоми, низький вміст білка у СМР, відхилення від норми на ЕКГ, блювання, проблеми, пов’язані з голкою, інфекції, пов’язані з пристроєм, та гіперчутливість. Жоден пацієнт не потребував припинення лікування препаратом через небажані явища.
Табличний перелік побічних реакцій
Побічні реакції представлено за категоріями система-орган-клас та частотою згідно з критеріями частоти Медичного словника нормативно-правової діяльності (MedDRA): дуже часто (≥ 1/10); часто (≥ 1/100 і < 1/10); нечасто (≥ 1/1000 і < 1/100); рідко (≥ 1/10 000 і < 1/1000); дуже рідко (< 1/10 000), частота невідома (неможливо встановити на основі наявних даних).
Таблиця 5. Частота побічних реакцій, що спостерігаються на фоні лікування препаратом Брінейра
|
Система-орган-клас |
Побічні реакції (термін переважного використання за MedDRA) |
Частота |
|
Інфекції та інвазії |
Інфекція, пов’язана з пристроєма Менінгіт |
Дуже часто Невідомо |
|
Розлади з боку імунної системи |
Гіперчутливість Анафілактична реакція |
Дуже часто Часто |
|
Розлади з боку психіки |
Дратівливість |
Дуже часто |
|
Розлади з боку нервової системи |
Явища судомb Головний біль Плеоцитоз у СМР |
Дуже часто Дуже часто Дуже часто |
|
Розлади з боку серця |
Брадикардія |
Часто |
|
Розлади з боку травної системи |
Блювання Шлунково-кишковий розлад |
Дуже часто Часто |
|
Розлади з боку шкіри та підшкірної клітковини |
Висип Кропив’янка |
Часто Часто |
|
Загальні розлади та реакції у місці введення препарату |
Гіпертерміяс Відчуття неспокою Подразнення в місці встановлення медичного пристрою |
Дуже часто Часто Часто |
|
Розлади, виявлені за результатами обстеження |
Підвищення рівня білка у СМР Відхилення від норми на ЕКГ Зниження рівня білка у СМР |
Дуже часто Дуже часто Дуже часто |
|
Проблеми з медичною продукцією |
Проблема з пристроєм: проблеми з голкоюd підтікання пристрою несправність пристрою оклюзія пристроюе пошкодження пристрою зміщення пристроюf |
Дуже часто Дуже часто Дуже часто Часто Часто Невідомо |
a Акне, спричинене пропіонобактеріями або епідермальним стафілококом.
b Атонічні судоми, клонічні судоми, раптова втрата свідомості, епілепсія, генералізовані тоніко-клонічні судоми, міоклонічна епілепсія, парціальні напади, малий епілептичний напад, судомний напад, кластерні судоми та епілептичний статус.
c Гіпертермія, що об’єднує терміни переважного використання "Гіпертермія" та "Підвищення температури тіла".
d Зміщення інфузійної голки.
e Закупорка катетера.
f Зміщення пристрою в клінічних дослідженнях не спостерігалося.
Опис окремих небажаних реакцій
Судоми
Судоми є частим проявом захворювання на CLN2 й очікувано спостерігаються в таких пацієнтів. У клінічних дослідженнях у 31 з 38 (82 %) пацієнтів, які приймали церліпоназу альфа, розвинулося явище, що відповідає критеріям судом стандартизованого запиту MedDRA. Найбільш частими явищами судом були судомний напад, епілепсія та генералізовані тоніко-клонічні судоми. Усього 4 % усіх випадків судом розглядалися як пов’язані з церліпоназою альфа; їх тяжкість коливалася від легких до тяжких (1−4 ступеня згідно з Загальними термінологічними критеріями для небажаних явищ (СТСАЕ)). Судоми вдавалося усунути за допомогою стандартних протисудомних лікарських засобів, і вони не призвели до необхідності припинення лікування препаратом Брінейра.
Гіперчутливість
Реакції гіперчутливості спостерігалися в 19 із 38 пацієнтів (50 %), які отримували лікування препаратом Брінейра. Тяжкі (3 ступеня згідно з Загальними термінологічними критеріями для небажаних явищ (СТСАЕ)) реакції гіперчутливості розвинулися в 6 пацієнтів; жоден з пацієнтів не припинив лікування препаратом. Реакції гіперчутливості були зареєстровані у 5 з 8 (63 %) пацієнтів віком < 3 років порівняно з 14 з 30 (47 %) пацієнтів віком ≥ 3 років. Найбільш частими проявами були гіпертермія з блюванням, плеоцитоз або дратівливість, що не є характерними для класичної імунної реакції гіперчутливості. Ці побічні реакції спостерігалися під час або протягом 24 годин після закінчення інфузії препарату Брінейра і не впливали на лікування. Симптоми минали з часом або після введення жарознижувальних, антигістамінних засобів та/або глюкокортикостероїдів.
Повідомлення про підозрювані побічні реакції
Повідомлення про підозрювані побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності.
2 роки.
Умови зберігання.
Зберігати у вертикальному положенні в морозильнику (від -25 °C до -15 °C).
Транспортувати та видавати в замороженому стані (від -85 °C до -15 °C).
Зберігати в оригінальній упаковці, щоб захистити від дії світла.
Зберігати у недоступному для дітей місці.
Несумісність.
Оскільки дослідження сумісності не проводилися, цей лікарський засіб не можна змішувати з іншими лікарськими засобами.
Упаковка.
5 мл розчину для інфузій у прозорому скляному флаконі (скло I типу), закупореному пробкою (бутилкаучук) з фторполімерним покриттям та обтиснутому алюмінієвою кришкою типу flip-off seal з пластиковим ковпачком зеленого кольору.
5 мл розчину для промивання у прозорому скляному флаконі (скло I типу), закупореному пробкою (бутилкаучук) з фторполімерним покриттям та обтиснутому алюмінієвою кришкою типу flip-off seal з пластиковим ковпачком жовтого кольору.
По 2 флакони з розчином для інфузій у комплекті з 1 флаконом з розчином для промивання в картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
БіоМарин Інтернешнл Лімітед.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Шанбаллі, Рінгаскідді, Ко. Корк, Ірландія.
