КСЕНПОМА
-
Індія Д-р Редді'с Лабораторіс ЛтдDosage form: капсули тверді по 1 мг, по 21 капсулі у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 100 капсул у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 7 капсул у блістері, по 3 блістери у картонній коробці; по 10 капсул у блістері, по 10 блістерів у картонній коробціComposition: 1 капсула тверда містить помалідоміду 1 мгMedicinal dispensing terms: за рецептомСertificate number: UA/20661/01/01ATS code: L04AX06Expiry: 3 роки
-
Індія Д-р Редді'с Лабораторіс ЛтдDosage form: капсули тверді по 2 мг, по 21 капсулі у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 100 капсул у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 7 капсул у блістері, по 3 блістери у картонній коробці; по 10 капсул у блістері, по 10 блістерів у картонній коробціComposition: 1 капсула тверда містить помалідоміду 2 мгMedicinal dispensing terms: за рецептомСertificate number: UA/20661/01/02ATS code: L04AX06Expiry: 3 роки
-
Індія Д-р Редді'с Лабораторіс ЛтдDosage form: капсули тверді по 3 мг, по 21 капсулі у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 100 капсул у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 7 капсул у блістері, по 3 блістери у картонній коробці; по 10 капсул у блістері, по 10 блістерів у картонній коробціComposition: 1 капсула тверда містить помалідоміду 3 мгMedicinal dispensing terms: за рецептомСertificate number: UA/20661/01/03ATS code: L04AX06Expiry: 3 роки
-
Індія Д-р Редді'с Лабораторіс ЛтдDosage form: капсули тверді по 4 мг по 21 капсулі у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 100 капсул у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 7 капсул у блістері, по 3 блістери у картонній коробці; по 10 капсул у блістері, по 10 блістерів у картонній коробціComposition: 1 капсула тверда містить помалідоміду 4 мгMedicinal dispensing terms: за рецептомСertificate number: UA/20661/01/04ATS code: L04AX06Expiry: 3 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
КСЕНПОМА
(XENPOMA)
Склад:
діюча речовина: помалідомід;
1 капсула тверда містить помалідоміду 1 мг, 2 мг, 3 мг або 4 мг;
допоміжні речовини:
капсули тверді по 1 мг: лактоза безводна, крохмаль прежелатинізований, натрію стеарилфумарат, капсула тверда желатинова №4 (склад оболонки капсули: желатин, вода очищена, титану діоксид (E 171), барвник FD&C Blue 1 (Е 133), еритрозин (Е 127), барвник D&C Red 33);
капсули тверді по 2 мг: лактоза безводна, крохмаль прежелатинізований, натрію стеарилфумарат, капсула тверда желатинова №2 (склад оболонки капсули: желатин, вода очищена, титану діоксид (E 171), барвник FD&C Blue 1 (Е 133), еритрозин (Е 127), барвник D&C Red 33, барвник D&C Yellow 10);
капсули тверді по 3 мг: лактоза безводна, крохмаль прежелатинізований, натрію стеарилфумарат, капсула тверда желатинова №2 (склад оболонки капсули: желатин, вода очищена, титану діоксид (E 171), барвник FD&C Blue 1 (Е 133), еритрозин (Е 127), барвник D&C Red 33, барвник FD&C Red 40 (Е 129));
капсули тверді по 4 мг: лактоза безводна, крохмаль прежелатинізований, натрію стеарилфумарат, капсула тверда желатинова №2 (склад оболонки капсули: желатин, вода очищена, титану діоксид (E 171), барвник FD&C Blue 1 (Е 133), еритрозин (Е 127), барвник D&C Red 33, барвник D&C Red 28).
Лікарська форма. Капсули тверді.
Основні фізико-хімічні властивості:
капсули тверді по 1 мг: тверді желатинові капсули, що складаються з кришки пурпурового кольору з написом білим чорнилом «
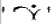 »
та «1 mg», та корпусу темно-рожевого
кольору
з написом
білим
чорнилом «520»,
заповнені
порошком від
світло-жовтого
до жовтого
кольору;
»
та «1 mg», та корпусу темно-рожевого
кольору
з написом
білим
чорнилом «520»,
заповнені
порошком від
світло-жовтого
до жовтого
кольору;
капсули тверді по 2 мг: тверді желатинові капсули, що складаються з кришки пурпурового кольору з написом білим чорнилом «
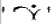 »
та «2 mg», та
непрозорого корпусу
рожевого кольору
з написом
білим
чорнилом «519»,
заповнені
порошком від
світло-жовтого
до жовтого
кольору;
»
та «2 mg», та
непрозорого корпусу
рожевого кольору
з написом
білим
чорнилом «519»,
заповнені
порошком від
світло-жовтого
до жовтого
кольору;
капсули тверді по 3 мг: тверді желатинові капсули, що складаються з кришки пурпурового кольору з написом білим чорнилом «
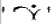 »
та «3 mg», та непрозорого
корпусу
фіолетового
кольору
з написом
білим
чорнилом «518»,
заповнені
порошком від
світло-жовтого
до жовтого
кольору;
»
та «3 mg», та непрозорого
корпусу
фіолетового
кольору
з написом
білим
чорнилом «518»,
заповнені
порошком від
світло-жовтого
до жовтого
кольору;
капсули тверді по 4 мг: тверді желатинові капсули, що складаються з кришки пурпурового кольору з написом білим чорнилом «
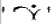 »
та «4 mg», та
непрозорого корпусу
пурпурового
кольору
з написом
білим
чорнилом «517»,
заповнені
порошком від
світло-жовтого
до жовтого
кольору.
»
та «4 mg», та
непрозорого корпусу
пурпурового
кольору
з написом
білим
чорнилом «517»,
заповнені
порошком від
світло-жовтого
до жовтого
кольору.
Фармакотерапевтична група.
Імуносупресанти. Інші імуносупресанти.
Код ATХ L04A X06.
Фармакологічні властивості.
Фармакодинаміка.
Помалідомід чинить пряму протимієломно-протипухлинну, анти-ангіогенну та імуномодулюючу дію і пригнічує живлення стромальних клітин, які допомагають зростанню клітинам множинної мієломи. Зокрема помалідомід пригнічує проліферацію та індукує апоптоз пухлинних клітин гематопоетичних клітин. Крім того, помалідомід інгібує проліферацію клітин множинної мієломи, резистентних до леналідоміду, у тому числі синергічно з дексаметазоном як чутливих до леналідоміду, так і стійких до леналідоміду клітин, та індукує апоптоз пухлинних клітин. Помалідомід посилює клітинний імунітет, опосередкований Т-клітинами та природними кілерами (ПК), та інгібує вироблення протизапальних цитокінів (наприклад, TNF-a та IL-6) моноцитами. Помалідомід також інгібує ангіогенез, блокуючи міграцію та адгезію клітин ендотелію.
Помалідомід зв'язується безпосередньо з білком цереблона (CRBN), який є частиною комплексу E3-лігази, та включає в себе білок зв'язування пошкоджень дезоксирибонуклеїнової кислоти (ДНК) (DDB1), Куллін 4 (CUL4) та регулятор Куллін-1 (Roc1), і може пригнічувати аутоубіквітинування CRBN у комплексі. E3-лігази убіквітину відповідають за поліубіквітинування різних субстратних білків і можуть частково пояснити плейотропні клітинні ефекти, що спостерігаються при лікуванні помалідомідом. При наявності помалідоміду in vitro субстратні білки Aiolos та Ikaros впливають на убіквітинування та подальшу деградацію, що призводить до прямого цитотоксичного та імуномодулюючого ефекту. In vivo терапія помалідомідом призвела до зниження рівня Aiolos у пацієнтів з рецидивуючою множинною мієломою, резистентною до леналідоміду.
Фармакокінетика.
Всмоктування
Помалідомід абсорбується з максимальною концентрацією у плазмі крові (Cmax), що виникає між 2 та 3 годинами, принаймні 73 % лікарського засобу абсорбується після прийому разової пероральної дози. Площа під фармакокінетичною кривою «концентрація-час» (AUC) помалідоміду збільшується приблизно лінійно та пропорційно дозі. Після застосування декількох доз помалідомід має коефіцієнт накопичення від 27 до 31 % на AUC.
Одночасне застосування лікарського засобу з їжею з високим вмістом жирів та калорій уповільнює швидкість всмоктування, зменшуючи середній рівень Cmax у плазмі крові приблизно на 27 %, але має мінімальний вплив на загальний ступінь всмоктування при 8 % зниженні середнього системного впливу. Тому помалідомід можна застосовувати незалежно від вживання їжі.
Розподіл
Помалідомід має середній теоретичний об’єм розподілу (Vd/F) між 62 і 138 л у рівноважному стані. Помалідомід розподіляється у сім’яній рідині здорових добровольців у концентрації приблизно 67 % від рівня плазми крові через 4 години після застосування дози (приблизне значення Tmax) через 4 дні прийому дози 2 мг один раз на добу. Зв’язування енантіомерів помалідоміду іn vitro з білками у плазмі крові людини становить від 12 % до 44 % і не залежить від концентрації.
Метаболізм
Помалідомід є основним циркулюючим компонентом (приблизно 70 % радіоактивності плазми) in vivo у здорових добровольців, які отримали разову пероральну дозу [14С]-помалідоміду (2 мг). Жодних метаболітів у плазмі крові з концентрацією >10 % відносно початкової або загальної радіоактивності виявлено не було.
Переважними метаболічними шляхами виділеної радіоактивності є гідроксилювання з подальшою глюкуронідацією або гідролізом. In vitro CYP1A2 і CYP3A4 були визначені основними ферментами CYP-опосередкованого гідроксилювання помалідоміду, додатковою незначною участю ферментів CYP2C19 та CYP2D6. Помалідомід також є субстратом P-глікопротеїну (P-gp) in vitro. Одночасне застосування помалідоміду із сильним інгібітором CYP3A4/5 і P-gp кетоконазолом або сильним індуктором CYP3A4/5 карбамазепіном не мало клінічно значущого впливу на ефекти помалідоміду. Одночасне застосування сильного інгібітора CYP1A2 фувоксаміну з помалідомідом при наявності кетоконазолу підвищувало середню експозицію помалідоміду на 107 % з 90 % ДІ [від 91 % до 124 %] порівняно з терапією помалідомідом і кетоконазолом. У другому дослідженні з метою оцінки впливу інгібітора CYP1A2 на зміни метаболізму одночасне застосовування фувоксаміну та помалідоміду збільшувало середню концентрацію помалідоміду в крові на 125 % з 90 % ДІ [від 98 % до 157 %], порівняно із застосуванням лише помалідоміду. У разі необхідності одночасного застосування сильних інгібіторів CYP1A2 (наприклад, ципрофлоксацину, еноксацину або флувоксаміну) разом із помалідомідом слід зменшити дозу помалідоміду на 50 %. Застосування помалідоміду у курців (відомий індукуючий ефект тютюнопаління на ізоформу CYP1A2) не мало клінічно значущого впливу на концентрацію помалідоміду порівняно з концентрацією помалідоміду у некурців.
На підставі даних in vitro помалідомід не є інгібітором або індуктором ізоферментів цитохрому Р450 і не пригнічує жодних відомих транспортерів лікарських засобів. Клінічно значущих взаємодій помалідоміду з іншими лікарськими засобами у разі його одночасного застосування із субстратами цих шляхів не очікується.
Виведення
Середній період напіввиведення помалідоміду становить приблизно 9,5 години у здорових пацієнтів та приблизно 7,5 години у пацієнтів із множинною мієломою. Середній загальний кліренс помалідоміду (CL/F) становить приблизно 7-10 л/годину.
Після одноразового перорального застосування [14C]-помалідоміду (2 мг) здоровими добровольцями приблизно 73 % та 15 % радіоактивної дози виводилося із сечею та фекаліями відповідно, при цьому приблизно 2 % та 8 % дозованого радіовуглецю виводилося у вигляді помалідоміду із сечею та фекаліями.
Помалідомід інтенсивно метаболізується перед виведенням з організму, при цьому метаболіти виводяться головним чином із сечею. Три основні метаболіти, що виявляються у сечі (утворені шляхом гідролізу або гідроксилювання з подальшим глюкуруванням), становлять приблизно 23 %, 17 % та 12 % відповідно, від дози в сечі.
На метаболіти, що залежать від CYP, припадає приблизно 43 % від загальної радіоактивності, що виділяється, тоді як незалежні від CYP гідролізовані метаболіти становлять 25 %, а екскреція незміненого помалідоміду становить 10 % (2 % із сечею та 8 % із фекаліями).
Популяційна фармакокінетика (ФК)
За результатами популяційного ФК аналізу з використанням моделі з двома відділеннями, здорові суб'єкти та пацієнти з множинною мієломою мали порівнянний видимий кліренс (CL/F) та теоретичний центральний об'єм розподілу (V2/F). У периферичних тканинах помалідомід переважно поглинався пухлинами з очевидним периферичним кліренсом розподілу (Q/F) та видимим периферичним об'ємом розподілу (V3/F) відповідно у 3,7 та 8 разів вище, ніж у здорових добровольців.
Педіатрична популяція
Після прийому одноразової пероральної дози помалідоміду у дітей та молодих людей з рецидивуючою або прогресуючою первинною пухлиною головного мозку медіана Tmax становила 2‑4 години після прийому дози і відповідала середнім геометричним значенням Cmax (CV %) 74,8 (59,4 %), 79,2 (51,7 %) та 104 (18,3 %) нг/мл при дозах 1,9, 2,6 та 3,4 мг/м2 відповідно. AUC0-24 та AUC0-inf слідували подібним тенденціям, загальна експозиція становила приблизно від 700 год • нг/мл до 800 год • нг/мл після введення нижчих двох доз та приблизно 1200 год • нг/мл – високої дози. Оціночний період напіввиведення становив приблизно від 5 до 7 годин.
Не було виявлено чітких тенденцій при стратифікації за віком та вживанням стероїдів при мінімальній топологічній різниці (MTD).
Загалом дані свідчать про те, що показник AUC збільшувався майже пропорційно збільшенню дози помалідоміду, тоді як збільшення Cmax, як правило, було менш пропорційним.
Фармакокінетика помалідоміду після перорального прийому у дозах від 1,9 мг/м2/добу до 3,4 мг/м2/добу була визначена у 70 пацієнтів у віці від 4 до 20 років у комплексному аналізі дослідження фази 1 та фази 2 при повторних або прогресуючих дитячих пухлинах головного мозку. Профілі «концентрація-час» помалідоміду були адекватно описані за допомогою однокамерної ФК-моделі з абсорбцією та елімінацією першого порядку. Помалідомід демонстрував лінійну та інваріантну у часі фармакокінетичну модель з помірною варіабельністю. Типові значення CL/F, Vc/F, Ka, час затримки помалідоміду становили 3,94 л/год, 43,0 л, 1,45 год-1 та 0,454 години відповідно. Кінцевий період напіввиведення помалідоміду становив 7,33 години. За винятком площі поверхні тіла (ППТ), жоден із випробуваних коваріатів, включаючи вік та стать, не впливав на фармакокінетику помалідоміду. Хоча ППТ було визначено як статистично значущу коваріату помалідоміду CL/F та Vc/F, вплив ППТ на показники експозиції не вважався клінічно значущим.
Загалом не було виявлено суттєвої різниці у фармакокінетичних показниках помалідоміду між дітьми та дорослими.
Пацієнти літнього віку.
На основі популяційного фармакокінетичного аналізу у здорових добровольців та пацієнтів з множинною мієломою не було виявлено значного впливу віку (в діапазоні 19‑83 років) на кліренс помалідоміду після його перорального прийому. У клінічних дослідженнях не потрібно було коригувати дозу у пацієнтів літнього віку (> 65 років), які застосовували помалідомід.
Ниркова недостатність
Популяційний фармакокінетичний аналіз показав, що фармакокінетичні параметри помалідоміду суттєво не змінювалися у пацієнтів із порушеннями функції нирок (що визначалося за кліренсом креатиніну або розрахунковою швидкістю клубочкової фільтрації [ШКФ]), порівняно з пацієнтами з нормальною функцією нирок (CrCl ≥60 мл/хвилину). Середня нормалізована експозиція (показник AUC) помалідоміду становила 98,2 % із 90 % довірчим інтервалом [77,4 % до 120,6 %] у пацієнтів з помірною нирковою недостатністю (ШКФ ≥30 до ≤45 мл/хв/1,73 м2), порівняно з пацієнтами з нормальною функцією нирок. Середня нормалізована експозиція (показник AUC) помалідоміду становила 100,2 % із 90 % довірчим інтервалом [79,7 % до 127,0 %] у пацієнтів із тяжкими порушеннями функції нирок, які не потребують діалізу (CrCl <30 або ШКФ <30 мл/хв/1,73 м2), порівняно з пацієнтами з нормальною функцією нирок. Середня нормалізована експозиція (показник AUC) помалідоміду зросла на 35,8 % із 90 % ДІ [7,5 % до 70,0 %] у пацієнтів із тяжкими порушеннями функції нирок, які потребують діалізу (CrCl <30 мл/хв з необхідністю діалізу), порівняно з пацієнтами з нормальною функцією нирок. Середні зміни в експозиції помалідоміду в кожній із цих груп ниркової недостатності не є настільки значними, щоб це потребувало корекції дози лікарського засобу.
Порушення функції печінки
Фармакокінетичні параметри помірно змінювались у пацієнтів з порушеннями функції печінки (визначені за критеріями Чайлда-П'ю) порівняно зі здоровими добровольцями. Середня експозиція помалідоміду збільшувалася на 51 % із 90 % довірчим інтервалом [від 9 % до 110 %] у пацієнтів із легкою печінковою недостатністю порівняно зі здоровими добровольцями. Середня експозиція помалідоміду збільшувалася на 58 % із 90 % довірчим інтервалом [13 % до 119 %] у пацієнтів з помірною печінковою недостатністю порівняно зі здоровими добровольцями. Середня експозиція помалідоміду збільшувалася на 72 % із 90 % довірчим інтервалом [від 24 % до 138 %] у пацієнтів з тяжкими порушеннями функції печінки порівняно зі здоровими добровольцями. Середнє збільшення експозиції помалідоміду у кожній із цих груп не було настільки значним, щоб потребувати корекції схеми застосування або дози лікарського засобу.
Клінічні характеристики.
Показання.
Ксенпома у комбінації з бортезомібом та дексаметазоном показана для лікування дорослих пацієнтів із множинною мієломою, які раніше отримали не менше ніж один курс лікування, що включав леналідомід.
Ксенпома у комбінації з дексаметазоном показана для лікування дорослих пацієнтів із рецидивуючою або рефрактерною множинною мієломою, які раніше отримали не менше двох курсів лікування, що включали леналідомід і бортезоміб та у яких відзначалося прогресування захворювання на тлі останньої терапії.
Протипоказання.
• Вагітність.
• Жінкам репродуктивного віку, якщо не виконані всі необхідні умови запобігання вагітності.
• Пацієнтам чоловічої статі, які не в змозі дотримуватися необхідних контрацептивних заходів.
• Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин лікарського засобу.
Особливі заходи безпеки.
Капсули не слід відкривати або подрібнювати. Якщо порошок помалідоміду контактував зі шкірою або слизовими оболонками, їх слід негайно ретельно промити водою з милом. Медичні працівники та обслуговуючий персонал повинні носити одноразові рукавички під час роботи з блістером або капсулою. Після завершення робіт з помалідомідом слід обережно зняти рукавички, щоб запобігти потраплянню на шкіру, помістити їх у герметичний пластиковий поліетиленовий пакет та утилізувати відповідно до місцевих вимог. Потім слід ретельно вимити руки водою з милом.
Вагітні жінки або жінки, які мають підозру на вагітність, не повинні працювати з блістером або капсулою помалідоміду (див. розділ «Особливості застосування»).
Будь-який невикористаний лікарський засіб або відходи слід утилізувати відповідно до місцевих вимог.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Вплив помалідоміду на інші лікарські засоби
Передбачається, що помалідомід не спричинить клінічно значущих фармакокінетичних взаємодій між лікарськими засобами шляхом інгібування або індукції цитохрому Р450 або інгібування транспортера при одночасному застосуванні із субстратами цих ферментів або транспортерами. Потенціал між такими лікарськими взаємодіями, включаючи потенційний вплив помалідоміду на фармакокінетику комбінованих оральних контрацептивів, клінічно не оцінювали.
Вплив інших лікарських засобів на помалідомід
Помалідомід частково метаболізується CYP1A2 та CYP3A4/5. Помалідомід також є субстратом P-глікопротеїну (P-gp). Одночасне застосування помалідоміду із сильним інгібітором CYP3A4/5 і P-gp кетоконазолом або сильним індуктором CYP3A4/5 карбамазепіном не мало клінічно значущого впливу на ефекти помалідоміду. Одночасне застосування сильного інгібітора CYP1A2 фувоксаміну з помалідомідом при наявності кетоконазолу підвищувало середню експозицію помалідоміду на 107 % з 90 % ДІ [від 91 % до 124 %] порівняно з терапією помалідомідом і кетоконазолом. У другому дослідженні з метою оцінки впливу інгібітора CYP1A2 на зміни метаболізму одночасне застосовування фувоксаміну та помалідоміду підвищувало середню концентрацію помалідоміду в крові на 125 % з 90 % ДІ [від 98 % до 157 %], порівняно із застосуванням лише помалідоміду. У разі необхідності одночасного застосування сильних інгібіторів CYP1A2 (наприклад, ципрофлоксацин, еноксацин і флувоксамін) разом із помалідомідом слід зменшити дозу помалідоміду на 50 %.
Дексаметазон
Одночасне багаторазове введення доз помалідоміду до 4 мг разом із дексаметазоном від 20 до 40 мг (який вважається слабким або помірним індуктором декількох ферментів CYP, у тому числі CYP3A) пацієнтам із множинною мієломою не впливало на фармакокінетику помалідоміду порівняно із введенням лише помалідоміду.
Вплив дексаметазону на концентрацію варфарину невідомий. Під час лікування рекомендується стежити за концентрацією варфарину в крові.
Інформацію про взаємодію інших лікарських засобів, які застосовують у комбінації з Ксенпомою, слід шукати у відповідних інструкціях з медичного застосування.
Особливості застосування.
Тератогенність
Помалідомід не слід приймати у період вагітності, оскільки він виявляє тератогенний ефект. Помалідомід структурно пов’язаний із талідомідом. Талідомід – лікарський засіб із відомим тератогенним для людини впливом, який спричиняє тяжкі вроджені вади. Було встановлено, що помалідомід є тератогенним при застосуванні у період основного органогенезу як для щурів, так і для кроликів.
Умови профілактики вагітності повинні бути виконані для всіх пацієнтів, якщо немає надійних доказів того, що пацієнт не має репродуктивного потенціалу.
Критерії для жінок, які не мають репродуктивного потенціалу
Жінки або партнери чоловічої статі вважаються такими, що не мають репродуктивного потенціалу, якщо вони відповідають принаймні одному з нижчезазначених критеріїв:
• Вік ≥ 50 років та природна аменорея протягом ≥1 року (аменорея після терапії раку або під час грудного годування не виключає репродуктивний вік).
• Передчасне згасання функції яєчників, підтверджене фахівцем-гінекологом.
• Попередня двобічна сальпінгооваріектомія або гістероектомія.
• Генотип XY, синдром Тернера, агенезія матки.
Консультування
Жінкам, які мають репродуктивний потенціал, застосування помалідоміду протипоказано, якщо не виконано всі наступні умови:
· Жінка усвідомлює очікуваний тератогенний ризик для ненародженої дитини.
· Жінка усвідомлює необхідність ефективної контрацепції щонайменше за 4 тижні до початку лікування, протягом усієї тривалості лікування та принаймні протягом 4-х тижнів після закінчення терапії.
· Навіть якщо у жінки репродуктивного віку є аменорея, необхідно дотримуватися всіх порад щодо ефективної контрацепції.
· Жінка повинна бути здатною застосовувати ефективні засоби контрацепції.
· Жінка проінформована та усвідомлює можливі наслідки вагітності та необхідність швидкої консультації у разі ризику вагітності.
· Жінка усвідомлює необхідність розпочати лікування якнайшвидше після негативного тесту на вагітність та після отримання лікарського засобу за рецептом.
· Жінка усвідомлює необхідність та погоджується проходити тестування на вагітність принаймні кожні 4 тижні, за винятком випадків, коли є підтвердження стерилізації шляхом оклюзії фалопієвих труб.
· Жінка визнає, що вона усвідомлює небезпеку та необхідність запобіжних заходів, пов’язаних із застосуванням помалідоміду.
Лікар, який призначає лікування, повинен забезпечити дотримання жінками репродуктивного віку таких умов:
· Пацієнтка відповідає умовам профілактики вагітності, включаючи підтвердження того, що вона має достатнє усвідомлення необхідності даних дій.
· Пацієнтка підтверджує згоду дотримуватися зазначених вище умов.
Для пацієнтів чоловічої статі, які приймають помалідомід, фармакокінетичні дані показали, що лікарський засіб потрапляє у сім’яну рідину під час лікування. Як запобіжний захід, а також враховуючи особливі групи населення з потенційно тривалим періодом виведення лікарського засобу через порушення функції печінки, всі пацієнти чоловічої статі, які приймають помалідомід, повинні виконувати такі умови:
· Чоловік усвідомлює очікуваний тератогенний ризик від статевої активності для вагітної жінки або жінки репродуктивного потенціалу.
· Чоловік усвідомлює необхідність використання презерватива у разі статевої активності з вагітною жінкою або жінкою репродуктивного віку, яка не використовує ефективну контрацепцію, протягом періоду лікування, під час тимчасового припинення лікування та протягом 7 днів після тимчасового припинення лікування та/або остаточного припинення лікування лікарським засобом. Це стосується також і чоловіків з вазектомією, які повинні використовувати презерватив, якщо вони вступають у статевий контакт із вагітною жінкою або жінкою, яка має репродуктивний потенціал, оскільки сім’яна рідина все ще може містити помалідомід у разі відсутності сперматозоїдів.
· Він усвідомлює, якщо його партнерка завагітніє в той час, коли він приймає помалідомід або через 7 днів після того, як він перестав приймати помалідомід, потрібно негайно повідомити про це свого лікуючого лікаря, також рекомендується направити партнерку до спеціалізованого лікаря або спеціаліста, досвідченого в тератології, для надання оцінки та рекомендацій.
Контрацепція
Жінки з репродуктивним потенціалом повинні застосовувати принаймні один ефективний метод контрацепції протягом щонайменше 4-х тижнів до терапії, під час терапії та принаймні протягом 4-х тижнів після терапії помалідомідом, і навіть у разі тимчасового припинення терапії лікарським засобом, за винятком випадків, коли пацієнтка практикує абсолютне і безперервне утримання від статевих стосунків, що підтверджується щомісячно. Якщо ефективна контрацепція не використовується, пацієнтку необхідно направити до відповідного кваліфікованого медичного працівника для отримання консультацій щодо протизаплідних засобів, для того щоб розпочати контрацепцію. Нижче наводяться варіанти, які можуть розглядатися як ефективні методи контрацепції:
· Імплантат.
· Внутрішньоматкова система, що вивільняє левоноргестрел.
· Депо медроксипрогестерону ацетату.
· Стерилізація шляхом оклюзії маткових труб.
· Статевий акт лише з партнером, якому провели вазектомію; вазектомія повинна бути підтверджена двома негативними аналізами сім’яної рідини.
· Таблетки, що інгібують овуляцію, з прогестероном (тобто дезогестрел).
Через підвищений ризик венозної тромбоемболії у пацієнток із множинною мієломою, які приймають помалідомід та дексаметазон, застосування пероральних комбінованих таблеток для контрацепції не рекомендоване. Якщо пацієнтка застосовує комбіновану оральну контрацепцію, їй необхідно перейти до одного з перелічених вище ефективних методів контрацепції. Ризик венозної тромбоемболії зберігається протягом 4‑6 тижнів після припинення застосування комбінованих оральних контрацептивів. Ефективність контрацептивних стероїдів може бути знижена під час прийому препарату разом із дексаметазоном.
Імплантати та внутрішньоматкові системи, що вивільняють левоноргестрел, підвищують ризик інфікування під час введення та під час нерегулярної вагінальної кровотечі. Для пацієнтів з нейтропенією слід враховувати профілактичне застосування антибіотиків. Введення внутрішньоматкових систем, що вивільняють мідь, не рекомендоване через потенційні ризики інфікування під час введення та втрати крові протягом менструації, що може поставити під загрозу пацієнтів із сильною нейтропенією або вираженою тромбоцитопенією.
Діагностика вагітності
Жінкам із репродуктивним потенціалом, як зазначено вище, необхідно проводити медичні контрольовані тести на вагітність з мінімальною чутливістю 25 мМО/мл згідно з місцевою практикою та під контролем лікаря. Ця вимога стосується в тому числі і жінок з репродуктивним потенціалом, які практикують абсолютне і безперервне утримання від статевих стосунків. В ідеалі діагностика вагітності, видача рецепта та відпуск лікарського засобу повинні проводитися в один і той же день. Видача помалідоміду жінкам репродуктивного віку має відбутися протягом 7 днів після призначення даного лікарського засобу.
До початку лікування
Тест на вагітність під наглядом лікаря повинен проводитися під час консультації, коли необхідно призначати помалідомід, або за 3 дні до візиту до лікаря, який призначає препарат, після того, як пацієнтка використовувала ефективні протизаплідні засоби протягом щонайменше 4-х тижнів. Тест повинен підтвердити, що пацієнтка не вагітна перед початком терапії помалідомідом.
Спостереження та закінчення лікування
Тест на вагітність під наглядом лікаря слід повторювати щонайменше кожні 4 тижні, включаючи принаймні 4 тижні після закінчення лікування, за винятком випадків, коли була виконана стерилізація шляхом оклюзії маткових труб. Тест на вагітність слід проводити в день візиту до лікаря, на якому призначається препарат, або за 3 дні до відвідування лікаря, який призначає лікарський засіб.
Додаткові заходи безпеки
Пацієнтів слід проінструктувати про те, що не можна передавати цей лікарський засіб іншим особам та про необхідність повернути невикористані капсули своєму фармацевту при завершенні лікування.
Пацієнти, які застосовують помалідомід, не повинні бути донорами крові, сім’яної рідини або сперматозоїдів під час лікування (у тому числі під час переривання дози) і протягом 7 днів після припинення терапії помалідомідом.
Медичним працівникам та людям, які доглядають за пацієнтами, необхідно одягати одноразові рукавички при будь-яких маніпуляціях з блістерами або капсулами лікарського засобу. Жінки, які підтверджено або ймовірно є вагітними, не повинні торкатися блістерів або капсул.
Навчальні матеріали, обмеження для призначення та видачі лікарського засобу
Щоб допомогти пацієнтам уникнути дії помалідоміду на плід, власник торгової ліцензії надасть медичним працівникам навчальні матеріали, які підкріплять застереження щодо очікуваних тератогенних ефектів помалідоміду, надасть рекомендації щодо контрацепції до початку терапії та інструктуватимуть стосовно необхідності виконання тестів на вагітність. Лікар, який призначає лікарський засіб, повинен інформувати пацієнта щодо очікуваного ризику тератогенних ефектів та необхідності застосування суворих заходів із запобігання вагітності відповідно до описаного в частині щодо запобігання вагітності, та надати пацієнтам відповідну навчальну брошуру для пацієнта, картку пацієнта та/або аналогічний застосунок відповідно до впровадженої національної системи ведення карток пацієнта. Система контрольованої видачі препарату включає використання картки пацієнта та/або аналогічного засобу для контролю призначення та/або видачі лікарських засобів пацієнтам та збір детальних даних стосовно показань до застосування лікарського засобу з метою здійснення моніторингу використання лікарського засобу поза затвердженими рекомендаціями із застосування. В ідеалі діагностика вагітності, видача рецепта та відпуск лікарського засобу повинні проводитися в один і той же день. Видача помалідоміду жінкам репродуктивного віку має відбутися протягом 7 днів після призначення даного лікарського засобу і після отримання негативного результату тесту на вагітність, виконаного під контролем лікаря. У жінок з репродуктивним потенціалом призначення лікарського засобу може здійснюватися максимум на 4-тижневий період лікування згідно зі схваленими схемами застосування лікарського засобу відповідно до показання, а в усіх інших пацієнтів лікарського засобу може призначатися максимум на 12-тижневий період лікування.
Гематологічні ускладнення
Найчастішою гематологічною небажаною реакцією 3 або 4 ступеня важкості у пацієнтів із рецидивною/рефрактерною множинною мієломою була нейтропенія, і наступними за нею за частотою є анемія і тромбоцитопенія. Пацієнтів слід контролювати на наявність гематологічних побічних реакцій, особливо нейтропенії. Також пацієнтів потрібно попередити про необхідність повідомляти про виникнення епізодів гарячки в найкоротші терміни. Лікарі повинні спостерігати за пацієнтами щодо ознак кровотеч, в тому числі носових кровотеч, особливо у разі одночасного застосування лікарських засобів, для яких відомо, що вони збільшують ризик кровотеч. Повний аналіз крові слід робити на початку терапії, щотижня протягом перших 8 тижнів терапії та надалі щомісяця. Може знадобитися зміна дози. Пацієнтам може знадобитися підтримувальна терапія препаратами крові та/або факторами росту.
Тромбоемболічне ускладнення
У пацієнтів, які отримують помалідомід у комбінації з бортезомібом та дексаметазоном або в поєднанні з дексаметазоном, можливе виникнення венозної тромбоемболії (переважно тромбоз глибоких вен і легенева емболія) та артеріальних тромбоемболічних ускладнень (інфаркт міокарда та порушення мозкового кровообігу). Пацієнти з відомими факторами ризику виникнення тромбоемболії, включаючи попередній тромбоз, повинні перебувати під ретельним контролем. Слід вжити заходів, щоб мінімізувати всі фактори ризику, які можна усунути (наприклад, куріння, гіпертензія та гіперліпідемія). Пацієнти та лікарі мають бути уважними до ознак та симптомів тромбоемболії. Пацієнти повинні звернутися за медичною допомогою у разі виникнення таких симптомів як задишка, біль у грудях, набряк рук або ніг. Рекомендується застосування засобів антикоагулянтної терапії (якщо вона не протипоказана), таких як ацетилсаліцилова кислота, варфарин, гепарин або клопідогрель, особливо у пацієнтів із додатковими факторами ризику тромботичних ускладнень. Рішення про проведення профілактичних заходів повинно бути прийнято після ретельної оцінки окремих факторів ризику для пацієнта. У клінічних дослідженнях пацієнти отримували для профілактики ацетилсаліцилову кислоту або альтернативну антитромботичну терапію. Застосування еритропоетичних засобів несе ризик виникнення тромботичних ускладнень, включаючи тромбоемболію. Тому еритропоетичні засоби, а також інші засоби, які можуть підвищити ризик виникнення тромбоемболічних ускладнень, слід застосовувати з обережністю.
Розлади щитовидної залози
Повідомлялося про випадки гіпотиреозу. Перед початком лікування необхідно здійснити контроль коморбідних станів, що впливають на функцію щитовидної залози. Рекомендується проводити моніторинг функції щитовидної залози до початку та під час лікування помалідомідом.
Периферична нейропатія
Пацієнти, які мали перебіг периферичної нейропатії ≥ 2 ступеня, були виключені з клінічних досліджень із помалідомідом. Слід бути обережними при вирішенні питання щодо призначення терапії помалідомідом таким пацієнтам.
Виражена серцева дисфункція
Пацієнти зі значною серцевою дисфункцією (застійна серцева недостатність III або IV ступеня за класифікацією Нью-Йоркської Асоціації Кардіологів; випадок інфаркту міокарда протягом 12 місяців після початку дослідження; нестабільна або погано контрольована стенокардія) були виключені з клінічних досліджень терапії помалідомідом. Повідомлялося про побічні реакції з боку серцевої системи, включаючи застійну серцеву недостатність, набряк легень та фібриляцію передсердь, головним чином у пацієнтів із наявними серцевими захворюваннями або серцевими факторами ризику. Слід дотримуватися належної обережності при призначенні помалідоміду таким пацієнтам, включаючи періодичний контроль за ознаками або симптомами серцево-судинної системи.
Синдром лізису пухлини
Пацієнти, які мають найбільший ризик виникнення синдрому лізису пухлини, – це пацієнти з високим навантаженням на пухлину до початку лікування. У цьому випадку за пацієнтами слід ретельно спостерігати та вживати відповідних запобіжних заходів при виникненні ризику.
Інше первинне злоякісне новоутворення
У пацієнтів, які отримували помалідомід, повідомляли про випадки виникнення другого первинного злоякісного захворювання – наприклад, немеланомного раку шкіри. Лікарі повинні ретельно слідкувати за пацієнтами до та під час лікування, використовуючи стандартне обстеження з виявлення онкологічних захворювань з метою виявлення можливого другого первинного злоякісного захворювання та у разі необхідності призначати відповідне лікування.
Алергічні реакції та тяжкі шкірні реакції
На тлі застосування помалідоміду повідомляли про розвиток ангіоневротичного набряку, анафілактичних реакцій та важких дерматологічних реакцій, включаючи синдром Стівенса-Джонсона, токсичний епідермальний некроліз (ТЕН) і DRESS-синдром. Пацієнтів необхідно проконсультувати щодо ознак і симптомів таких реакцій та проінструктувати їх про необхідність негайно звертатися за медичною допомогою у разі виникнення цих симптомів. Застосування помалідоміду необхідно припинити при ексфоліативному або бульозному висипанні або при підозрі на синдром Стівенса-Джонсона, або токсичний епідермальний некроліз (ТЕН), або DRESS-синдром; і більше не призначати знову після того, як він був відмінений через розвиток цих реакцій. Пацієнти із серйозними алергічними реакціями на талідомід або леналідомід в анамнезі були виключені з клінічних досліджень. Такі пацієнти мають вищий ризик виникнення реакцій гіперчутливості та не повинні приймати помалідомід. При виникненні висипання 2‑3 ступеня слід розглянути можливість тимчасового або остаточного припинення застосування лікарського засобу. Необхідно назавжди припинити терапію помалідомідом при виникненні ангіоневротичного набряку та анафілактичної реакції.
Запаморочення та дезорієнтація
Після застосування помалідоміду були зареєстровані випадки запаморочення та сплутаності свідомості. Пацієнти повинні уникати ситуацій, у яких запаморочення або сплутаність свідомості можуть стати проблемою, та не застосовувати інші лікарські засоби, які можуть спричинити запаморочення або сплутаність свідомості, без попередньої консультації з лікарем.
Інтерстиціальне захворювання легень (ІЗЛ)
Після застосування помалідоміду були зареєстровані випадки ІЗЛ та пов’язані з ним випадки, включаючи пневмонію. Необхідно проводити ретельну оцінку хворих із гострим початком або необґрунтованим погіршенням симптомів легеневих захворювань для того, щоб виключити ІЗЛ. Застосування помалідоміду необхідно тимчасово припинити на час дослідження цих симптомів, і, якщо ІЗЛ буде підтверджено, розпочати відповідне лікування. Терапію помалідомідом слід відновити лише після ретельної оцінки співвідношення користі та ризиків.
Порушення з боку печінки
У пацієнтів, які застосовували помалідомід, спостерігалося помітне підвищення рівня аланінамінотрансферази (АЛТ) та білірубіну. Також повідомлялося про випадки виникнення гепатиту, через що довелося припинити терапію помалідомідом. Рекомендовано постійно стежити за клінічними показниками роботи печінки протягом перших 6 місяців лікування та після припинення терапії.
Інфекції
Про повторне виникнення гепатиту В після терапії помалідомідом у поєднанні з дексаметазоном у пацієнтів, які раніше були заражені вірусом гепатиту В (ВГВ), повідомляли рідко. Деякі з цих випадків спричинили гостру печінкову недостатність, через що довелося припинити терапію помалідомідом. До початку терапії помалідомідом слід встановити наявність або відсутність вірусу гепатиту В. Пацієнтам, які мають позитивний тест на вірус гепатиту В (ВГВ), рекомендується проконсультуватися з лікарем, який має досвід у лікуванні гепатиту В. Слід проявляти обережність при терапії помалідомідом у комбінації з дексаметазоном при лікуванні пацієнтів, які раніше мали вірус гепатиту В, включаючи пацієнтів з позитивним результатом тестування на антитіла до ядерного антигена ВГВ (анти-HBc), але негативним результатом тестування на поверхневий антиген ВГВ (HBsAg).
За цими пацієнтами необхідно здійснювати ретельний нагляд щодо можливого виникнення ознак і симптомів активної інфекції ВГВ протягом усього періоду лікування лікарським засобом.
Прогресуюча мультифокальна лейкоенцефалопатія (ПМЛ)
Повідомляли про випадки прогресуючої мультифокальної лейкоенцефалопатії, включаючи летальні випадки, при застосуванні помалідоміду. Повідомляли про випадки ПМЛ, які виникли від декількох місяців до декількох років після початку лікування помалідомідом. Як правило, реєстрували випадки ПМЛ у пацієнтів, які одночасно приймали дексаметазон або попереднє лікування іншими імуносупресивними хіміотерапевтичними засобами. Лікарі повинні регулярно спостерігати за пацієнтами та враховувати ПМЛ при диференціальному діагнозі у пацієнтів з новими або прогресуючими неврологічними симптомами, когнітивними або поведінковими ознаками чи симптомами. Також пацієнтам слід рекомендувати інформувати свого партнера або опікунів про своє лікування, оскільки вони можуть помітити симптоми, про які пацієнт не знає.
Оцінка ПМЛ повинна базуватися на неврологічному обстеженні, магнітно-резонансній томографії мозку та аналізі ліквору на ДНК вірусу JC (JCV) методом полімеразної ланцюгової реакції (ПЛР) або біопсії мозку з тестуванням на JCV. Негативна ПЛР JCV не виключає ПМЛ. Якщо не вдається встановити альтернативний діагноз, може бути потрібне додаткове спостереження та оцінка.
Якщо є підозра на ПМЛ, подальше дозування слід призупинити, поки ПМЛ не буде виключено. Якщо ПМЛ підтверджено, необхідно остаточно відмінити помалідомід.
Вміст натрію
Цей лікарський засіб містить менше 1 ммоль натрію (23 мг) на капсулу, тобто можна вважати, що даний засіб вільний від натрію.
Лікарський засіб містить у складі допоміжних речовин лактозу, тому якщо у пацієнта встановлена непереносимість деяких цукрів, необхідно проконсультуватися з лікарем, перш ніж приймати цей лікарський засіб.
Застосування у період вагітності або годування груддю.
Жінки репродуктивного віку/контрацепція у чоловіків і жінок
Жінки репродуктивного віку повинні використовувати ефективні методи контрацепції. Якщо жінка завагітніла під час терапії помалідомідом, лікування необхідно припинити, а пацієнтку направити до лікаря, який спеціалізується або досвідчений у тератології, для оцінки ризиків для плода та надання порад. Якщо жінка завагітніла від чоловіка, який застосовує помалідомід, рекомендується направити пацієнтку до лікаря, який спеціалізується або досвідчений у тератології, для оцінки ризиків для плода та надання порад. Помалідомід проникає у сім’яну рідину людини. Як запобіжний захід всі пацієнти чоловічої статі, які приймають помалідомід, повинні використовувати презервативи протягом усього періоду лікування, під час переривання дози та протягом 7 днів після припинення лікування в тому випадку, якщо партнерка вагітна або репродуктивного віку і не застосовує інших видів контрацепції.
Вагітність
Тератогенний ефект помалідоміду на організм людини є ймовірним. Помалідомід протипоказаний до застосування у період вагітності та жінкам репродуктивного віку, за винятком випадків, коли всі умови для запобігання вагітності виконані.
Годування груддю
Немає даних, які б підтвердили проникнення лікарського засобу у грудне молоко людини. Помалідомід, після його введення, був виявлений у молоці щурів. Через потенційну можливість виникнення побічних реакцій від помалідоміду у дітей, які знаходяться на грудному годуванні, необхідно прийняти рішення про припинення годування груддю або відміну терапії лікарським засобом, враховуючи користь грудного годування для дитини та користь терапії для жінки.
Фертильність
Було встановлено, що помалідомід негативно впливає на фертильність і має тератогенний вплив на тварин. Помалідомід проникав крізь плаценту та був виявлений у крові плода після введення вагітним кроликам.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Помалідомід має незначний або помірний вплив на здатність керувати транспортними засобами або працювати з іншими автоматизованими системами. Після застосування помалідоміду повідомлялося про випадки виникнення стомлюваності, пригніченого рівня свідомості, сплутаності свідомості та запаморочення. Якщо під час застосування терапії помалідомідом виникають вказані побічні реакції, пацієнти мають бути проінструктовані про те, що їм не слід керувати транспортним засобом, працювати з іншими автоматизованими системами або виконувати небезпечні види діяльності під час лікування помалідомідом.
Спосіб застосування та дози.
Лікування необхідно розпочинати та контролювати під наглядом лікарів, які мають досвід лікування множинної мієломи.
Дозування продовжують або змінюють на підставі клінічних та лабораторних результатів.
Комбінована терапія
• Помалідомід у поєднанні з бортезомібом і дексаметазоном
Рекомендована початкова доза помалідоміду становить 4 мг перорально один раз на добу з 1-го по 14-й день кожного 21-денного циклу лікування.
У комбінації з бортезомібом і дексаметазоном помалідомід слід застосовувати відповідно до таблиці 1. Рекомендована початкова доза бортезомібу становить 1,3 мг/м2; вводиться внутрішньовенно або підшкірно один раз на добу у дні, зазначені в таблиці 1. Рекомендована доза дексаметазону становить 20 мг перорально один раз на добу у дні, зазначені в таблиці 1. Лікування помалідомідом у поєднанні з бортезомібом та дексаметазоном слід проводити до прогресування захворювання або до появи неприйнятної токсичності.
Рекомендована схема дозування помалідоміду у поєднанні з бортезомібом та дексаметазоном
Таблиця 1
|
Цикли 1-8 |
День (з 21-денного циклу) |
||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
Помалідомід (4 мг) |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
|||||||
|
Бортезоміб (1,3 мг/м2) |
• |
• |
• |
• |
|||||||||||||||||
|
Дексаметазон (20 мг)* |
• |
• |
• |
• |
• |
• |
• |
• |
|||||||||||||
|
Цикл 9 і подальші цикли |
День (з 21-денного циклу) |
||||||||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
Помалідомід (4 мг) |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
• |
|||||||
|
Бортезоміб (1,3 мг/м2) |
• |
• |
|||||||||||||||||||
|
Дексаметазон (20 мг)* |
• |
• |
• |
• |
|||||||||||||||||
* Див. Особливі групи населення щодо застосування у пацієнтів віком >75 років.
Зміна дози або тимчасове припинення застосування помалідоміду
Для того, щоб почати новий цикл помалідоміду, число нейтрофілів повинно становити > 1 х 109/л, а кількість тромбоцитів повинна становити > 50 х 109/л.
Інструкції з тимчасового припинення застосування помалідоміду або зниження його дози у зв'язку з виникненням побічних реакцій, пов’язаних з помалідомідом, наведені в таблиці 2, а рівні дозування визначені в таблиці 3.
Інструкції зі зміни дозування помалідоміду∞
Таблиця 2
|
Токсичність |
Зміна дозування |
|
Нейтропенія* АКН** <0,5 х 109/л або фебрильна нейтропенія (гарячка ≥38,5 °С і АКН** <1 х 109/л) |
Тимчасово припинити лікування помалідомідом до завершення циклу. Виконувати ЗАК*** щотижня. |
|
Повернення рівня АКН** до ≥ 1 x 109/л |
Відновити лікування помалідомідом у дозі, нижчій від попередньої на один рівень. |
|
Для кожного наступного зниження < 0,5 x 109/л |
Тимчасово припинити лікування помалідомідом. |
|
Повернення рівня АКН** до ≥ 1 x 109/л |
Відновити лікування помалідомідом у дозі, нижчій від попередньої на один рівень. |
|
Тромбоцитопенія Вміст тромбоцитів < 25 x 109/л |
Тимчасово припинити лікування помалідомідом до завершення циклу. Виконувати ЗАК*** щотижня. |
|
Повернення до рівня ≥ 50 x 109/л |
Відновити лікування помалідомідом у дозі, нижчій від попередньої на один рівень. |
|
Для кожного наступного зниження < 25 x 109/л |
Тимчасово припинити лікування помалідомідом. |
|
Повернення до рівня ≥ 50 x 109/л |
Відновити лікування помалідомідом у дозі, нижчій від попередньої на один рівень. |
|
Висипання Висипання 2-3 ступеня |
Розглянути доцільність тимчасового припинення лікування або припинення застосування помалідоміду. |
|
Висипання 4 ступеня або пухирі (включаючи ангіоневротичний набряк, анафілактичну реакцію, ексфоліативні або бульозні висипання, або якщо підозрюється синдром Стівенса-Джонсона, токсичний епідермальний некроліз (ТЕН) або медикаментозна реакція з еозинофілією та системною симптоматикою (DRESS-синдром)) |
Назавжди відмінити лікування. |
|
Інше Інші побічні реакції, пов’язані з помалідомідом ≥ 3 ступеня |
Тимчасово припинити лікування помалідомідом до завершення циклу. У наступному циклі відновити лікування помалідомідом у дозі, нижчій за попередню на один рівень (побічні реакції повинні зникнути або зменшитися до ≤ 2 ступеня, перш ніж можна знову розпочинати застосування лікарського засобу). |
∞ Інструкції щодо зміни дози в цій таблиці застосовують для помалідоміду у поєднанні з бортезомібом та дексаметазоном та для помалідоміду у поєднанні з дексаметазоном.
* У випадку нейтропенії лікар повинен розглянути питання про використання факторів росту.
** АКН - абсолютна кількість нейтрофілів.
*** ЗАК - загальний клінічний аналіз крові.
Зниження дози помалідоміду∞
Таблиця 3
|
Рівень дозування |
Доза помалідоміду при пероральному прийомі |
|
Початкова доза |
4 мг |
|
Рівень дози-1 |
3 мг |
|
Рівень дози-2 |
2 мг |
|
Рівень дози-3 |
1 мг |
∞ Інструкції щодо зміни дози в цій таблиці застосовують для помалідоміду у поєднанні з бортезомібом та дексаметазоном та для помалідоміду у поєднанні з дексаметазоном.
Якщо побічні реакції з’являються після зниження дози до 1 мг, то застосування лікарського засобу необхідно припинити.
Сильні інгібітори CYP1A2
Якщо сильні інгібітори CYP1A2, такі як ципрофлоксацин, еноксацин і флувоксамін, застосовувати разом із помалідомідом, необхідно зменшити дозу помалідоміду на 50 %.
Корекція дози або тимчасове припинення застосування бортезомібу
Для отримання інструкцій щодо тимчасового припинення застосування або зменшення дози бортезомібу лікарі повинні звернутися до відповідної інструкції для медичного застосування лікарського засобу з діючою речовиною бортезоміб.
Корекція дози або тимчасове припинення застосування дексаметазону
Інструкції щодо тимчасового припинення застосування або зменшення дози для дексаметазону зазначені в наведених нижче таблицях 4 та 5. Однак рішення щодо тимчасового припинення терапії або відновлення дози лікарського засобу приймаються на розсуд лікаря відповідно до інструкції для медичного застосування лікарського засобу.
Інструкція щодо зміни дозування дексаметазону
Таблиця 4
|
Токсичність |
Зміна дози |
|
Диспепсія 1-2 ступеня |
Застосовувати рекомендовану дозу та лікувати блокатором H2-гістамінових рецепторів або аналогом. Знижувати дозу на один рівень, якщо симптоми зберігаються. |
|
Диспепсія ≥3 ступеня |
Тимчасово припиняти терапію лікарським засобом, поки симптоми не стануть контрольованими. Додати блокатор H2-гістамінових рецепторів або аналог та відновити прийом у дозі на один рівень нижчий від попередньої дози. |
|
Набряки >3 ступеня |
У разі необхідності додати до терапії діуретик та зменшити дозу лікарського засобу на один рівень від попередньої. |
|
Дезорієнтація та порушення настрою ≥ 2 ступеня |
Тимчасово припинити терапію лікарським засобом, поки симптоми не зникнуть. Відновлювати лікування у дозі, нижчій від попередньої на один рівень. |
|
М’язова слабкість ≥ 2 ступеня |
Тимчасово припинити лікування лікарським засобом, поки симптоми м’язової слабкості стануть ≤ 1 ступеня. Відновити лікування у дозі, нижчій від попередньої на один рівень. |
|
Гіперглікемія ≥ 3 ступеня |
Зменшити дозу лікарського засобу на один рівень. За потреби призначати інсулін або пероральні гіпоглікемічні засоби. |
|
Гострий панкреатит |
Остаточно виключити дексаметазон зі схеми лікування. |
|
Інші побічні реакції від дексаметазону ≥ 3 ступеня |
Припинити терапію дексаметазоном, допоки прояви побічних реакцій не стануть ≤ 2 ступеня. Відновити лікування у дозі, нижчій від попередньої на один рівень. |
Якщо відновлення від токсичного ефекту триває понад 14 днів, прийом дексаметазону слід відновити в дозі на один рівень нижче від попередньої дози.
Зниження дози дексаметазону
Таблиця 5
|
Рівень дозування |
Вік ≤ 75 років Доза (цикли 1-8: день 1, 2, 4, 5, 8, 9, 11, 12 із 21-денного циклу; цикл ≥ 9: день 1, 2, 8, 9 із 21-денного циклу) |
Вік > 75 років Доза (цикли 1-8: день 1, 2, 4, 5, 8, 9, 11, 12 із 21-денного циклу; цикл ≥ 9: день 1, 2, 8, 9 із 21-денного циклу) |
|
Початкова доза |
20 мг |
10 мг |
|
Рівень дози-1 |
12 мг |
6 мг |
|
Рівень дози-2 |
8 мг |
4 мг |
Застосування дексаметазону слід припинити, якщо пацієнт не може переносити дозу 8 мг у віці ≤ 75 років або дозу 4 мг у віці >75 років.
У разі відміни будь-якого з компонентів схеми лікування подальше застосування решти лікарських засобів визначає лікар.
• Помалідомід у поєднанні з дексаметазоном
Рекомендована початкова доза лікарського засобу становить 4 мг, застосовувати перорально один раз на день з 1-го по 21-й день кожного 28 денного циклу лікування.
Рекомендована доза дексаметазону становить 40 мг перорально один раз на день на 1, 8, 15 та 22 день кожного 28-денного циклу лікування.
Лікування помалідомідом у поєднанні з дексаметазоном слід проводити до прогресування захворювання або до появи неприйнятних токсичних ефектів.
Корекція дози або тимчасове припинення застосування помалідоміду
Інструкції щодо тимчасового припинення терапії або зменшення ризику виникнення побічних реакцій, пов’язаних із помалідомідом, наведені в таблицях 2 та 3.
Корекція дози дексаметазону
Інструкції щодо зміни дози для зниження ризику виникнення побічних реакцій, пов’язаних із дексаметазоном, наведені в таблиці 4. Інструкції щодо зниження дози для зменшення ризику виникнення побічних реакцій, пов’язаних із дексаметазоном, наведені в таблиці 6. Однак рішення щодо припинення/відновлення прийому дози приймаються на розсуд лікаря відповідно до чинної інструкції для медичного застосування лікарського засобу.
Зниження дози дексаметазону
Таблиця 6
|
Рівень дозування |
Вік ≤ 75 років День 1, 8, 15, 22 кожного 28-денного циклу |
Вік >75 років День 1, 8, 15, 22 кожного 28-денного циклу |
|
Початкова доза |
40 мг |
20 мг |
|
Рівень дози-1 |
20 мг |
12 мг |
|
Рівень дози-2 |
10 мг |
8 мг |
Застосування дексаметазону слід припинити, якщо пацієнт не може переносити дозу 10 мг у віці ≤ 75 років або дозу 8 мг у віці >75 років.
Особливі групи населення
Пацієнти літнього віку
Помалідомід у поєднанні з бортезомібом та дексаметазоном.
Коригування дози для помалідоміду не є необхідним.
Інформація про одночасне застосування бортезомібу у поєднанні з помалідомідом наведена у відповідному розділі поточної інструкції для медичного застосування.
Для пацієнтів віком >75 років початкова доза дексаметазону становить:
• Доза з 1 по 8 цикл: 10 мг один раз на день у 1, 2, 4, 5, 8, 9, 11 та 12 дні кожного 21-денного циклу.
• Для 9 і наступних циклів: 10 мг один раз на день у 1, 2, 8 і 9 дні кожного 21-денного циклу.
Помалідомід у поєднанні з дексаметазоном
Коригування дози для помалідоміду не є необхідним.
Для пацієнтів віком >75 років початкова доза дексаметазону становить:
• 20 мг один раз на добу у 1, 8, 15 і 22 дні кожного 28-денного циклу.
Печінкова недостатність
Пацієнти із загальним білірубіном у сироватці крові > 1,5 x ВМН (верхня межа норми) були виключені з клінічних досліджень. Порушення функції печінки має незначний вплив на фармакокінетику помалідоміду. Не потрібно коригувати початкову дозу помалідоміду пацієнтам із порушеннями функції печінки, визначеними за критеріями Чайлда-П’ю. Однак пацієнтів із порушеннями функції печінки слід додатково контролювати щодо виникнення побічних реакцій, при необхідності зменшувати дози або тимчасово припиняти лікування помалідомідом.
Ниркова недостатність
Коригування дози помалідоміду для пацієнтів із порушеннями функції нирок не є необхідним. У дні, коли пацієнти перебувають на гемодіалізі, дозу помалідоміду слід приймати після гемодіалізу.
Спосіб застосування
Пероральне застосування.
Тверді капсули слід приймати перорально в один і той же час щодня. Капсули не слід відкривати, ламати або жувати. Капсули слід ковтати цілими, бажано запивати водою, з їжею або без неї. Якщо пацієнт забув прийняти дозу помалідоміду протягом одного дня, то необхідно прийняти призначену дозу, як заплановано, наступного дня. Пацієнти не повинні змінювати дозу, щоб компенсувати пропущену в попередні дні дозу.
Рекомендується натискати лише на один край капсули, щоб витиснути її з блістера, тим самим зменшуючи ризик деформації капсули або її розламування.
Інформацію про інші лікарські засоби, які застосовують у комбінації з Ксенпомою, наведено у відповідних інструкціях для медичного застосування.
Діти.
Немає даних щодо застосування помалідоміду дітям віком до 18 років для показання множинна мієлома.
Крім зареєстрованих показань, застосування помалідоміду вивчали у дітей віком від 4 до 18 років з рецидивуючими або прогресуючими пухлинами головного мозку, однак результати досліджень не дозволили зробити висновок про те, що користь від такого застосування переважує ризики. Наявна на даний час інформація зазначена в розділах «Побічні реакції» та «Фармакологічні властивості». Не існує відповідного застосування помалідоміду у дітей віком 0‑17 років за показаннями множинної мієломи.
Передозування.
Вивчали застосування помалідоміду у дозі до 50 мг у вигляді разової дози у здорових добровольців та у дозі 10 мг декілька разів на добу у пацієнтів із множинною мієломою; при цьому не було виявлено жодних серйозних побічних реакцій, які були б пов'язані з передозуванням. У ході досліджень встановлено, що помалідомід виводиться шляхом гемодіалізу.
У разі передозування рекомендується підтримувальна терапія.
Побічні реакції.
Помалідомід у комбінації з бортезомібом та дексаметазоном
Найчастіше виявляли порушення з боку системи крові та лімфатичної системи: нейтропенію (46,8 %), тромбоцитопенію (36,7 %) та анемію (28,4 %). Найчастіше надходили повідомлення про периферичну сенсорну нейропатію (47,8 %). Найпоширенішими побічними реакціями 3 або 4 ступеня були реакції з боку системи крові та лімфатичної системи: нейтропенія (41,7 %), тромбоцитопенія (27,3 %) та анемія (14,0 %). Найпоширенішою серйозною побічною реакцією, про яку повідомлялося, була пневмонія (11,5 %). Інші серйозні побічні реакції включали гарячку (4,0 %), інфекції нижніх дихальних шляхів (2,9 %), легеневу емболію (2,9 %), грип (2,9 %) та гостре ураження нирок (2,9 %).
Помалідомід у комбінації з дексаметазоном
Найчастіше у клінічних дослідженнях повідомляли про побічні реакції з боку системи крові та лімфатичної системи, що включали анемію (45,7 %), нейтропенію (45,3 %) та тромбоцитопенію (27 %); спостерігалися загальні розлади та місцеві ускладнення у місці застосування лікарських засобів, а саме: втома (28,3 %), гарячка (21 %) та периферичний набряк (13 %); при інфекціях та інвазіях виникала пневмонія (10,7 %). Про периферичну нейропатію повідомляли у 12,3 % пацієнтів, про випадки венозної або тромботичної емболії (ВТЕ) – у 3,3 % пацієнтів. Найчастіше повідомляли про побічні реакції 3 або 4 ступеня з боку системи крові та лімфатичної системи, що включали нейтропенію (41,7 %), анемію (27 %) та тромбоцитопенію (20,7 %); побічні реакції при інфекціях та інвазіях, включаючи пневмонію (9 %); спостерігалися загальні розлади та місцеві ускладнення у місці застосування лікарських засобів, а саме: втома (4,7 %), гарячка (3 %) та периферичний набряк (1,3 %). Найпоширенішою серйозною побічною реакцією, про яку повідомлялося, була пневмонія (9,3 %). Інші серйозні побічні реакції включали фебрильну нейтропенію (4,0 %), нейтропенію (2,0 %), тромбоцитопенію (1,7 %) та реакції венозної або тромботичної емболії (1,7 %).
Побічні реакції зазвичай виникають протягом перших 2-х циклів лікування помалідомідом.
Список побічних реакцій у вигляді таблиці
Помалідомід у поєднанні з бортезомібом та дексаметазоном
У рандомізованому дослідженні CC-4047-MM-007 278 пацієнтів отримували помалідомід, бортезоміб та дексаметазон (Pom+Btz+Dex arm) (див. розділ «Спосіб застосування та дози»).
Побічні реакції, які спостерігаються у пацієнтів, які отримували помалідомід у поєднанні з бортезомібом та дексаметазоном, наведені в таблиці 7 за системою органних класів (СОК), частотою всіх побічних реакцій та для побічних реакцій 3 та 4 ступеня.
Частоту побічних реакції для комплексної терапії Pom + Btz + Dex (будь-якого класу) визначають відповідно до поточних значень: дуже часто (≥ 1/10); часто (≥ 1/100 і <1/10); нечасто (≥1/1000 і <1/100).
Про всі побічні реакції (ПР) повідомлялося в клінічному дослідженні ММ-007 для пацієнтів, які отримували помалідомід у поєднанні з бортезомібом та дексаметазоном
Таблиця 7
|
Системний органний клас/переважний термін |
Всі побічні реакції/частота |
3‑4 ступінь побічних реакцій/частота |
|
Інфекції та інвазії |
Дуже часто Пневмонія, бронхіт, інфекції верхніх дихальних шляхів, вірусна інфекція верхніх дихальних шляхів Часто Сепсис, септичний шок, коліт, спричинений Clostridium difficile, інфекції дихальних шляхів, інфекції нижніх дихальних шляхів, легенева інфекція, грип, бронхіоліт, інфекції сечовивідних шляхів |
Дуже часто Пневмонія Часто Сепсис, септичний шок, коліт, спричинений Clostridium difficile, бронхіт, інфекції верхніх дихальних шляхів, інфекції нижніх дихальних шляхів, легенева інфекція, грип, бронхіоліт, інфекції сечовивідних шляхів |
|
Доброякісні, злоякісні та неуточнені новоутворення (включаючи кісти та поліпи) |
Часто Базальноклітинна карцинома |
|
|
З боку системи крові та лімфатичної системи |
Дуже часто Нейтропенія, тромбоцитопенія, лейкопенія, анемія Часто Фебрильна нейтропенія, лімфопенія |
Дуже часто Нейтропенія, тромбоцитопенія, анемія Часто Фебрильна нейтропенія, лейкопенія, лімфопенія |
|
Порушення обміну речовин, харчування та метаболізму |
Дуже часто Гіпокаліємія, гіперглікемія Часто Гіпомагніємія, гіпокальціємія, гіпофосфатемія, гіперкаліємія, гіперкальціємія |
Часто Гіпокаліємія, гіперглікемія гіпомагніємія, гіпокальціємія, гіпофосфатемія, гіперкаліємія, гіперкальціємія |
|
Психічні розлади |
Дуже часто Безсоння Часто Депресія |
Часто Депресія, безсоння |
|
З боку нервової системи |
Дуже часто Периферична сенсорна нейропатія, запаморочення, тремор Часто Синкопе, периферична сенсомоторна нейропатія, парестезія, дисгевзія |
Часто Синкопе, периферична сенсорна нейропатія, периферична сенсомоторна нейропатія Нечасто Запаморочення, тремор |
|
З боку органів зору |
Часто Катаракта |
Часто Катаракта |
|
З боку серця |
Часто Фібриляція передсердь |
Часто Фібриляція передсердь |
|
З боку судин |
Часто Тромбоз глибоких вен, гіпотензія, гіпертензія |
Часто Гіпотензія, гіпертензія Нечасто Тромбоз глибоких вен |
|
З боку дихальної системи, органів грудної клітки та середостіння |
Дуже часто Задишка, кашель Часто Тромбоемболія легеневої артерії |
Часто Тромбоемболія легеневої артерії, задишка |
|
З боку шлунково-кишкового тракту |
Дуже часто Діарея, блювання, нудота, запор Часто Біль у животі, біль у верхніх відділах живота, стоматит, сухість у роті, здуття живота |
Часто Діарея, блювання, біль у животі, запор Нечасто Біль у верхніх відділах живота, стоматит, нудота, здуття живота |
|
З боку шкіри та підшкірної клітковини |
Часто Висипання |
Часто Висипання |
|
З боку опорно-рухової системи та сполучної тканини |
Дуже часто М’язова слабкість, біль у спині Часто Біль у кістках, м’язові спазми |
Часто М’язова слабкість, біль у спині Нечасто Біль у кістках |
|
З боку нирок та сечовидільної системи |
Часто Гостра ниркова недостатність, хронічна ниркова недостатність, затримка сечовипускання |
Часто Гостра ниркова недостатність, хронічна ниркова недостатність, затримка сечовипускання |
|
Загальні розлади та реакції у місці застосування лікарського засобу |
Дуже часто Втома, гарячка, периферичний набряк Часто Біль у грудях некардіального походження, набряк |
Часто Втома, гарячка, біль у грудях некардіального походження, периферичний набряк, набряк |
|
Лабораторні та інструментальні дані |
Часто Підвищення рівня АЛТ, зниження маси тіла |
Часто Зниження маси тіла Нечасто Підвищення рівня АЛТ |
|
Травми, отруєння та процедурні ускладнення |
Часто Падіння |
Нечасто Падіння |
Помалідомід у поєднанні з дексаметазоном
У рандомізованому дослідженні CC-4047-MM-003 302 пацієнти із рецидивуючою та рефрактерною множинною мієломою отримали терапію помалідомідом 4 мг, який застосовували один раз на добу протягом 21 дня кожного 28-денного циклу у поєднанні з низькою дозою дексаметазону щотижня.
Побічні реакції, що спостерігалися у пацієнтів, які отримували помалідомід у комбінації з дексаметазоном, наведені нижче в таблиці 8 за системою органних класів (СОК), частотою всіх побічних реакцій та для побічних реакцій 3 або 4 ступеня.
Частота побічних реакцій така ж, як і в групі пацієнтів, які застосовували помалідомід і дексаметазон у дослідженні CC-4047-MM-003 (n=302). Усередині кожного СОК і в угрупуваннях за частотою несприятливі реакції наведені у порядку зменшення серйозності. Частоту визначають відповідно до поточних значень: дуже часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); частота невідома (не може бути визначена на основі наявних даних).
Часті побічні реакції, зазначені в клінічному дослідженні MM-003 у пацієнтів, які отримували помалідомід у поєднанні з дексаметазоном
Таблиця 8
|
Системний органний клас/бажаний термін |
Усі часті побічні реакції/частота |
3‑4 ступінь частих побічних реакцій/частота |
|
Інфекції та інвазії |
Дуже часто Пневмонія (бактеріальної, вірусної та грибкової інфекції, включаючи умовно патогенні інфекції) Часто Нейтропенічний сепсис, бронхопневмонія, бронхіт, інфекції дихальних шляхів, інфекції верхніх дихальних шляхів, назофарингіт, оперізувальний герпес |
Часто Нейтропенічний сепсис, пневмонія (бактеріальної, вірусної та грибкової інфекції, включаючи умовно патогенні інфекції), бронхопневмонія, інфекції дихальних шляхів, інфекції верхніх дихальних шляхів Нечасто Бронхіт, оперізувальний герпес |
|
Доброякісні, злоякісні та неуточнені новоутворення (у тому числі кісти та поліпи) |
Нечасто Базальноклітинний рак шкіри, плоскоклітинний рак шкіри |
Нечасто Базальноклітинний рак шкіри, плоскоклітинний рак шкіри |
|
З боку системи крові та лімфатичної системи |
Дуже часто Нейтропенія, тромбоцитопенія, лейкопенія, анемія Часто Фебрильна нейтропенія |
Дуже часто Нейтропенія, тромбоцитопенія, анемія Часто Фебрильна нейтропенія, лейкопенія |
|
Порушення обміну речовин та метаболізму |
Дуже часто Зниження апетиту Часто Гіперкаліємія, гіпонатріємія |
Часто Гіперкаліємія, гіпонатріємія Нечасто Зниження апетиту |
|
Психічні розлади |
Часто Сплутаність свідомості |
Часто Сплутаність свідомості |
|
З боку нервової системи |
Часто Знижений рівень свідомості, периферична сенсорна нейропатія, запаморочення, тремор |
Часто Знижений рівень свідомості Нечасто Периферична сенсорна нейропатія, запаморочення, тремор |
|
З боку органів слуху та лабіринту |
Часто Запаморочення |
Часто Запаморочення |
|
З боку судин |
Часто Тромбоз глибоких вен |
Нечасто Тромбоз глибоких вен |
|
З боку дихальної системи, органів грудної клітки та середостіння |
Дуже часто Задишка, кашель Часто Тромбоемболія легеневої артерії |
Часто Задишка Нечасто Тромбоемболія легеневої артерії, кашель |
|
З боку шлунково-кишкового тракту |
Дуже часто Діарея, нудота, запор Часто Блювання, шлунково-кишкові кровотечі |
Часто Діарея, блювання, запор Нечасто Нудота, шлунково-кишкові кровотечі |
|
З боку печінки та жовчовивідних шляхів |
Нечасто Гіпербілірубінемія |
Нечасто Гіпербілірубінемія |
|
З боку шкіри та підшкірної клітковини |
Часто Висипання, свербіж |
Часто Висипання |
|
З боку опорно-рухової системи та сполучної тканини |
Дуже часто Біль у кістках, м’язові спазми |
Часто Біль у кістках Нечасто М’язові спазми |
|
З боку нирок та сечовидільної системи |
Часто Ниркова недостатність, затримка сечовиділення |
Часто Ниркова недостатність Нечасто Затримка сечовипускання |
|
З боку органів репродуктивної системи та молочних залоз |
Часто Біль у ділянці таза |
Часто Біль у ділянці таза |
|
Загальні порушення та порушення у місці введення |
Дуже часто Втома, гарячка, периферичний набряк |
Часто Втома, гарячка, периферичний набряк |
|
Лабораторні та інструментальні дані |
Часто Зменшення кількості нейтрофілів, зменшення кількості лейкоцитів, зменшення кількості тромбоцитів, підвищення рівня АЛТ |
Часто Зменшення кількості нейтрофілів, зменшення кількості лейкоцитів, зменшення кількості тромбоцитів, підвищення рівня АЛТ |
Окрім перерахованих вище побічних реакцій, виявлених у рамках головних клінічних випробувань, наведена нижче таблиця 9 була підготовлена на основі даних, зібраних у післяреєстраційному періоді.
Повідомлення про регулярні побічні реакції, які виникли у післяреєстраційному періоді під час терапії помалідомідом
Таблиця 9
|
Системний органний клас/переважний термін |
Всі побічні реакції/частота |
3‑4 ступінь побічних реакцій/частота |
|
Інфекції та інвазії |
Частота невідома Реактивація гепатиту В |
Частота невідома Реактивація гепатиту В |
|
З боку системи крові та лімфатичної системи |
Часто Панцитопенія |
Часто Панцитопенія |
|
З боку імунної системи |
Часто Ангіоневротичний набряк, кропив’янка Частота невідома Анафілактична реакція, відторгнення трансплантованого твердого органа |
Нечасто Ангіоневротичний набряк, кропив’янка Частота невідома Анафілактична реакція |
|
З боку ендокринної системи |
Нечасто Гіпотиреоз |
|
|
Порушення обміну речовин та метаболізму |
Часто Гіперурикемія Нечасто Синдром лізису пухлин |
Часто Гіперурикемія Нечасто Синдром лізису пухлин |
|
З боку нервової системи |
Часто Внутрішньочерепні крововиливи Нечасто Інсульт |
Нечасто Інсульт, внутрішньочерепні крововиливи |
|
З боку серця |
Часто Серцева недостатність, фібриляція передсердь, інфаркт міокарда |
Часто Серцева недостатність, фібриляція передсердь Нечасто Інфаркт міокарда |
|
З боку дихальної системи, органів грудної клітки та середостіння |
Часто Кровотеча з носа, інтерстиційне захворювання легень |
Нечасто Кровотеча з носа, інтерстиційне захворювання легень |
|
З боку печінки та жовчовивідних шляхів |
Нечасто Гепатит |
|
|
З боку шкіри та підшкірної клітковини |
Частота невідома Лікарська реакція з еозинофілією та системними симптомами, токсичний епідермальний некроліз, синдром Стівенса-Джонсона |
Частота невідома Лікарська реакція з еозинофілією та системними симптомами, токсичний епідермальний некроліз, синдром Стівенса-Джонсона |
|
Лабораторні та інструментальні дані |
Часто Підвищення рівня сечової кислоти у крові |
Нечасто Підвищення рівня сечової кислоти у крові |
Опис обраних побічних реакцій
Тератогенність
Помалідомід структурно пов’язаний із талідомідом. Талідомід – лікарський засіб з відомим тератогенним впливом на людину, який спричиняє тяжкі вроджені вади. Було встановлено, що помалідомід є тератогенним при застосуванні у період основного органогенезу як для щурів, так і для кроликів. Якщо помалідомід застосовувати у період вагітності, очікується тератогенний вплив лікарського засобу на людину.
Нейтропенія та тромбоцитопенія
У пацієнтів, які отримували комбіновану терапію помалідомідом у клінічних дослідженнях, нейтропенія спостерігалася у 46,8 % пацієнтів (з них 41,7 % 3 або 4 ступеня). Нейтропенія не призводила до переривання терапії помалідомідом у жодного пацієнта та найчастіше була несерйозною.
Повідомляли про випадки фебрильної нейтропенії у 3,2‑6,7 % пацієнтів, з них у 1,8‑4,0 % пацієнтів вважалася серйозною.
У пацієнтів, які отримували комбіновану терапію помалідомідом під час клінічних досліджень, тромбоцитопенія виникла у 27,0‑36,7 % пацієнтів. Тромбоцитопенія 3 або 4 ступеня виникла у 20,7‑27,3 % пацієнтів, що призвело до переривання терапії помалідомідом у 0,7 % пацієнтів та вважалася серйозною у 0,4‑1,7 %.
Нейтропенія та тромбоцитопенія виникали частіше протягом перших двох циклів лікування помалідомідом (див. розділи «Особливості застосування» та «Спосіб застосування та дози»).
Інфекція
Інфекція була найпоширенішим негематологічним токсичним проявом.
У пацієнтів, які отримували комбіновану терапію помалідомідом під час клінічних досліджень, зараження інфекцією виникало у 55,0‑80,2 % пацієнтів (з них 24,0‑30,9 % – 3 або 4 ступеня). Інфекції верхніх дихальних шляхів і пневмонія були найчастішими проявами інфекцій. Летальні інфекції (5 ступінь) траплялися у 2,7‑4,0 % пацієнтів. Інфекції призвели до припинення терапії помалідомідом у 2,0‑2,9 % пацієнтів.
Тромбоемболічні ускладнення
Профілактика ацетилсаліциловою кислотою (та іншими антикоагулянтами для пацієнтів з високим ризиком) була обов’язковою для всіх пацієнтів у клінічних дослідженнях. Рекомендується антикоагуляційна терапія (якщо вона не протипоказана).
У пацієнтів, які отримували комбіновану терапію помалідомідом під час клінічних досліджень, венозні тромбоемболічні ускладнення траплялися у 3,3-11,5 % пацієнтів (з них 1,3‑5,4 % – 3 або 4 ступеня). Венозне тромбоемболічне ускладнення було зареєстровано як серйозна побічна реакція у 1,7‑4,3 % пацієнтів, не було зафіксовано летальних реакцій, виникнення венозного тромбоемболічного ускладнення асоціювали з припиненням терапії помалідомідом до 1,8 % пацієнтів.
Периферична нейропатія
• Помалідомід у поєднанні з бортезомібом та дексаметазоном
Пацієнти з тривалою периферичною нейропатією ≥2 ступеня із болем за 14 днів до рандомізації були виключені з клінічних досліджень. Периферична нейропатія спостерігалася у 55,4 % пацієнтів (з них 10,8 % 3 ступеня; 0,7 % 4 ступеня). Скориговані за тривалістю впливу показники були порівнянними для різних груп лікування. Приблизно 30 % пацієнтів, які зазнали периферичної нейропатії, мали в анамнезі нейропатію на початку дослідження. Периферична нейропатія призвела до відміни бортезомібу приблизно у 12,9 % пацієнтів, помалідоміду у 1,8 % пацієнтів та дексаметазону у 2,2‑8,9 % пацієнтів відповідно. Слід звернутися також до відповідної інструкції для медичного застосування бортезомібу.
• Помалідомід у поєднанні з дексаметазоном
Пацієнти з тривалою периферичною нейропатією ≥ 2 ступеня були виключені з клінічних досліджень. Периферична нейропатія спостерігалася у 12,3 % пацієнтів (з них 1,0 % 3 або 4 ступеня). Ніяких серйозних реакцій периферичної нейропатії не було зареєстровано, перервати терапію через периферичну нейропатію довелося у 0,3 % пацієнтів.
Кровотечі/крововиливи
Повідомлялося про геморагічні розлади після застосування помалідоміду, особливо у пацієнтів з такими факторами ризику як застосування супутніх лікарських засобів, що підвищують ризик виникнення кровотеч. Геморагічні ускладнення включали кровотечі з носа, внутрішньочерепні крововиливи та шлунково-кишкові кровотечі.
Алергічні реакції та тяжкі шкірні реакції
Повідомляли про ангіоневротичний набряк, анафілактичні реакції та тяжкі шкірні реакції, включаючи синдром Стівенса-Джонсона, токсичний епідермальний некроліз та медикаментозні реакції з еозинофілією та системними симптомами після застосування помалідоміду. Пацієнтам із сильними висипаннями в анамнезі, пов’язаними із застосуванням леналідоміду або талідоміду, не потрібна терапія помалідомідом.
Діти
Побічні реакції у педіатричних пацієнтів (віком від 4 до 18 років) з рецидивуючими або прогресуючими пухлинами головного мозку, про які повідомлялося, відповідали відомому профілю безпеки помалідоміду у дорослих пацієнтів (див. розділ «Фармакологічні властивості»).
Повідомлення про підозрювані побічні реакції.
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності.
3 роки.
Умови зберігання.
Зберігати в оригінальній упаковці при температурі не вище 25 °С.
Зберігати у недоступному для дітей місці.
Упаковка.
По 21 капсулі у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 100 капсул у контейнері з кришкою, недоступною для відкриття дітьми, по 1 контейнеру у картонній коробці; по 7 капсул у блістері, по 3 блістери у картонній коробці; по 10 капсул у блістері, по 10 блістерів у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Д-р Редді’с Лабораторіс Лтд, ФТО-7.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Дільниця № Р1-Р9, Фаза - ІІІ, ВСЕЗ, Дюввада, Візакхапатнам Дистрикт, Андра Прадеш, 530046, Індія.
Повідомити про побічну реакцію або відсутність ефективності при застосуванні лікарського засобу можна за телефонами (цілодобово):
+380 44 207 51 97 або +380 50 414 39 39; а також на електронну адресу: [email protected].
