ЕНЖЕНЛА
-
США Пфайзер Ейч.Сі.Пі. КорпорейшнDosage form: розчин для ін’єкцій по 24 мг/1,2 мл; 1 попередньо наповнена ручка, що містить картридж, у картонній коробціComposition: 1 мл розчину містить соматрогону 20 мг;/1 попередньо наповнена ручка містить 24 мг соматрогону в 1,2 мл розчину/Medicinal dispensing terms: за рецептомСertificate number: UA/20559/01/01ATS code: H01AC08Expiry: 3 роки
-
США Пфайзер Ейч.Сі.Пі. КорпорейшнDosage form: розчин для ін’єкцій по 60 мг/1,2 мл; 1 попередньо наповнена ручка, що містить картридж, у картонній коробціComposition: 1 мл розчину містить соматрогону 50 мг;/1 попередньо наповнена ручка містить 60 мг соматрогону в 1,2 мл розчину/Medicinal dispensing terms: за рецептомСertificate number: UA/20559/01/02ATS code: H01AC08Expiry: 3 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЕНЖЕНЛА
(NGENLA)
Склад:
діюча речовина: соматрогон;
1 мл розчину містить соматрогону 20 мг або 50 мг;
1 попередньо наповнена ручка містить 24 мг соматрогону в 1,2 мл розчину або 60 мг соматрогону в 1,2 мл розчину;
допоміжні речовини: тринатрію цитрат, дигідрат; кислота лимонна, моногідрат; L-гістидин, натрію хлорид, м-крезол, полоксамер 188, вода для ін’єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий розчин від безбарвного до світло-жовтуватого кольору із pH 6,6.
Фармакотерапевтична група. Гормони гіпофіза і гіпоталамуса та їхні аналоги, соматропін та агоністи соматропіну. Код АТХ H01A C08.
Фармакологічні властивості
Фармакодинаміка
Механізм дії
Соматрогон — це глікопротеїн, що має амінокислотну послідовність хоріонічного гонадотропіну людини (ХГЛ) з однією копією С-кінцевого пептиду (C-Terminal Peptide, CTP) з бета-ланцюга ХГЛ на N-кінці та двома копіями CTP (в тандемі) на C-кінці. Домени глікозилювання та CTP визначають період напіввиведення соматрогону, що дозволяє застосовувати препарат один раз на тиждень.
Соматрогон зв’язується з рецептором гормону росту (ГР) та ініціює каскад передачі сигналу, що спричиняє зміни росту й метаболізму. Згідно з каскадом передачі сигналу ГР, зв’язування соматрогону призводить до активації сигнального шляху STAT5b і підвищує концентрацію ІФР-1 у сироватці крові. Було виявлено, що концентрація ІФР-1 збільшується залежно від дози під час терапії соматрогоном, що частково опосередковує клінічний ефект. Як наслідок, ГР та ІФР-1 стимулюють метаболічні зміни, лінійний ріст і підвищують швидкість росту в дітей із дефіцитом гормону росту (ДГР).
Фармакодинамічна дія
У клінічних дослідженнях соматрогон підвищує концентрацію ІФР-1. Фармакодинамічні оцінки, проведені приблизно через 96 годин після введення препарату для визначення індексу стандартного відхилення (SDS) середньої концентрації ІФР-1 протягом інтервалу дозування, показали нормалізацію значень ІФР-1 у пацієнтів після одного місяця терапії.
Обмін води та мінеральних речовин
Соматрогон індукує затримку фосфору в організмі.
Клінічна ефективність і безпека
Безпеку та ефективність застосування соматрогону для лікування дітей і підлітків віком від 3 років із ДГР оцінювали у двох багатоцентрових рандомізованих відкритих контрольованих клінічних дослідженнях. Обидва дослідження мали 12-місячний основний період, протягом якого порівнювали застосування соматрогону один раз на тиждень із соматропіном, який вводили один раз на добу, з подальшим відкритим періодом продовження з однією групою, протягом якого всі пацієнти отримували соматрогон один раз на тиждень. Первинною кінцевою точкою оцінки ефективності для обох досліджень була річна швидкість росту після 12 місяців терапії. В обох дослідженнях також оцінювали інші кінцеві точки, що відображають зріст, який вдалось наздогнати, такі як зміна SDS зросту порівняно з вихідним рівнем і SDS зросту.
В опорному багатоцентровому дослідженні не меншої ефективності фази 3 оцінювали безпеку та ефективність застосування соматрогону у дозі 0,66 мг/кг/тиждень порівняно з 0,034 мг/кг/день соматропіну у 224 дітей препубертатного віку з ДГР. Середній вік у групах терапії становив 7,7 року (мінімальний вік — 3,01, максимальний — 11,96), 40,2 % пацієнтів були віком від 3 до 7 років включно, 59,8 % були віком від 7 років; 71,9 % пацієнтів були чоловічої, а 28,1 % — жіночої статі. У цьому дослідженні 74,6 % пацієнтів були представниками європеоїдної раси, 20,1 % належали до монголоїдної раси та 0,9 % були афроамериканцями. Вихідні характеристики захворювання були збалансованими в обох групах терапії. Приблизно 68 % пацієнтів мали піковий рівень ГР у плазмі крові щонайбільше 7 нг/мл, а їхній середній зріст був менший за –2 SDS.
Введення соматрогону один раз на тиждень не менш ефективно впливало на швидкість росту через 12 місяців порівняно із застосуванням соматропіну один раз на добу (див. таблицю 1). Застосування соматрогону один раз на тиждень також спричинило збільшення SDS концентрації ІФР-1 із середнього значення –1,95 на початку дослідження до середнього значення 0,65 через 12 місяців.
|
Таблиця 1 Ефективність соматрогону порівняно із соматропіном у дітей з ДГР після 12 місяців терапії |
|||
|
Параметр терапії |
Група терапії |
Різниця LSM (95 % ДІ) |
|
|
Соматрогон (N = 109) |
Соматропін (N = 115) |
||
|
Оцінка LSM |
Оцінка LSM |
||
|
Швидкість росту (см/рік) |
10,10 |
9,78 |
0,33 (–0,24; 0,89) |
|
Індекс стандартного відхилення зросту |
–1,94 |
–1,99 |
0,05 (–0,06; 0,16) |
|
Зміна індексу стандартного відхилення зросту порівняно з початком дослідження |
0,92 |
0,87 |
0,05 (–0,06; 0,16) |
|
Скорочення: ДІ — довірчий інтервал; ДГР — дефіцит гормону росту; LSM — середнє значення, обчислене методом найменших квадратів (Least Square Mean); N — кількість пацієнтів, які були рандомізовані та отримали терапію. |
|||
У відкритому продовженні опорного дослідження фази 3 загалом 91 пацієнту вводили соматрогон у дозі 0,66 мг/кг/тиждень щонайменше протягом 2 років і збирали дані щодо зросту. Через 2 роки спостерігалося швидке збільшення SDS зросту від вихідного рівня (сукупна зміна середнього значення SDS зросту (SD) дорівнювала 1,38 (0,78), медіана становила 1,19 (діапазон: від 0,2 до 4,9)).
У багатоцентровому дослідженні фази 2 для вивчення безпеки та визначення дози 31 пацієнт отримував соматрогон у дозах до 0,66 мг/кг/тиждень протягом 7,7 року. Під час останньої оцінки SDS зросту (середнє значення (SD)) становило –0,39 (0,95), а кумулятивна зміна SDS швидкості росту (середнє значення (SD)) від вихідного рівня становила 3,37 (1,27).
Тягар лікування
У рандомізованому відкритому перехресному дослідженні фази 3 за участю 87 дітей із ДГР порівнювали труднощі при терапії соматрогоном, який вводили один раз на тиждень (0,66 мг/кг/тиждень), та при щоденному застосуванні соматропіну. У групі введення соматрогону один раз на тиждень спостерігали значне полегшення (зменшення труднощів) терапії для пацієнта, полегшення (зменшення труднощів) терапії для особи, що здійснює догляд, більшу зручність для пацієнта, більший намір дотримуватися режиму лікування та більші переваги для пацієнта.
Пацієнти дитячого віку
Європейське агентство з лікарських засобів скасувало зобов’язання надавати результати досліджень препарату Енженла в усіх педіатричних підгрупах пацієнтів, який застосовували для тривалого лікування дітей із порушенням росту внаслідок недостатньої секреції гормону росту (див. розділ «Спосіб застосування та дози»).
Фармакокінетика
Фармакокінетику (ФК) соматрогону оцінювали з використанням популяційного підходу в 42 дітей (віковий діапазон від 3 до 15,5 року) з ДГР.
Всмоктування
Після підшкірної ін’єкції концентрація соматрогону в сироватці крові підвищувалася повільно, досягаючи піка через 6–18 годин після введення препарату.
У дітей з ДГР експозиція соматрогону збільшується пропорційно дозі при застосуванні доз 0,25 мг/кг/тиждень, 0,48 мг/кг/тиждень і 0,66 мг/кг/тиждень. Після введення один раз на тиждень соматрогон не накопичується в організмі. У дітей з ДГР пікова рівноважна концентрація, визначена за допомогою популяційного дослідження ФК, становила 636 нг/мл після застосування дози 0,66 мг/кг/тиждень. Пацієнти з позитивним результатом аналізу на АЛЗ мали приблизно на 45 % вищу рівноважну середню концентрацію.
Розподіл
У дітей з ДГР уявний центральний об’єм розподілу, оцінений у популяційному дослідженні ФК, становив 0,728 л/кг, а уявний периферичний об’єм розподілу — 0,165 л/кг.
Біотрансформація
Вважається, що метаболізм соматрогону полягає в класичному білковому катаболізмі з подальшим відновленням амінокислот і поверненням до системного кровообігу.
Виведення
У пацієнтів дитячого віку з ДГР уявний кліренс, оцінений у популяційному дослідженні ФК, становив 0,0317 л/год/кг. Пацієнти з позитивними результатами аналізу на АЛЗ мали приблизно на 25,8 % нижчий уявний кліренс.
У разі оціненого у популяційному дослідженні ФК ефективного періоду напіввиведення, що становить 28,2 години, соматрогон буде присутній у кровообігу протягом приблизно 6 днів після останнього введення.
Особливі групи пацієнтів
Вік, раса, стать, маса тіла
Згідно з популяційним ФК аналізом, вік, стать, раса та етнічна приналежність пацієнта не мають клінічно значущого впливу на фармакокінетику соматрогону в пацієнтів дитячого віку з ДГР. Експозиція соматрогону зменшується зі збільшенням маси тіла. Однак доза соматрогону 0,66 мг/кг/тиждень забезпечує адекватну системну експозицію для безпечного досягнення ефективності в діапазоні маси тіла, оціненому в клінічних дослідженнях.
Доклінічні дані щодо безпеки препарату
Доклінічні дані, отримані в стандартних фармакологічних дослідженнях безпеки та дослідженнях токсичності багаторазових доз, свідчать про відсутність особливої небезпеки для людини.
Дослідження репродуктивної токсичності та токсичності для розвитку проводили на щурах, яким підшкірно вводили соматрогон в дозах до 30 мг/кг (що еквівалентні рівням експозиції, які приблизно в 14 разів перевищують такі (за показником AUC) при застосуванні максимальної рекомендованої дози для людини).
Соматрогон збільшував тривалість естрального циклу, копулятивного інтервалу й кількості жовтих тіл у самиць щурів, але не впливав на показники спарювання, фертильність і ранній ембріональний розвиток.
Не спостерігалося впливу соматрогону на розвиток ембріонів і плодів.
У дослідженні пренатального та постнатального розвитку соматрогон збільшував середню масу тіла дитинчат першого покоління (F1) (обох статей), а також збільшував середній копулятивний інтервал у самиць F1 після введення найвищої дози (30 мг/кг). Ці зміни узгоджувалися з більшою тривалістю естрального циклу, однак не спостерігався пов’язаний зі змінами вплив на показники спарювання.
Клінічні характеристики
Показання
Препарат Енженла показаний для лікування дітей та підлітків віком від 3 років із порушенням росту внаслідок недостатньої секреції гормону росту.
Протипоказання
Гіперчутливість до соматрогону (див. розділ «Особливості застосування») або будь-якої допоміжної речовини, що входить до складу лікарського засобу.
Соматрогон не можна застосовувати за наявності ознак активності пухлини на основі досвіду щоденного застосування препаратів гормону росту. Внутрішньочерепні пухлини повинні бути неактивними, а протипухлинна терапія має бути завершена до початку лікуванням гормоном росту (ГР). Терапію слід припинити, якщо є ознаки росту пухлини (див. розділ «Особливості застосування»).
Соматрогон не можна застосовувати для стимуляції росту в дітей із закритими епіфізами.
Пацієнтам із гострими критичними захворюваннями, які мають ускладнення після операції на відкритому серці, операції на черевній порожнині, численних травм унаслідок нещасного випадку, гостру дихальну недостатність або подібні стани, не можна призначати соматрогон (щодо пацієнтів, які проходять замісну терапію, див. розділ «Особливості застосування»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Дослідження взаємодії за участю дітей не проводилися.
Глюкокортикоїди
Одночасне лікування глюкокортикоїдами може пригнічувати ефект стимуляції росту соматрогоном. У пацієнтів із дефіцитом адренокортикотропного гормону (АКТГ) слід ретельно коригувати замісну терапію глюкокортикоїдами, щоб уникнути пригнічення росту. Таким чином, необхідно ретельно контролювати зріст пацієнтів, які отримують глюкокортикоїди, щоб оцінити потенційний вплив лікування глюкокортикоїдами на ріст.
Гормон росту знижує перетворення кортизону на кортизол і може виявляти раніше не діагностований центральний гіпоадреналізм або призвести до неефективності низьких замісних доз глюкокортикоїдів (див. розділ «Особливості застосування»).
Інсулін і гіпоглікемічні лікарські засоби
Пацієнтам із цукровим діабетом, які потребують фармакологічної терапії, може бути необхідне коригування дози інсуліну та (або) пероральних чи ін’єкційних гіпоглікемічних препаратів на початку лікування соматрогоном (див. розділ «Особливості застосування»).
Препарати гормонів щитоподібної залози
Лікування зі щоденним застосуванням гормону росту може виявляти раніше не діагностований або субклінічний центральний гіпотиреоз. Може виникнути потреба в призначенні замісної терапії тироксином або її коригуванні (див. розділ «Особливості застосування»).
Пероральна терапія естрогенами
Пацієнткам, які отримують пероральну терапію естрогенами, для досягнення мети лікування може бути потрібна більша доза соматрогону (див. розділ «Особливості застосування»).
Препарати, які метаболізуються цитохромом P450
Дослідження взаємодії лікарських засобів із застосуванням соматрогону не проводилися. Було показано, що соматрогон індукує експресію мРНК CYP3A4 in vitro. Клінічна значущість результатів цього спостереження невідома. Дослідження інших агоністів рецепторів гормону росту людини, проведені за участю дітей і дорослих із дефіцитом гормону росту, а також здорових чоловіків літнього віку, свідчать про те, що застосування цих препаратів може збільшити кліренс сполук, які, як відомо, метаболізуються ізоферментами цитохрому P450, зокрема CYP3A. Кліренс сполук, що метаболізуються CYP3A4 (наприклад статевих стероїдів, кортикостероїдів, протисудомних засобів і циклоспорину), може бути підвищений, що може призвести до зниження експозиції цих лікарських засобів.
Особливості застосування
Відстеження
Задля покращення відстеження біологічних лікарських засобів слід точно вказувати в документації назву та номер серії препарату, що вводиться.
Гіперчутливість
Повідомлялося про серйозні системні реакції гіперчутливості (наприклад анафілаксію, ангіоневротичний набряк) при щоденному застосуванні препаратів гормону росту. Якщо виникає серйозна реакція гіперчутливості, слід негайно припинити застосування соматрогону; необхідно відразу розпочати лікування згідно зі стандартами медичної допомоги та спостерігати за станом пацієнта до зникнення ознак і симптомів (див. розділ «Протипоказання»).
Гіпоадреналізм
Згідно з опублікованими даними, пацієнти, які щоденно отримують терапію гормоном росту й мають дефіцит певного гормону (-ів) гіпофіза або ризик розвитку такого дефіциту, можуть мати ризик зниження рівня кортизолу в сироватці крові та (або) маніфестації центрального (вторинного) гіпоадреналізму. Крім того, пацієнти, які отримують замісну терапію глюкокортикоїдами з приводу раніше діагностованого гіпоадреналізму, можуть потребувати збільшення підтримувальної або стресової дози після початку лікування соматрогоном (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). Слід стежити за станом пацієнтів щодо зниження рівня кортизолу в сироватці крові та (або) необхідності підвищення дози глюкокортикоїдів для пацієнтів із діагностованим гіпоадреналізмом (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Порушення функції щитоподібної залози
Гормон росту посилює екстратиреоїдне перетворення T4 в T3 та може викрити початкову стадію гіпотиреозу. Пацієнти з наявним гіпотиреозом повинні отримати належне лікування перед початком терапії соматрогоном згідно з результатами клінічного обстеження. Оскільки гіпотиреоз впливає на відповідь організму на терапію гормоном росту, пацієнтам необхідно регулярно перевіряти функцію щитоподібної залози та отримувати замісну терапію гормонами щитовидної залози, якщо є показання (див. розділи «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Побічні реакції»).
Синдром Прадера–Віллі
Застосування соматрогону пацієнтам із синдромом Прадера – Віллі не досліджувалося. Соматрогон не показаний для тривалого лікування пацієнтів дитячого віку із затримкою росту через генетично підтверджений синдром Прадера – Віллі, крім випадків, коли у них також діагностовано ДГР. Надходили повідомлення про раптові летальні наслідки після початку терапії гормоном росту в дітей із синдромом Прадера – Віллі, які мали один або кілька факторів ризику: тяжке ожиріння, обструкцію верхніх дихальних шляхів чи апное уві сні в анамнезі або невстановлену респіраторну інфекцію.
Порушення обміну глюкози
Лікування препаратами гормону росту може знизити чутливість до інсуліну та спричинити гіперглікемію. Необхідно розглянути можливість додаткового контролю за станом пацієнтів, які отримують терапію соматрогоном і мають порушення толерантності до глюкози або додаткові фактори ризику розвитку цукрового діабету. Для пацієнтів з цукровим діабетом, які отримують лікування соматрогоном, може бути необхідним коригування доз гіпоглікемічних препаратів (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Новоутворення
У разі лікування пацієнтів зі злоякісними захворюваннями в анамнезі слід приділяти особливу увагу ознакам і симптомам рецидиву. Пацієнти з наявними пухлинами або вторинним дефіцитом гормону росту внаслідок внутрішньочерепного утворення повинні проходити регулярне обстеження щодо прогресування або рецидиву основного захворювання. У пацієнтів, які хворіли на рак у дитинстві, повідомлялося про підвищений ризик розвитку другого новоутворення в разі лікування соматропіном після першого новоутворення. Внутрішньочерепні пухлини, зокрема менінгіоми, у пацієнтів, які отримували лікування опроміненням голови з приводу першого новоутворення, були найпоширенішими із цих других новоутворень.
Доброякісна внутрішньочерепна гіпертензія
Повідомлялося про внутрішньочерепну гіпертензію (ВГ) із набряком диска зорового нерва, атаксією, порушеннями зору, головним болем, нудотою та (або) блюванням у невеликої кількості пацієнтів, які отримували терапію препаратами гормону росту. На початку лікування та за клінічними показаннями рекомендовано обстеження очного дна. Слід тимчасово припинити застосування соматрогону пацієнтам із клінічними або фундоскопічними ознаками ВГ. Наразі недостатньо доказів, щоб дати конкретні поради щодо продовження лікування гормоном росту після зникнення проявів ВГ. У разі поновлення терапії соматрогоном необхідний моніторинг щодо ознак і симптомів ВГ.
Гостре критичне захворювання
У тяжкохворих дорослих пацієнтів з ускладненнями після операції на відкритому серці, операції на черевній порожнині, після множинних травм унаслідок нещасного випадку або з гострою дихальною недостатністю смертність була вищою серед осіб, які отримували соматропін у дозі 5,3 або 8 мг на добу (тобто 37,1–56 мг/тиждень), порівняно з тими, хто отримував плацебо, 42 % порівняно з 19 %. З огляду на наведену інформацію цих пацієнтів не слід лікувати соматрогоном. Оскільки немає доступної інформації про безпеку замісної терапії гормоном росту для пацієнтів із гострими критичними захворюваннями, переваги продовження лікування соматрогоном у цій ситуації слід порівняти з потенційними ризиками. Для всіх пацієнтів, у яких розвивається інше або подібне гостре критичне захворювання, можливу користь від лікування соматрогоном необхідно розглядати порівняно з потенційним ризиком.
Панкреатит
Хоча панкреатит рідко зустрічається в пацієнтів, які отримують препарати гормону росту, цей діагноз слід розглядати, якщо під час лікування соматрогоном виникає сильний біль у животі.
Сколіоз
Оскільки соматрогон збільшує швидкість росту, під час лікування слід відстежувати ознаки розвитку або прогресування сколіозу.
Порушення з боку епіфізів
Порушення з боку епіфізів, зокрема епіфізеоліз головки стегнової кістки, можуть виникати частіше в пацієнтів із розладами з боку ендокринної системи або зі швидким ростом. Необхідно ретельно обстежити будь-яку дитину, в якої під час лікування з’явилася кульгавість або скарги на біль у стегні чи коліні.
Пероральна терапія естрогенами
Пероральний естроген впливає на відповідь ІФР-1 на гормон росту. Якщо пацієнтка, яка застосовує соматрогон, починає або припиняє пероральну терапію естрогенами, слід контролювати концентрацію ІФР-1, щоб визначити, чи необхідно коригувати дозу гормону росту для підтримки концентрації ІФР-1 у сироватці крові в межах норми (див. розділ «Спосіб застосування та дози»). Пацієнткам, які отримують пероральну терапію естрогенами, для досягнення мети лікування може бути потрібна більша доза соматрогону (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Допоміжні речовини
Вміст натрію
Цей лікарський засіб містить менш ніж 1 ммоль (23 мг) натрію на одну дозу, тобто практично не містить натрію.
Міозит — це дуже рідкісна побічна реакція, що може бути пов’язана з консервантом метакрезолом. У разі виникнення міалгії або занадто сильного болю в місці ін’єкції слід розглянути діагноз міозиту. Якщо він підтверджений, потрібно застосовувати препарати гормону росту, які не містять метакрезолу.
Застосування у період вагітності або годування груддю
Вагітність
Дані щодо застосування соматрогону вагітним відсутні. Результати досліджень на тваринах свідчать про відсутність прямого чи опосередкованого шкідливого впливу на репродуктивну функцію (див. розділ «Доклінічні дані щодо безпеки препарату»).
Препарат Енженла не рекомендується призначати вагітним та жінкам репродуктивного віку, які не використовують засоби для контрацепції.
Годування груддю
Невідомо, чи виділяється соматрогон або його метаболіти у грудне молоко людини. Ризик для новонароджених і немовлят не може бути виключений. Рішення щодо припинення годування груддю або припинення чи утримання від терапії соматрогоном слід ухвалювати з урахуванням користі від годування груддю для дитини й користі лікування для матері.
Репродуктивна функція
Ризик безпліддя в жінок або чоловіків із репродуктивним потенціалом не досліджувався. У дослідженні на щурах не було порушень репродуктивної функції в самців і самиць (див. розділ «Доклінічні дані щодо безпеки препарату»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Енженла не впливає або майже не впливає на швидкість реакції під час керування автотранспортом або іншими механізмами.
Спосіб застосування та дози
Терапію повинні розпочинати та контролювати лікарі, які мають відповідну кваліфікацію та досвід діагностики і лікування дітей з дефіцитом гормону росту (ДГР).
Дози
Рекомендована доза становить 0,66 мг/кг маси тіла і вводиться один раз на тиждень шляхом підшкірної ін’єкції.
За допомогою кожної попередньо наповненої ручки можна встановити та ввести дозу, призначену лікарем. Дозу можна округлити в більшу або меншу сторону на розсуд лікаря, обізнаного щодо індивідуальних потреб пацієнта. Якщо потрібні дози понад 30 мг (тобто маса тіла пацієнта перевищує 45 кг), слід зробити дві ін’єкції.
Початкова доза для пацієнтів, які переходять на лікування соматрогоном зі щоденного застосування препаратів гормону росту
Пацієнтам, які переходять із щоденного застосування препаратів гормону росту на лікування соматрогоном із введенням один раз на тиждень, нову схему терапії можна розпочинати з дози 0,66 мг/кг/тиждень наступного дня після останньої щоденної ін’єкції.
Титрування дози
У разі необхідності дозу соматрогону можна коригувати залежно від швидкості росту, побічних реакцій, маси тіла пацієнта й концентрації інсуліноподібного фактора росту 1 (ІФР-1) у сироватці крові.
Під час моніторингу концентрації ІФР-1 зразки слід завжди брати через 4 дні після введення попередньої дози. Корекція дози має бути спрямована на досягнення середнього індексу стандартного відхилення (Standard Deviation Score, SDS) концентрації ІФР-1 у нормальному діапазоні, тобто від –2 до +2 (бажано близько 0 SDS).
Для пацієнтів, у яких концентрація ІФР-1 у сироватці крові перевищує середнє референтне значення для їхнього віку й статі більш ніж на 2 SDS, дозу соматрогону слід зменшити на 15 %. Для деяких пацієнтів може бути необхідно декілька знижень дози.
Оцінювання та припинення лікування
Ефективність і безпеку лікування соматрогоном слід оцінювати з інтервалом приблизно в 6–12 місяців. Для цього можна розглядати ауксологічні параметри, біохімічні показники (концентрації ІФР-1, гормонів, глюкози) і пубертатний статус. Рекомендований регулярний моніторинг індексів SDS сироваткового ІФР-1 протягом усього курсу лікування. У пубертатний період оцінювання слід проводити частіше.
Лікування потрібно припинити, якщо є ознаки закриття епіфізарних пластинок росту (див. розділ «Протипоказання»). Також слід припинити терапію пацієнтів, які досягли кінцевого або майже кінцевого зросту, тобто річної швидкості росту менш ніж 2 см/рік або кісткового віку понад 14 років у дівчат і понад 16 років у хлопців.
Пропуск дози
Пацієнти повинні дотримуватися свого звичайного дня застосування препарату. У разі пропуску дози соматрогон слід ввести якомога скоріше протягом 3 днів після пропуску дози, а потім відновити звичайний графік дозування один раз на тиждень. Якщо минуло більш ніж 3 дні, слід проігнорувати пропущену дозу та ввести чергову дозу в запланований день. У будь-якому разі пацієнти можуть відновити свій звичайний графік дозування один раз на тиждень.
Зміна дня застосування препарату
День щотижневого введення можна змінити, якщо необхідно, але проміжок між двома дозами повинен становити принаймні 3 дні. Після вибору нового дня введення слід продовжувати застосування препарату один раз на тиждень.
Особливі групи пацієнтів
Пацієнти літнього віку
Безпека та ефективність застосування соматрогону пацієнтам віком понад 65 років не встановлені. Дані відсутні.
Порушення функції нирок
Застосування соматрогону пацієнтам із порушенням функції нирок не досліджувалося. Надати рекомендації щодо дозування не можна.
Порушення функції печінки
Застосування соматрогону пацієнтам із порушенням функції печінки не досліджувалося. Надати рекомендації щодо дозування не можна.
Пацієнти дитячого віку
Безпека та ефективність застосування соматрогону новонародженим, немовлятам і дітям віком до 3 років не встановлені. Дані відсутні.
Спосіб застосування
Соматрогон вводять у вигляді підшкірної ін’єкції.
Соматрогон слід уводити під шкіру живота, стегон, сідниць або плечей. Місце ін’єкції слід змінювати по колу в межах ділянки для кожного введення. Ін’єкції під шкіру плечей та сідниць повинна робити особа, яка доглядає за пацієнтом.
Пацієнт і особа, яка доглядає за ним, повинні пройти навчання, щоб опанувати процедуру введення ін’єкції, для можливості самостійного введення препарату.
Якщо для введення повної дози потрібно кілька ін’єкцій, їх слід робити в різні ділянки тіла.
Соматрогон слід вводити один раз на тиждень, у той самий день кожного тижня, у будь-який час доби.
Енженла, розчин для ін’єкцій у попередньо наповненій ручці, 24 мг.
Попередньо наповненою ручкою можна вводити дози від 0,2 до 12 мг соматрогону з кроком 0,2 мг (0,01 мл).
Енженла, розчин для ін’єкцій у попередньо наповненій ручці, 60 мг.
Попередньо наповненою ручкою можна вводити дози від 0,5 до 30 мг соматрогону з кроком 0,5 мг (0,01 мл).
Особливі застереження щодо поводження з препаратом та утилізації залишків
Розчин повинен бути прозорим, від безбарвного до світло-жовтуватого кольору та не містити часточок. Не вводьте лікарський засіб, якщо він каламутний, темно-жовтий або містить сторонні часточки. Не струшуйте, струшування може пошкодити лікарський засіб.
Кожна попередньо наповнена ручка з препаратом Енженла призначена для використання одним пацієнтом. Попередньо наповнену ручку з препаратом Енженла за будь-яких обставин не можуть використовувати інші особи, навіть у разі зміни голки.
Попередньо наповнену ручку слід використовувати лише протягом 28 днів після першого застосування. Не використовувати після закінчення терміну придатності.
Цей лікарський засіб не можна заморожувати, піддавати впливу тепла (температур вище 32 °C). Якщо лікарський засіб був заморожений або перебував під впливом тепла, його слід утилізувати.
Приготування дози
Ручку можна використовувати відразу після виймання з холодильника. Для комфортнішої ін’єкції попередньо наповнену ручку, що містить стерильний розчин соматрогону, можна нагріти до кімнатної температури не вище 32 °C протягом 30 хвилин. Слід перевіряти розчин у ручці щодо наявності пластівців, часточок і зміни кольору. Ручку не можна струшувати. У разі наявності пластівців, часточок чи зміни кольору ручку не можна використовувати.
Введення
Визначене місце для ін’єкції слід підготувати згідно з інструкціями щодо застосування. Рекомендується змінювати місце ін’єкції по колу в межах ділянки для кожного введення. Під час використання завжди надягайте ковпачок на попередньо наповнену ручку після кожної ін’єкції. Після кожного застосування повертайте препарат Енженла в холодильник. Перед використанням завжди слід прикріплювати нову голку. Голки не можна використовувати повторно. Ін’єкційну голку слід знімати після кожної ін’єкції, а ручку потрібно зберігати без прикріпленої до неї голки. Це допоможе запобігти закупорці голок, забрудненню, інфікуванню, витіканню розчину та неточному дозуванню.
У разі закупорки голки (тобто рідина не з’являється на кінчику голки) пацієнти повинні дотримуватися вказівок, описаних в розділі «Інформація для пацієнта».
Для введення необхідні стерильні голки, які не входять до комплекту пакування. Препарат Енженла можна вводити за допомогою голки розміром від 4 до 8 мм та від 30 до 32G.
Інструкції щодо підготовки та застосування препарату наведені в розділі «Спосіб застосування».
Утилізація
Будь-який невикористаний лікарський засіб і відходи слід утилізувати згідно з місцевими вимогами. Якщо попередньо наповнена ручка порожня, перебувала під впливом температур вище 32 °C чи поза холодильником більш ніж 4 години під час кожного використання, була використана 5 разів або минуло понад 28 днів після першого застосування препарату, її слід утилізувати, навіть якщо вона містить невикористаний препарат. Після правильного введення всіх доз у ручці може залишитися невелика кількість стерильного розчину соматрогону. Пацієнтів слід проінструктувати не застосовувати розчин, що залишився, а належним чином утилізувати ручку.
Інформація для пацієнта
Інструкція щодо використання ручки для ін’єкцій з дозуванням 24 мг або 60 мг
· Енженла для ін’єкцій — це багатодозова попередньо наповнена ручка, що містить 24 мг або 60 мг препарату.
· Препарат Енженла може вводити пацієнт, особа, яка здійснює догляд за пацієнтом, лікар або медсестра. Не можна вводити препарат Енженла самостійно, поки вам не покажуть правильний спосіб введення ін’єкції. Також ви повинні прочитати та зрозуміти інструкції щодо застосування. Якщо ваш лікар або медсестра вирішить, що ви або особа, яка здійснює догляд, можете вводити препарат Енженла вдома, вам слід пройти навчання щодо правильного приготування та введення цього лікарського засобу. Важливо, щоб ви прочитали, зрозуміли й дотримувалися цих інструкцій, щоб правильно вводити препарат Енженла. Важливо поговорити зі своїм лікарем або медсестрою, щоб переконатися, що ви розумієте всі вказівки щодо дозування препарату Енженла.
· Щоб запам’ятати, коли потрібно вводити препарат Енженла, ви можете заздалегідь зробити позначки у своєму календарі. Зателефонуйте своєму лікарю або медсестрі, якщо у вас або особи, яка доглядає за вами, виникнуть запитання щодо правильного способу введення препарату Енженла.
· Кожне обертання (клацання) регулятора дози попередньо наповненої ручки, що містить 24 мг препарату, збільшує дозу на 0,2 мг. За одну ін’єкцію можна вводити від 0,2 до 12 мг. Якщо ваша доза перевищує 12 мг, вам потрібно зробити кілька ін’єкцій.
Кожне обертання (клацання) регулятора дози попередньо наповненої ручки, що містить 60 мг препарату, збільшує дозу на 0,5 мг. За одну ін’єкцію можна вводити від 0,5 до 30 мг. Якщо ваша доза перевищує 30 мг, вам потрібно зробити кілька ін’єкцій.
· Після правильного введення всіх доз у ручці може залишитися невелика кількість препарату. Це нормально. Пацієнти не повинні намагатися використати залишки розчину, слід утилізувати ручку належним чином.
· Не діліться своєю ручкою з іншими людьми, навіть за умови заміни голки. Ви можете передати іншим людям серйозну інфекцію або отримати серйозну інфекцію від них.
· Для кожної ін’єкції завжди використовуйте нову голку. Це зменшить ризик зараження, інфікування, витікання препарату та закупорки голок, яка призводить до введення неправильної дози.
· Не струшуйте ручку. Струшування може пошкодити лікарський засіб.
· Ручку не рекомендовано використовувати сліпим людям або пацієнтам із вадами зору без допомоги особи, яка навчена правильному введенню ін’єкції цього лікарського засобу.
Нижче наведено детальний опис послідовності застосування ручки з дозуванням 24 мг. У разі використання ручки з дозуванням 60 мг потрібно виконувати аналогічні дії.

Зовнішній вигляд ручки та комплектація голки може відрізнятися. Голки для використання Голки для ручок не входять до комплекту пакування Енженла. Ви можете використовувати голки для ручок від 4 до 8 мм та від 30 до 32G. · Наведені нижче голки показані для використання з ручкою Енженла: o 32G (Novo Nordisk®, NovoFine® Plus) o 31G (Novo Nordisk®, NovoFine®) o 31G (Becton Dickinson and Company, BD Ultra-Fine™ or BD Micro-Fine™) · Наведені нижче голки із захисним екраном показані для використання з ручкою Енженла: o 30G (Becton Dickinson and Company, AutoShield Duo™) o 30G (Novo Nordisk®, NovoFine® AutoCover®) · Проконсультуйтесь зі своїм лікарем або медсестрою щодо голки, яка вам потрібна. Стерильна голка (приклад), що не входить до комплекту:
Примітка: голки із захисним екраном не мають внутрішнього ковпачка голки. Кроки 5, 6 і 11 цих інструкцій щодо внутрішнього ковпачка голки можна пропустити при використанні голки із захисним екраном. Зверніться до інструкцій щодо використання голки задля отримання додаткової інформації. Застереження: ніколи не використовуйте зігнуту або пошкоджену голку. Завжди обережно поводьтеся з голками для ручок, щоб не вколоти себе (чи когось іншого) голкою. Не приєднуйте нову голку до ручки, доки не будете готові до ін’єкції. |
Підготовка до ін’єкції
Крок 1. Підготуйтеся
· Вимийте та висушіть руки.
· Ви можете використовувати ручку відразу після виймання з холодильника. Для комфортнішої ін’єкції залиште ручку при кімнатній температурі на 30 хвилин (див. розділ «Умови зберігання»).
· Перевірте назву, концентрацію лікарського засобу та етикетку вашої ручки, щоб переконатися, що це саме той лікарський засіб, який вам призначив лікар.
· Перевірте термін придатності на етикетці ручки. Не використовуйте лікарський засіб, якщо термін придатності закінчився.
· Не використовуйте свою ручку, якщо:
○ її вміст був заморожений чи перебував під впливом тепла (температур вище 32 °C) або минуло більш ніж 28 днів після першого використання ручки (див. розділ «Умови зберігання»);
○ ручка впала;
○ ручка виглядає зламаною або пошкодженою.
· Не знімайте ковпачок з ручки, доки не будете готові до ін’єкції.
Крок 2. Виберіть і очистіть місце для ін’єкції
|
Сідниці: вводить лише особа, яка здійснює догляд |
|
Руки (задня частина плеча): вводить лише особа, яка здійснює догляд |
|
Ділянки на животі: відступайте щонайменше 5 см від пупка |
|
Стегна (передня верхня частина) |
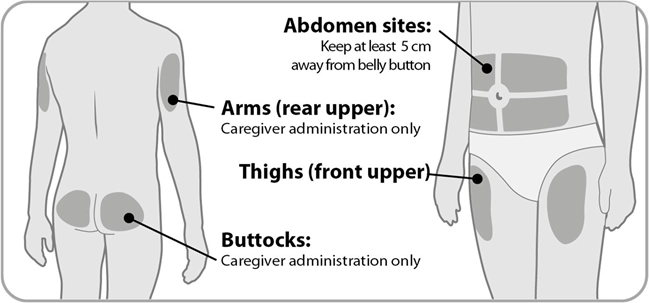
· Препарат Енженла слід вводити під шкіру живота, стегон, сідниць або плечей.
· Виберіть найкраще місце для ін’єкції згідно з рекомендаціями лікаря або медсестри.
· Якщо для введення повної дози необхідно кілька ін’єкцій, їх слід виконати в різні ділянки.
· Уникайте ділянок поблизу кісток або ділянок із синцями, почервоніннями, виразками або ущільненнями, а також з рубцями або ознаками захворювань шкіри.
· Очистіть місце для ін’єкції спиртовою серветкою.
· Дайте цій ділянці висохнути.
· Не торкайтеся місця для ін’єкції після очищення.
Крок 3. Перевірте лікарський засіб
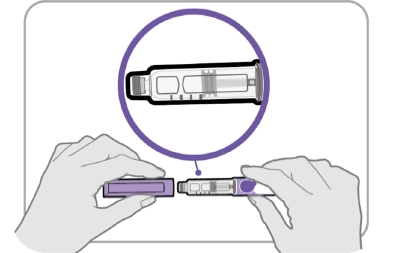
· Зніміть ковпачок ручки та збережіть його, щоб повернути на місце після ін’єкції.
· Перевірте препарат всередині тримача картриджа.
· Переконайтеся, що лікарський засіб прозорий, від безбарвного до світло-жовтуватого кольору. Не вводьте препарат, якщо він каламутний або темно-жовтий.
· Переконайтеся, що в розчині немає пластівців або часточок. Не вводьте препарат, якщо він містить пластівці або часточки.
Примітка. Якщо в препараті є одна або кілька бульбашок, це нормально.
Крок 4. Приєднайте голку

· Візьміть нову голку та зніміть захисний папір.
· Утримуйте голку на одній лінії зі ручкою, тримайте прямо і голку, і ручку.
· Обережно натисніть, а потім прикрутіть голку до ручки.
Не затягуйте надто сильно.
Примітка. Дійте обережно, щоб не прикріпити голку під кутом. Це може спричинити витікання препарату.
Обережно! Голки гострі з обох кінців. Обережно поводьтеся з ними, щоб не вколоти себе (чи когось іншого) голкою.
Крок 5. Зніміть зовнішній футляр голки

· Зніміть зовнішній футляр голки.
· Обов’язково зберігайте зовнішній футляр голки. Він знадобиться вам пізніше, щоб зняти голку.
Примітка. Ви повинні побачити внутрішній футляр голки після зняття зовнішнього футляра. Якщо ви не бачите його, спробуйте знову приєднати голку.
Примітка. Якщо ви використовуєте голку із захисним екраном, зверніться до інструкцій голки щодо її використання.
Крок 6. Зніміть внутрішній ковпачок голки

· Обережно зніміть внутрішній ковпачок голки, щоб відкрити голку.
· Викиньте внутрішній ковпачок голки в контейнер для гострих предметів. Він вам уже не знадобиться.
Примітка. Якщо ви використовуєте голку із захисним екраном, зверніться до інструкцій голки щодо її використання.
|
Це нова ручка? |
|
Так: перейдіть до налаштування нової ручки |
|
Ні |
Налаштування нової ручки (перша підготовка) — лише для першого використання нової ручки
Ви повинні налаштувати (уперше підготувати) кожну нову ручку перед першим використанням.
· Таке налаштування здійснюють перед першим використанням кожної нової ручки.
· Мета налаштування нової ручки — видалити бульбашки повітря та переконатися, що ви отримаєте необхідну дозу.
Важливо! Пропустіть кроки з А до В, якщо ви вже налаштували ручку.
Крок А. Установіть регулятор
|
— 0 |
|
мг |
|
— 0,4 |
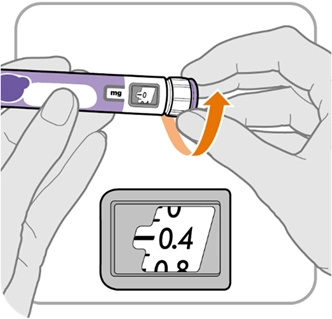
· Покрутіть регулятор дози до 0,4 для ручки з дозуванням 24 мг або до 1,0 для ручки з дозуванням 60 мг.
Примітка. Якщо ви надмірно покрутили регулятор дози, його можна повернути назад.
Крок Б. Постукайте по тримачу картриджа
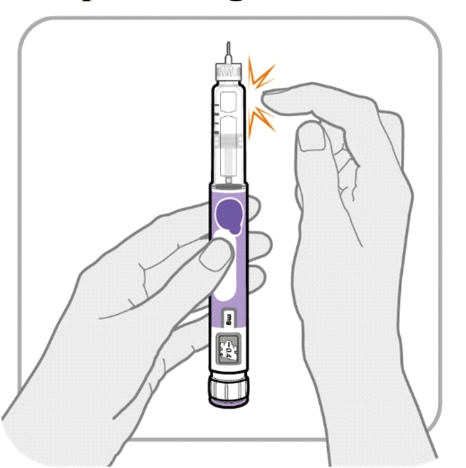
· Тримайте ручку голкою вгору, щоб бульбашки повітря мали змогу підніматися.
· Обережно постукайте по тримачу картриджа, щоб бульбашки повітря спливли вгору.
Важливо! Виконайте крок Б, навіть якщо ви не бачите бульбашок повітря.
Крок В. Натисніть кнопку та перевірте надходження рідини
|
— 0 |
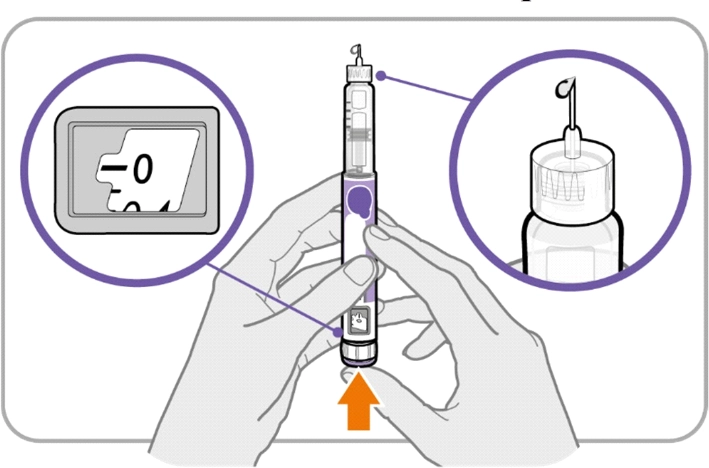
· Натискайте кнопку введення, доки вона не зупиниться, а у вікні дози не з’явиться «0».
· Перевірте наявність рідини на кінчику голки. Якщо з’являється рідина, ваша ручка налаштована.
· Завжди переконуйтеся, що перед ін’єкцією з’являється крапля рідини. Якщо рідина не з’явилася, повторіть кроки від A до В.
○ Якщо рідина не з’являється після того, як ви повторили кроки від A до В п’ять разів, приєднайте нову голку та спробуйте ще один раз.
Не використовуйте ручку, якщо крапля рідини все одно не з’являється. Зверніться до свого лікаря або медсестри та застосовуйте нову ручку.
Налаштування призначеної дози
Крок 7. Оберіть дозу
|
мг |
|
— 0 |
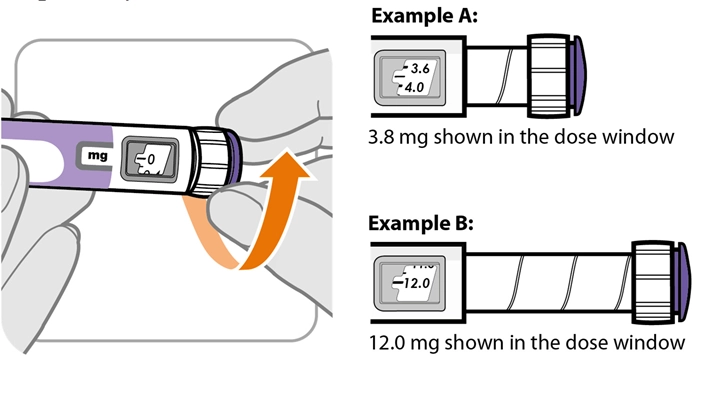
· Поверніть регулятор дози, щоб налаштувати дозу.
○ Дозу можна збільшити або зменшити повертанням регулятора дози в будь-якому напрямку.
○ Регулятор дози обертається на 0,2 мг за один раз для ручки, яка містить 24 мг, або на 0,5 мг за один раз для ручки, яка містить 60 мг.
○ Для ручки, яка містить 24 мг препарату, ви можете встановити дозу лише до 12 мг для однієї ін’єкції; для ручки, яка містить 60 мг препарату, ви можете встановити дозу лише до 30 мг для однієї ін’єкції.
○ Вікно дози показує дозу в міліграмах (мг).
· Завжди перевіряйте вікно дози, щоб переконатися, що ви встановили правильну дозу.
Важливо! Не натискайте кнопку введення під час налаштування дози.
Що робити, якщо я не можу встановити потрібну дозу?
· Якщо ваша доза перевищує 12 мг або 30 мг, вам потрібно зробити кілька ін’єкцій.
· За одну ін’єкцію можна вводити від 0,2 до 12 мг ручкою, яка містить 24 мг, або від 0,5 до 30 мг ручкою, яка містить 60 мг.
○ Якщо вам потрібна допомога, щоб правильно розподілити дозу, зверніться до свого лікаря або медсестри.
○ Для кожної ін’єкції використовуйте нову голку (див. «Крок 4. Приєднайте голку»).
○ Якщо зазвичай ви потребуєте 2 ін’єкцій, щоб отримати повну дозу, обов’язково введіть другу дозу.
Що робити, якщо в ручці залишилося недостатньо препарату?
· Якщо ваша ручка містить менш ніж 12 мг або 30 мг препарату, регулятор дози зупиниться, а кількість препарату, що залишилася, відобразиться у вікні дози.
· Якщо у вашій ручці недостатньо препарату для введення повної дози, ви можете:
○ ввести кількість, що залишилась у вашій ручці, а потім підготувати нову ручку, щоб отримати повну дозу.
Не забудьте відняти дозу, яку ви вже ввели.
Наприклад, якщо доза становить 3,8 мг і ви можете встановити регулятор дози лише на 1,8 мг, вам слід увести ще 2,0 мг новою ручкою. Або, якщо доза становить 21,5 мг і ви можете встановити регулятор дози лише на 17 мг, вам слід увести ще 4,5 мг новою ручкою.
○ взяти нову ручку та ввести повну дозу.
Введення дози
Крок 8. Введіть голку
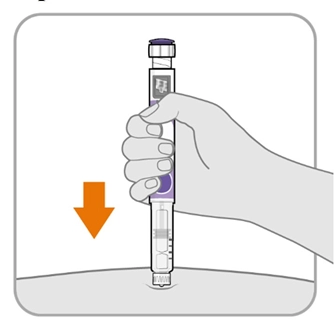
· Тримайте ручку так, щоб ви могли бачити цифри у вікні дози.
· Введіть голку безпосередньо в шкіру.
Крок 9. Введіть препарат
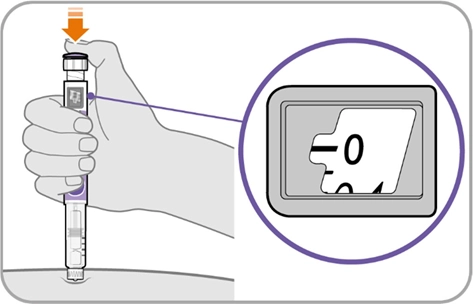
· Продовжуйте тримати голку в тому ж положенні в шкірі.
· Натискайте кнопку введення, доки вона не зупиниться, а у вікні дози не з’явиться «0».
Крок 10. Порахуйте до 10
|
Порахуйте до 10 |
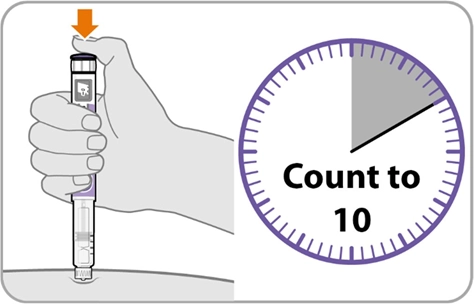
· Продовжуйте натискати кнопку введення, рахуючи до 10. Це дасть вам змогу отримати повну дозу препарату.
· Коли ви порахували до 10, відпустіть кнопку введення та повільно вийміть ручку з місця ін’єкції, витягнувши голку прямо назовні.
Примітка. Ви можете побачити краплю препарату на кінчику голки. Це нормально й не впливає на щойно отриману дозу.
Крок 11. Надіньте зовнішній футляр голки
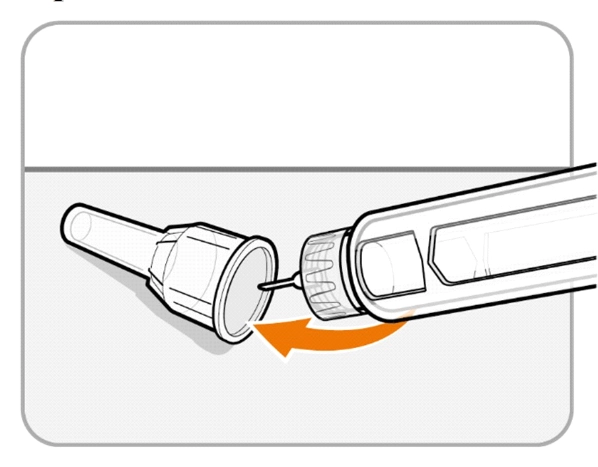
· Обережно надіньте зовнішній футляр голки назад на голку.
· Натискайте на зовнішній футляр голки, доки він не зафіксується.
Обережно! Ніколи не намагайтеся надіти внутрішній футляр голки назад на голку. Ви можете вколотися голкою.
Примітка. Якщо ви використовуєте голку із захисним екраном, зверніться до інструкцій голки щодо її використання.
Крок 12. Зніміть голку
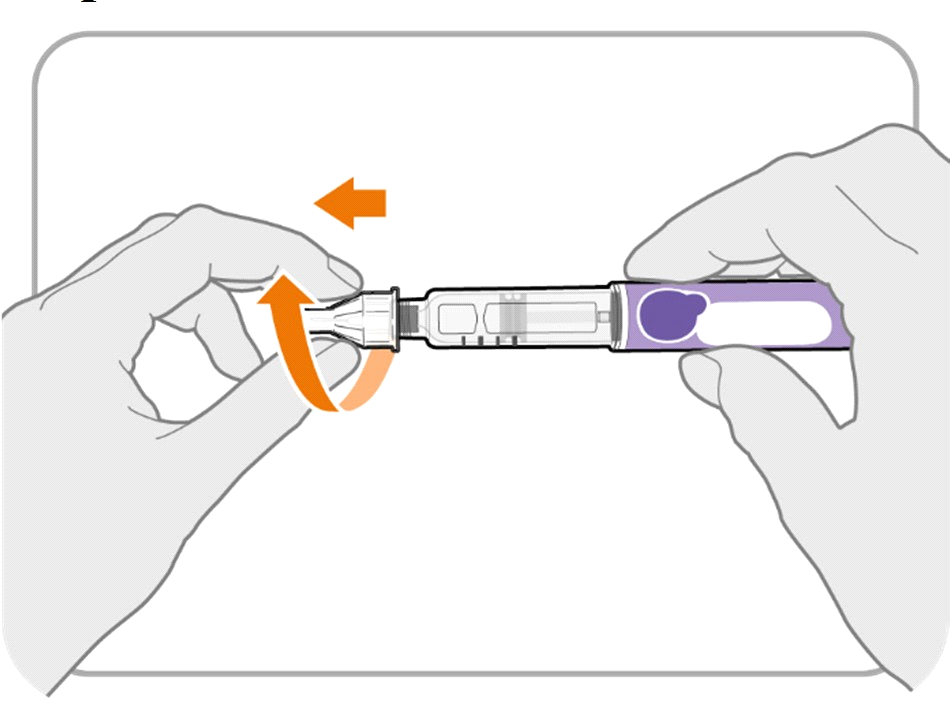
· Викрутіть голку з футляром з ручки.
· Обережно потягніть, поки голка з футляром не зніметься.
Примітка. Якщо голка все ще не знята, замініть зовнішній футляр голки й повторіть спробу. Під час відкручування голки необхідно застосовувати тиск.
Утилізуйте використані голки для ручок у контейнер для гострих предметів згідно з інструкціями лікаря, медсестри або фармацевта та згідно з місцевими законами про охорону здоров’я та безпеку. Зберігайте контейнер для гострих предметів у недоступному для дітей місці. Не використовуйте голки повторно.
Крок 13. Надіньте ковпачок на ручку
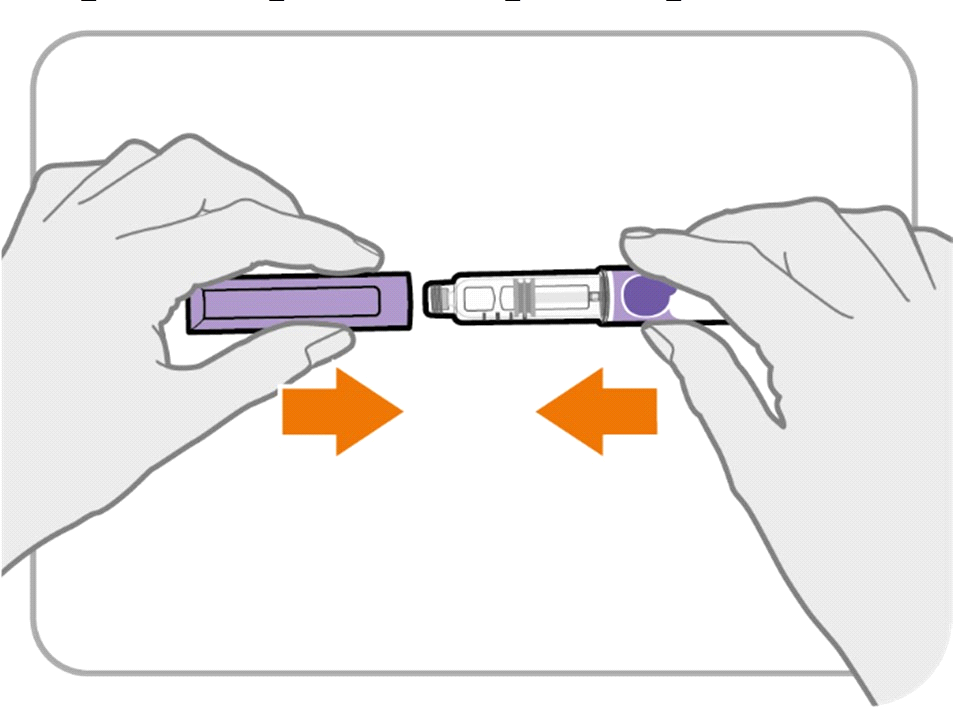
· Надіньте ковпачок назад на ручку.
· Не надягайте ковпачок на ручку з прикріпленою до неї голкою.
· Якщо у вашій ручці залишився препарат, зберігайте її в холодильнику між застосуваннями (див. розділ «Умови зберігання»).
Крок 14. Після ін’єкції
· Злегка натисніть на місце ін’єкції чистою ватною кулькою або марлевим диском і потримайте кілька секунд.
· Не тріть місце ін’єкції. У вас може з’явитися невелика кількість крові в цьому місці. Це нормально.
· У разі потреби ви можете накласти невеликий пластир на місце ін’єкції.
· Якщо ваша ручка порожня або минуло більш ніж 28 днів після першого застосування, утилізуйте її, навіть якщо вона містить невикористаний препарат. Утилізуйте її в контейнер для гострих предметів.
· Щоб запам’ятати, коли потрібно утилізувати ручку, ви можете написати дату першого застосування на етикетці ручки й нижче:
Дата першого застосування / /
Діти
Препарат можна застосовувати у педіатричній практиці.
Передозування
Разове застосування соматрогону в дозах понад 0,66 мг/кг/тиждень не досліджували. З огляду на досвід щоденного застосування препаратів, що містять гормон росту, короткочасне передозування може призвести спочатку до гіпоглікемії, а згодом до гіперглікемії. Тривале передозування може спричинити ознаки та симптоми гігантизму та (або) акромегалії, що узгоджується з наслідками надлишку гормону росту.
Лікування передозування соматрогоном має складатись із загальних підтримуючих заходів.
Побічні реакції
Резюме профілю безпеки
Найпоширенішими побічними реакціями після лікування соматрогоном є реакції в місці ін’єкції (РМІ) (25,1 %), головний біль (10,7 %) і пірексія (10,2 %).
Список побічних реакцій
Дані щодо безпеки отримано в багатоцентровому дослідженні безпеки та визначення дози фази 2, а також в опорному багатоцентровому дослідженні не меншої ефективності фази 3 у пацієнтів дитячого віку з ДГР (див. розділ «Фармакодинаміка»). Дані відображають застосування соматрогону один раз на тиждень (0,66 мг/кг/тиждень) для лікування 265 пацієнтів.
Нижче поданий перелік побічних реакцій на соматрогон за системно-органними класами за загальноприйнятими категоріями частоти виникнення: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто (від ≥ 1/1000 до < 1/100), рідко (від ≥ 1/10 000 до < 1/1000), дуже рідко (< 1/10 000) або частота невідома (не можна оцінити за наявними даними). У кожній групі за частотою побічні реакції перелічені в порядку зниження їхньої серйозності.
Розлади з боку крові та лімфатичної системи. Часто: анемія, еозинофілія.
Розлади з боку ендокринної системи. Часто: гіпотиреоз; нечасто: недостатність кори надниркових залоз.
Розлади з боку нервової системи. Дуже часто: головний біль.
Розлади з боку органів зору. Часто: алергічний кон’юнктивіт.
Розлади з боку шкіри та підшкірної клітковини. Нечасто: генералізований висип.
Розлади з боку опорно-рухового апарату та сполучної тканини. Часто: артралгія; біль у кінцівках.
Загальні розлади та реакції в місці введення. Дуже часто: реакції в місці введенняа; пірексія.
|
а Реакціями в місці ін’єкції можуть бути біль, еритема, свербіж, набряк, ущільнення, синці, кровотеча, підвищення температури шкіри, гіпертрофія, запалення, деформація, кропив’янка в місці ін’єкції. |
Опис окремих побічних реакцій
Реакція в місці ін’єкції
У клінічному дослідженні фази 3 повідомлення про РМІ були активно запитуваними протягом усього дослідження. У більшості випадків місцеві РМІ були тимчасовими, виникали переважно протягом перших 6 місяців терапії та були легкими за ступенем тяжкості; РМІ зазвичай виникали в день ін’єкції та їхня середня тривалість не перевищувала 1 дня. Серед них біль, еритема, свербіж, набряк, ущільнення, синці, гіпертрофія, запалення та підвищення температури шкіри в місці ін’єкції спостерігалися в 43,1 % пацієнтів, які отримували терапію соматрогоном, порівняно з 25,2 % пацієнтів, які отримували щоденні ін’єкції соматропіну.
У довгостроковому відкритому продовженні клінічного дослідження фази 3 місцеві РМІ були подібними за характером і тяжкістю. Про них повідомляли на початку терапії в пацієнтів, які переходили з лікування соматропіном на застосування соматрогону. РМІ були зареєстровані у 18,3 % пацієнтів, які спочатку отримували соматрогон в основному дослідженні й не припиняли лікування в продовженні дослідження, і, аналогічно, 37 % були зареєстровані в пацієнтів, які спочатку отримували соматропін і були переведені в продовженні дослідження на терапію соматрогоном.
Імуногенність
В опорному дослідженні безпеки та ефективності зі 109 пацієнтів, які отримували соматрогон, у 84 (77,1 %) був позитивний результат аналізу на антитіла до лікарського засобу (АЛЗ). Не спостерігалося клінічних ефектів або впливу на безпеку після утворення антитіл.
Інші побічні реакції на соматропін можна вважати ефектами, притаманними загалом цьому класу препаратів, зокрема:
· доброякісні та злоякісні новоутворення (див. розділ «Особливості застосування»);
· метаболічні та аліментарні розлади: цукровий діабет 2-го типу (див. розділ «Особливості застосування»);
· розлади з боку нервової системи: доброякісна внутрішньочерепна гіпертензія (див. розділ «Особливості застосування»), парестезія;
· розлади з боку опорно-рухового апарату, сполучної тканини та кісток: міалгія;
· розлади з боку репродуктивної системи та молочних залоз: гінекомастія;
· розлади з боку шкіри та підшкірної клітковини: шкірний висип, кропив’янка та свербіж;
· загальні розлади та реакції в місці введення: периферичний набряк, набряк обличчя;
· розлади з боку шлунково-кишкового тракту: панкреатит (див. розділ «Особливості застосування»).
Метакрезол
Цей лікарський засіб містить метакрезол, що може спричинити болісні відчуття під час ін’єкцій (див. розділ «Особливості застосування»).
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутність ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності. 3 роки.
Умови зберігання.
Зберігати у недоступному для дітей місці.
Перед першим застосуванням зберігати в холодильнику (від 2 до 8 °C). Невідкриту ручку можна тимчасово зберігати до 4 годин при температурі до 32 °C.
Після першого застосування термін зберігання 28 днів. Зберігати в холодильнику (від 2 до 8 °C). Не заморожувати. Зберігайте препарат у ручці з надягненим ковпачком для захисту від світла.
Лікарський засіб Енженла можна тримати при кімнатній температурі (до 32 °C) до 4 годин під час кожної ін’єкції максимум 5 разів. Після кожного застосування повертайте ручку з препаратом Енженла в холодильник. Запобігайте впливу температур понад 32 °C та не залишайте лікарський засіб за кімнатної температури більш ніж на 4 години під час кожного використання.
Ручку з лікарським засобом Енженла слід утилізувати, якщо її використали 5 разів, якщо вона перебувала під впливом температур понад 32 °C або якщо її виймали з холодильника більш ніж на 4 години під час кожного використання.
Несумісність.
Оскільки дослідження несумісності не проводилися, цей препарат заборонено змішувати з іншими лікарськими засобами.
Упаковка.
1 попередньо наповнена ручка, що містить картридж, у картонній коробці.
Категорія відпуску. за рецептом.
Виробник.
Пфайзер Менюфекчуринг Бельгія НВ.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Рейксвег 12, Пуурс-Сінт-Амандс, 2870, Бельгія.
