ІКАТІБАНТ-ВІСТА
-
Англія Містрал Кепітал Менеджмент ЛімітедDosage form: розчин для ін'єкцій, 30 мг/3 мл; по 3 мл у попередньо наповненому шприці, по 1 або 3 шприца в пачціComposition: 1 попередньо наповнений шприц (3 мл) містить ікатібанту ацетат еквівалентно ікатібанту 30 мгMedicinal dispensing terms: за рецептомСertificate number: UA/20439/01/01ATS code: B06AC02Expiry: 2 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ІКАТІБАНТ-ВІСТА
(ICATIBANT-VISTA)
Склад:
діюча речовина: ікатібанту ацетат;
1 попередньо наповнений шприц (3 мл) містить ікатібанту ацетат еквівалентно ікатібанту 30 мг:
допоміжні речовини: натрію хлорид, льодяна оцтова кислота, натрію гідроксид, вода для ін’єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий безбарвний розчин у скляному шприці об’ємом 3 мл, вільний від видимих частинок.
Фармакотерапевтична група. Інші гематологічні засоби, препарати для лікування спадкового ангіоневротичного набряку. Код АТХ B06A C02.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії.
Спадковий ангіоневротичний набряк (САН) – аутосомно-домінантне захворювання, яке викликається відсутністю або дисфункцією інгібітора С1-естрази. Напади САН супроводжуються підвищеним викидом брадикініну, який є ключовим медіатором у розвитку клінічних симптомів.
САН проявляється періодичними нападами підшкірного та/або підслизового набряку зі залученням верхніх дихальних шляхів, шкіри та шлунково-кишкового тракту. Напад зазвичай триває від 2 до 5 днів.
Ікатібант є селективним конкурентним антагоністом рецептора брадикініну типу 2 (В2). Це синтетичний декапептид зі структурою, схожою на брадикінін, який має у своєму складі 5 непротеїногенних амінокислот. При САН підвищення концентрації брадикініну є ключовим медіатором у розвитку клінічних симптомів.
Фармакодинамічні ефекти.
Здоровим молодим добровольцям ікатібант вводили у дозі 0,8 мг/кг протягом 4 годин; 1,5 мг/кг/добу або 0,15 мг/кг/добу застосовували протягом 3 днів, чим попереджали розвиток брадикінін-індукованої гіпотензії, вазодилатації та рефлекторної тахікардії. Доведено, що ікатібант є конкурентним антагоністом при збільшенні брадикініну в 4 рази.
Клінічна ефективність та безпека.
Дані ефективності були отримані з початкового відкритого дослідження фази II і з трьох контрольованих досліджень фази III.
Клінічні дослідження фази III (FAST-1 та FAST-2) були рандомізованими, подвійними сліпими, контрольованими випробуваннями та мали ідентичний дизайн, за винятком препарату порівняння (одне із пероральним застосуванням транексамової кислоти як препарату порівняння та одне плацебо-контрольоване). Загалом 130 пацієнтів були рандомізовані для отримання або ікатібанту в дозі 30 мг (63 пацієнти), або препарату порівняння (транексамової кислоти – 38 пацієнтів або плацебо – 29 пацієнтів). Наступні епізоди САН лікували у відкритий спосіб. Пацієнти зі симптомами ангіоневротичного набряку гортані отримували відкриту терапію ікатібантом. Первинною кінцевою точкою ефективності був час до початку полегшення симптомів за візуальною аналоговою шкалою (ВАШ). У таблиці 1 показано результати ефективності цих досліджень. FAST-3 являло собою рандомізоване плацебо-контрольоване дослідження у паралельних групах за участю 98 дорослих пацієнтів зі середнім віком 36 років. Пацієнти були рандомізовані для отримання ікатібанту 30 мг або плацебо шляхом підшкірної ін'єкції. Частина пацієнтів у цьому дослідженні мала гострі напади САН під час прийому андрогенів, антифібринолітиків або інгібіторів Cl. Первинною кінцевою точкою був час до початку полегшення симптомів, що оцінюється з використанням складової візуальної аналогової шкали з 3 пунктів (ВАШ-3), що складається з оцінок набряку шкіри, шкірного болю і болю в животі. У таблиці 2 показані результати ефективності FAST-3.
У цих дослідженнях у пацієнтів, які застосовували ікатібант, середній час до початку полегшення симптомів був меншим (2,0, 2,5 та 2,0 години відповідно) порівняно з пацієнтами, які застосовували транексамову кислоту (12,0 годин) та плацебо (4,6 та 19,8 години). Лікувальний ефект ікатібанту було підтверджено вторинними кінцевими точками ефективності. У комплексному аналізі цих контрольованих досліджень фази III час до початку усунення симптомів і час до початку усунення первинних симптомів був однаковим незалежно від вікової групи, статі, раси, маси тіла і від того, чи приймали пацієнти андрогени або антифібринолітики.
Відповідь також була послідовною при повторних атаках у контрольованих випробуваннях фази III. Загалом 237 пацієнтів отримали 1386 доз ікатібанту по 30 мг на лікування 1278 нападів гострого САН. У перших 15 пацієнтів із випадками нападів, які застосовували ікатібант (1114 доз на 1030 нападів), середній час до початку полегшення симптомів був подібним для всіх нападів (від 2,0 до 2,5 години). 92,4 % цих нападів САН лікували введенням одноразової дози ікатібанту.
Таблиця 1
Результати ефективності для FAST-1 та FAST-2
|
Контрольоване клінічне дослідження FIRAZYR у порівнянні з транексамовою кислотою або плацебо: результати ефективності. |
||||||
|
FAST-2 |
FAST-1 |
|||||
|
Ікатібант |
Транексамова кислота |
Ікатібант |
Плацебо |
|||
|
Кількість пацієнтів у популяції ITT |
36 |
38 |
Кількість рандомізованих пацієнтів, які отримали не менше однієї дози препарату, що досліджується |
27 |
29 |
|
|
Вихідний рівень ВАШ (мм) |
63,7 |
61,5 |
Вихідний рівень ВАШ (мм) |
69,3 |
67,7 |
|
|
Зміна вихідного рівня на 4 години |
-41,6 |
-14,6 |
Зміна вихідного рівня на 4 години |
- 44,8 |
- 23,5 |
|
|
Різниця між методами лікування (95 % ДІ, p-значення) |
-27,8 (-39,4, -16,2), р < 0,001 |
Різниця між методами лікування (95 % ДІ, p‑значення) |
-23,3 (-37,1, -9,4), р = 0,002 |
|||
|
Зміна вихідного рівня на 12 годин |
- 54,0 |
- 30,3 |
Зміна вихідного рівня на 12 годин |
- 54,2 |
- 42,4 |
|
|
Різниця між методами лікування (95 % ДІ, p-значення) |
-24,1 (-33,6, -14,6), р < 0,001 |
Різниця між методами лікування (95 % ДІ, p‑значення) |
-15,2 (-28,6, -1,7), р = 0,028 |
|||
|
Середній час до початку полегшення симптомів (години) |
Середній час до початку полегшення симптомів (години) |
|||||
|
Усі епізоди (n = 74) |
2,0 |
12,0 |
Усі епізоди (n = 56) |
2,5 |
4,6 |
|
|
Частота відповіді (%, ДІ) через 4 години після початку лікування |
Частота відповіді (%, ДІ) через 4 години після початку лікування |
|||||
|
Усі епізоди (n = 74) |
80,0 (63,1; 91,6) |
30,6 (16,3; 48,1) |
Усі епізоди (n = 56) |
66,7 (46,0; 83,5) |
46,4 (27,5; 66,1) |
|
|
Середній час до появи полегшення симптомів: усі симптоми (години): біль у животі, набряк шкіри, шкірний біль |
1,6 2,6 1,5 |
3,5 18,1 12,0 |
Середній час до появи полегшення симптомів: усі симптоми (години): біль у животі, набряк шкіри, шкірний біль |
2,0 3,1 1,6 |
3,3 10,2 9,0 |
|
|
Середній час до майже повного полегшення симптомів (години) |
Середній час до майже повного полегшення симптомів (години) |
|||||
|
Усі епізоди (n = 74) |
10,0 |
51,0 |
Усі епізоди (n = 56) |
8,5 |
19,4 |
|
|
Середній час до майже повного полегшення симптомів (години) |
Середній час до майже повного полегшення симптомів (години) |
|||||
|
Усі епізоди (n = 74) |
0,8 |
7,9 |
Усі епізоди (n = 56) |
0,8 |
16,9 |
|
|
Середній час до майже повного полегшення симптомів (години) |
Середній час до майже повного полегшення симптомів (години) |
|||||
|
Усі епізоди (n = 74) |
1,5 |
6,9 |
Усі епізоди (n = 56) |
1,0 |
5,7 |
|
Таблиця 2
Результати ефективності для FAST-3.
|
Результати ефективності: FAST-3; контрольована фаза – населення ITT |
||||
|
Кінцева точка |
Статистика |
Ікатібант |
Плацебо |
Значення p |
|
(n = 43) |
(n = 45) |
|||
|
Основна кінцева точка |
||||
|
Час до появи полегшення симптомів – комбінована ВАШ (години) |
медіана |
2,0 |
19,8 |
< 0,001 |
|
Інші кінцеві точки |
||||
|
Час до появи полегшення основних симптомів (години) |
медіана |
1,5 |
18,5 |
< 0,001 |
|
Зміна зведеної оцінки за ВАШ через 2 години після лікування |
середнє |
-19,74 |
- 7,49 |
< 0,001 |
|
Зміна загальної оцінки симптомів щодо оцінки пацієнта через 2 години |
середнє |
- 0,53 |
- 0,22 |
< 0,001 |
|
Зміна загальної оцінки симптомів щодо оцінки пацієнта через 2 години |
середнє |
- 0,44 |
- 0,19 |
< 0,001 |
|
Час до майже повного усунення симптомів (години) |
медіана |
8,0 |
36,0 |
0,012 |
|
Час до покращення вихідних симптомів щодо оцінки пацієнта (години) |
медіана |
0,8 |
3,5 |
< 0,001 |
|
Час до покращення вихідних зорових симптомів за оцінкою дослідника (години) |
медіана |
0,8 |
3,4 |
< 0,001 |
Загалом у цих контрольованих клінічних випробуваннях III фази лікували 66 пацієнтів із нападами САН, що вражали гортань. Результати були аналогічні пацієнтам із неларингеальними нападами САН щодо часу до початку полегшення симптомів. Застосування дітям.
Проведено відкрите нерандомізоване дослідження з однією групою (HGT-FIR-086) за участю 32 пацієнтів. Всі пацієнти отримали принаймні одну дозу ікатібанту (0,4 мг/кг маси тіла до максимальної дози 30 мг) і більшість пацієнтів спостерігалися протягом як мінімум 6 місяців. 11 пацієнтів мали препубертатний статус, а 21 пацієнт був або в пубертатному, або у постпубертатному періоді.
Ефективна популяція складалася з 22 пацієнтів, які застосовували ікатібант (11 у препубертатному періоді та 11 у пубертатному/постпубертатному періоді) з приводу нападу САН.
Первинною кінцевою точкою ефективності був час до початку полегшення симптомів (ЧППС), виміряний за допомогою комбінованої оцінки симптомів, повідомленої дослідником. Час до полегшення симптомів визначали як тривалість часу (у годинах), протягом якого симптоми зменшувалися на 20 %. Загалом середній час на початок полегшення симптомів становив 1,0 годину (95 % ДІ, 1,0‑1,1 години). Через 1 та 2 години після лікування приблизно у 50 % та 90 % пацієнтів відповідно спостерігалося полегшення симптомів.
Загалом середній час до появи мінімальних симптомів (найбільш ранній час після лікування, коли всі симптоми були слабко виражені або відсутні) становив 1,1 години (95 % ДІ, 1,0‑2,0 години).
Фармакокінетика.
Фармакокінетика ікатібанту була охарактеризована у дослідженнях із використанням як внутрішньовенного, так і підшкірного введення здоровим добровольцям та пацієнтам. Фармакокінетичний профіль ікатібанту у пацієнтів зі САН аналогічний до здорових добровольців.
Всмоктування.
Після підшкірного введення абсолютна біодоступність ікатібанту становить 97 %. Час досягнення максимальної концентрації становить приблизно 30 хвилин.
Розподіл.
Об'єм розподілу ікатібанту (Vss) становить приблизно 20‑25 л. Зв’язування з білками плазми крові становить 44 %.
Біотрансформація.
Ікатібант значною мірою метаболізується протеолітичними ферментами до неактивних метаболітів, які переважно виводяться зі сечею.
Дослідження in vitro підтвердили, що ікатібант не розщеплюється окиснювальними метаболічними шляхами, не є інгібітором основних ізоферментів цитохрому P450 (CYP) (CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 та 3A4) і не є індуктором CYP 1A2 і 3A4. Виведення.
Ікатібант в основному виводиться шляхом метаболізму, при цьому менше 10 % дози виводиться зі сечею у незміненому вигляді. Кліренс становить приблизно 15‑20 л/год і не залежить від дози. Кінцевий період напіввиведення з плазми крові становить приблизно 1‑2 години.
Особливі групи пацієнтів.
Пацієнти літнього віку.
Дані свідчать про вікове зниження кліренсу, що призводить до більшої експозиції приблизно на 50‑60 % у пацієнтів літнього віку (75‑80 років) порівняно з пацієнтами віком 40 років. Стать.
Дані свідчать про відсутність різниці в кліренсі між жінками та чоловіками після поправки на масу тіла.
Печінкова та ниркова недостатність.
Обмежені дані свідчать, що вплив ікатібанту не залежить від печінкової або ниркової недостатності.
Раса.
Інформація про вплив на індивідуальні раси обмежена. Доступні дані про експозицію свідчать про відсутність різниці в кліренсі між небілими (n = 40) і білими (n = 132) пацієнтами.
Застосування у дітей.
Фармакокінетика ікатібанту була охарактеризована у дітей зі САН у дослідженні HGT-FIR-086 (див. розділ «Фармакодинаміка»). Після одноразового підшкірного введення (від 0,4 мг/кг до максимальної дози 30 мг) час досягнення максимальної концентрації становить приблизно 30 хвилин, а кінцевий період напіввиведення – приблизно 2 години. Немає спостережених відмінностей в експозиції ікатібанту між пацієнтами зі САН з нападом і без нього. Популяційне фармакокінетичне моделювання з використанням даних як дорослих, так і педіатричних пацієнтів показало, що кліренс ікатібанту пов’язаний з масою тіла, при цьому нижчі значення кліренсу відзначаються при меншій масі тіла у дітей зі САН. Ґрунтуючись на моделюванні дозування залежно від маси тіла, прогнозована експозиція ікатібанту у дітей зі САН (див. розділ «Спосіб застосування та дози») нижча, ніж експозиція, що спостерігається у дослідженнях, проведених за участю дорослих пацієнтів зі САН.
Клінічні характеристики.
Показання.
Симптоматичне лікування гострих нападів спадкового ангіоневротичного набряку (САН) у дорослих, підлітків та дітей віком від 2 років (зумовленого дефіцитом інгібітора С1-естрази).
Протипоказання.
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин лікарського засобу.
Особливі заходи безпеки.
Розчин має бути прозорим, безбарвним і не містити видимих часток.
Застосування в педіатричній популяції.
Відповідна доза для введення залежить від маси тіла (див. розділ «Спосіб застосування та дози»).
Якщо необхідна доза становить менше 30 мг (3 мл), для отримання та введення відповідної дози потрібне таке обладнання:
• адаптер (проксимальний та/або дистальний гніздовий роз’єм/з’єднувач Luer Lock);
• 3 мл (рекомендовано) градуйований шприц.
Попередньо наповнений шприц ікатібанту та всі інші компоненти призначені лише для одноразового використання.
Будь-який невикористаний продукт або відходи слід утилізувати відповідно до місцевих вимог. Усі голки та шприци слід викидати в контейнер для гострих предметів.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Фармакокінетична взаємодія лікарських засобів за участю CYP450 не очікується (див. розділ «Фармакокінетика»).
Одночасне застосування ікатібанту з інгібіторами ангіотензинперетворювального ферменту (АПФ) не вивчалося. Інгібітори АПФ протипоказані пацієнтам зі САН через можливе підвищення рівня брадикініну.
Застосування у дітей.
Усі дослідження лікарських взаємодій проводили тільки у дорослих.
Особливості застосування.
Ларингеальні напади.
Пацієнти з ларингеальними нападами після ін’єкції повинні перебувати у відповідному медичному закладі доти, доки лікар не вважатиме виписку безпечною.
Ішемічна хвороба серця.
В умовах ішемії погіршення функції серця та зниження коронарного кровотоку теоретично можливе внаслідок антагонізму рецепторів брадикініну 2 типу. Тому слід бути обережним при застосуванні ікатібанту пацієнтам із гострою ішемічною хворобою серця або нестабільною стенокардією.
Інсульт.
Хоча є дані, що підтверджують позитивний ефект блокади В2-рецепторів відразу після інсульту, існує теоретична можливість того, що ікатібант може послаблювати позитивні нейропротекторні ефекти брадикініну в пізній фазі. Відповідно, слід бути обережним при призначенні ікатібанту пацієнтам протягом декількох тижнів після інсульту.
Особа, яка здійснює догляд за хворим/самостійне введення лікарського засобу.
Пацієнтам, які раніше ніколи не застосовували лікарський засіб ІКАТІБАНТ-ВІСТА, перше лікування слід проводити в медичному закладі або під наглядом лікаря.
У разі недостатнього полегшення або рецидиву симптомів після самостійного введення або введення особою, яка здійснює догляд за хворим, пацієнту або опікуну рекомендується звернутися до лікаря. Для дорослих наступні дози, які можуть знадобитися для купірування нападу, слід вводити в медичному закладі (див. розділ «Спосіб застосування та дози»). Немає даних щодо введення наступних доз для купірування того самого нападу у підлітків або дітей. Пацієнти, які перенесли ларингеальний напад, повинні обов’язково звернутися до лікаря та спостерігатись у медичному закладі, у тому числі після того, як зробили ін’єкцію вдома.
Важлива інформація про допоміжні речовини.
Даний лікарський засіб містить менше 1 ммоль (23 мг) натрію на шприц, тому практично вільний від натрію.
Застосування у дітей.
Існує обмежений досвід лікування більше ніж одного нападу САН ікатібантом у дітей.
Застосування у період вагітності або годування груддю.
Вагітність.
Для ікатібанту відсутні клінічні дані про вплив на вагітність. Дослідження на тваринах показали вплив на імплантацію заплідненої яйцеклітини в матку та пологи, але потенційний ризик для людини невідомий.
Ікатібант під час вагітності слід застосовувати тільки в тому випадку, якщо очікувана користь для матері перевищує потенційний ризик для плода (наприклад, для лікування потенційно небезпечних для життя ларингеальних нападів).
Період годування груддю.
Ікатібант виділяється у молоко щурів у період лактації у концентраціях, подібних до концентрацій у крові матері. Не було виявлено жодного впливу на постнатальний розвиток у щурів.
Невідомо, чи виділяється ікатібант у грудне молоко людини, але жінкам, які годують груддю та повинні застосовувати ікатібант, рекомендується утриматися від годування груддю протягом 12 годин після лікування.
Фертильність.
Як у щурів, так і у собак повторне застосування ікатібанту призводило до впливу на репродуктивні органи. Ікатібант не впливав на фертильність самців мишей та щурів. У дослідженні 39 здорових дорослих чоловіків і жінок, які отримували 30 мг ікатібанту кожні 6 годин у вигляді 3 доз кожні 3 дні (всього 9 доз), не було виявлено клінічно значущих змін порівняно з вихідним рівнем у базальній та стимульованій ГнРГ концентрації репродуктивних гормонів ні у жінок, ні у чоловіків. Не було виявлено значного впливу ікатібанту на концентрацію прогестерону у лютеїновій фазі та на лютеїнову функцію або на тривалість менструального циклу у жінок, а також не було виявлено значного впливу ікатібанту на кількість, рухливість та морфологію сперматозоїдів у чоловіків. Режим дозування, використаний у даному дослідженні, навряд чи буде підтримуватися у клінічних умовах.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Ікатібант має незначний вплив на здатність керувати транспортними засобами та працювати з механізмами. Повідомлялося про стомлюваність, млявість, втому, сонливість і запаморочення після застосування ікатібанту. Зазначені симптоми можуть виникати внаслідок нападу САН. Пацієнтам не рекомендовано керувати автотранспортом та іншими механізмами, якщо вони відчувають втому або запаморочення.
Спосіб застосування та дози.
Лікарський засіб ІКАТІБАНТ-ВІСТА показаний для застосування під керівництвом медичного працівника.
Дозування.
Дорослі.
Рекомендована доза для дорослих – одноразова підшкірна ін’єкція лікарського засобу ІКАТІБАНТ-ВІСТА 30 мг.
Найчастіше для купірування нападу достатньо однієї ін’єкції лікарського засобу ІКАТІБАНТ-ВІСТА. У разі недостатнього полегшення або рецидиву симптомів можна ввести другу ін’єкцію лікарського засобу ІКАТІБАНТ-ВІСТА через 6 годин. Якщо друга ін’єкція дає недостатнє полегшення або спостерігається рецидив симптомів, можна застосувати третю ін’єкцію лікарського засобу ІКАТІБАНТ-ВІСТА ще через 6 годин. Не можна вводити більше 3 ін’єкцій даного лікарського засобу протягом 24 годин.
Під час клінічних досліджень застосовувалося не більше 8 ін’єкцій лікарського засобу ІКАТІБАНТ-ВІСТА на місяць.
Діти.
Рекомендована доза лікарського засобу ІКАТІБАНТ-ВІСТА залежно від маси тіла для дітей та підлітків (віком від 2 до 17 років) представлена в таблиці 3.
Таблиця 3
Режим дозування для дітей
|
Маса тіла |
Доза (об’єм ін’єкції) |
|
від 12 кг до 25 кг |
10 мг (1,0 мл) |
|
від 26 кг до 40 кг |
15 мг (1,5 мл) |
|
від 41 кг до 50 кг |
20 мг (2,0 мл) |
|
від 51 кг до 65 кг |
25 мг (2,5 мл) |
|
> 65 кг |
30 мг (3,0 мл) |
Під час клінічного випробування застосовувалося не більше 1 ін’єкції лікарського засобу ікатібанту на один напад САН.
Пацієнти літнього віку.
Інформація щодо пацієнтів віком від 65 років обмежена.
Доведено, що у людей літнього віку спостерігається підвищений системний вплив ікатібанту. Значення цього впливу для безпеки ікатібанту невідоме (див. розділ «Фармакокінетика»).
Печінкова недостатність.
Для пацієнтів з печінковою недостатністю корекція дози не потрібна.
Ниркова недостатність.
Для пацієнтів з нирковою недостатністю корекція дози не потрібна.
Спосіб застосування.
Лікарський засіб ІКАТІБАНТ-ВІСТА призначений для підшкірного введення переважно в ділянку живота.
Даний лікарський засіб слід вводити повільно, враховуючи об’єм, який необхідно ввести. Кожен шприц із лікарським засобом ІКАТІБАНТ-ВІСТА призначений лише для одноразового використання.
Особа, яка здійснює догляд за хворим/самостійне введення лікарського засобу.
Рішення про призначення особи, яка здійснюватиме догляд за хворим або про самостійне введення лікарського засобу ІКАТІБАНТ-ВІСТА повинен приймати тільки лікар, який має досвід діагностики та лікування спадкового ангіоневротичного набряку (див. розділ «Особливості застосування»).
Лікарський засіб ІКАТІБАНТ-ВІСТА можна вводити самостійно або його може вводити особа, яка здійснює догляд за хворим, тільки після навчання техніці підшкірних ін’єкцій медичним працівником.
Покрокова інструкція щодо введення ін’єкції ІКАТІБАНТ-ВІСТА для:
- самостійного введення лікарського засобу (дорослі);
- введення лікарського засобу дорослим, підліткам або дітям віком від 2 років (з масою тіла не менше 12 кг) особою, яка здійснюватиме догляд за хворим, або медичним працівником.
|
1) Загальні відомості. |
|
• Перед початком процесу очистити робочу ділянку (поверхню), яка буде використовуватися. • Вимити з милом та водою руки. • Відкрити лоток, відігнувши захисну плівку. • Вилучити попередньо наповнений шприц із лотка. • Зняти ковпачок з кінця попередньо наповненого шприца, відкрутивши його. • Покласти попередньо наповнений шприц після відкручування ковпачка. |
|
2а) Підготовка шприца для дітей та підлітків (2‑17 років) з масою тіла до 65 кг. |
|
Важлива інформація для медичних працівників та осіб, які здійснюватимуть догляд за хворим: Якщо доза становить менше 30 мг (3 мл), для отримання відповідної дози потрібне таке обладнання (див. нижче): a) попередньо наповнений шприц лікарського засобу ІКАТІБАНТ-ВІСТА (що містить розчин ікатібанту); b) з’єднувач (адаптер); c) градуйований шприц на 3 мл. 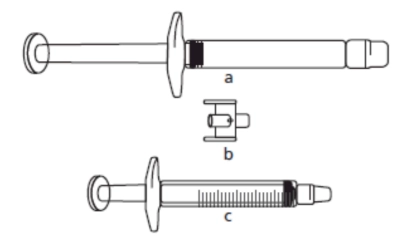
Необхідний об’єм для ін’єкції в мл (див. Таблицю 1) слід набрати в порожній градуйований шприц на 3 мл. 1) Зняти ковпачки з кожного кінця з’єднувача. Не торкатися кінців з’єднувача та канюлі шприців, щоб запобігти забрудненню. 2) Накрутити з’єднувач на попередньо наповнений шприц. 3) Приєднати градуйований шприц до іншого кінця з’єднувача, переконавшись, що обидва з’єднання надійно закріплені. 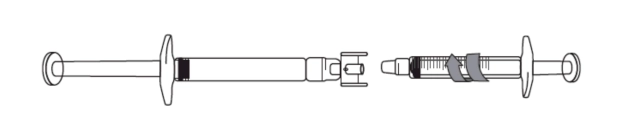
Перенесення розчину ікатібанту в градуйований шприц: 1) Щоб розпочати перенесення розчину ікатібанту, потрібно натиснути на поршень попередньо наповненого шприца (крайній лівий кут на зображенні нижче). 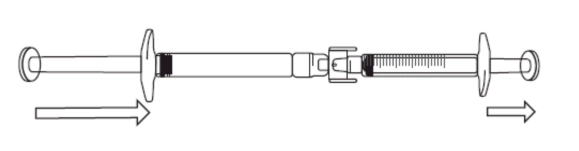
2) Якщо розчин ікатібанту не починає надходити в градуйований шприц, злегка потягнути поршень шприца, доки розчин ікатібанту не почне текти в градуйований шприц (див. рисунок нижче). 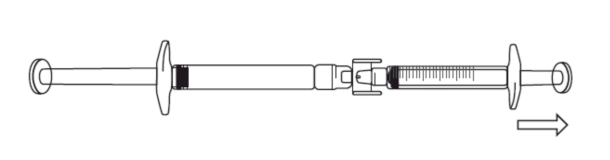
3) Продовжувати натискати на поршень попередньо наповненого шприца доти, доки необхідний об’єм ін’єкції (доза) не буде перенесений у градуйований шприц (див. таблицю 3 для отримання інформації про дозування). |
|
Якщо в градуйованому шприці є повітря: • Повернути з’єднані шприци так, щоб попередньо наповнений шприц виявився зверху (див. рисунок нижче). 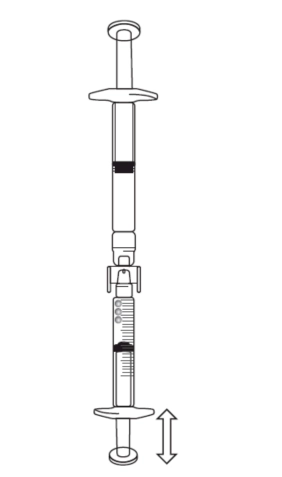
• Натиснути на поршень градуйованого шприца так, щоб все повітря потрапило назад у попередньо наповнений шприц (цей крок може знадобитися повторити кілька разів). • Набрати необхідний об’єм розчину ікатібанту. 4) Зняти попередньо наповнений шприц та з’єднувач із градуйованого шприца. 5) Викинути попередньо наповнений шприц та з’єднувач у контейнер для викидання гострих відходів. |
|
2б) Підготовка шприца та голки для ін’єкції (усі пацієнти: дорослі, підлітки та діти) |
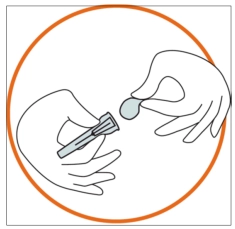
• Вилучити захисний ковпачок голки з блістера. • Зняти захисну плівку зі захисного ковпачка голки (голка повинна залишатися в захисному ковпачку голки). |
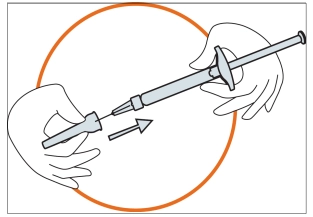
• Міцно тримати шприц. Обережно приєднати голку до шприца з безбарвним розчином. • Нагвинтити шприц на голку, яка все ще закріплена в захисному ковпачку голки. • Вийняти голку із захисного ковпачка голки, потягнувши за шприц. Не тягнути за поршень. • Тепер шприц готовий до ін’єкції. |
|
3) Підготовка місця ін’єкції |
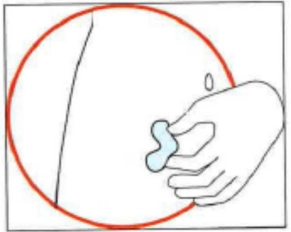
• Вибрати місце ін’єкції. Місцем ін’єкції має бути шкірна складка на животі приблизно на 5–10 см (2–4 дюйми) нижче пупка з обох боків. Дана ділянка має бути на відстані принаймні 5 см (2 дюйми) від будь-яких шрамів. Не вибирати ділянку, на якій наявні синці, набряк або відчувається біль. • Спиртовою серветкою очистити місце ін’єкції та дати йому висохнути. |
|
4) Введення розчину |
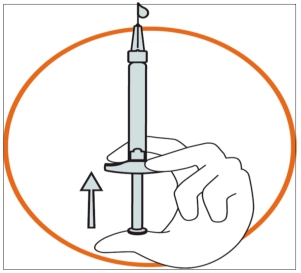
• Тримати шприц однією рукою між двома пальцями, при цьому великий палець повинен бути біля основи поршня. • Переконатися, що в шприці відсутні бульбашки повітря, натиснувши на поршень до появи першої краплі на кінчику голки. |
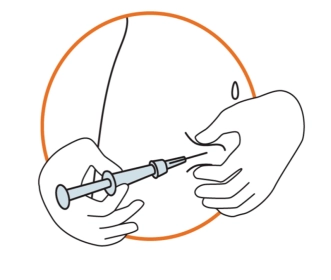
• Тримати шприц під кутом 45-90 градусів до шкіри так, щоб голка була звернена у напрямку до шкіри. • Тримаючи шприц в одній руці, іншою рукою обережно утримувати складку шкіри з попередньо продезінфікованим місцем для ін’єкції між великим пальцем з одного боку та іншими пальцями з іншого. • Утримуючи складку шкіри, піднести шприц до шкіри та швидко ввести голку в складку шкіри. • Повільно натискати на поршень шприца нерухомою рукою, доки вся рідина не буде введена в шкіру і в шприці не залишиться жодної рідини. • Натискати повільно, щоб це зайняло приблизно 30 секунд. • Відпустити складку шкіри та обережно витягнути голку. |
|
5) Утилізація ін’єкційного матеріалу |
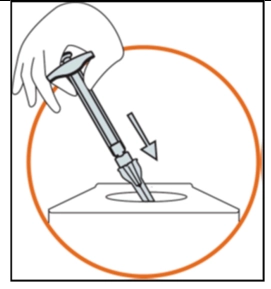
• Викинути шприц, голку та ковпачок голки в контейнер для викидання гострих відходів, які можуть завдати шкоди іншим у разі неправильного поводження. |
Діти.
Лікарський засіб застосовувати дітям віком від 2 років. Не можна рекомендувати схему дозування для дітей віком до 2 років або з масою тіла менше 12 кг, оскільки безпека та ефективність у зазначеній педіатричній групі не встановлені.
Передозування.
Клінічна інформація про передозування відсутня. Доза 3,2 мг/кг внутрішньовенно (приблизно у 8 разів більша за терапевтичну дозу) викликала минучу еритему, свербіж, почервоніння або артеріальну гіпотензію у здорових добровольців. Жодного терапевтичного втручання не знадобилося.
Побічні реакції.
У клінічних дослідженнях загалом 999 нападів САН було вилікувано за допомогою ікатібанту 30 мг, який вводили підшкірно медичні працівники. Ікатібант 30 мг медичні працівники вводили підшкірно 129 здоровим добровольцям та 236 пацієнтам зі САН. Практично у всіх пацієнтів, які отримували ікатібант підшкірно у процесі клінічних випробувань, розвивалися реакції в місці ін’єкції (що характеризуються подразненням шкіри, набряком, болем, свербежем, еритемою, відчуттям печіння). Зазначені реакції зазвичай були легкими або помірними за тяжкістю, минущими та зникали без подальшого втручання. Побічні реакції (див. таблицю 4)
Частота побічних реакцій, наведених у таблиці 4, визначається за такою умовою: дуже часто (≥ 1/10); часто (≥ 1/100 до < 1/10); нечасто (≥ 1/1000 до < 1/100); рідко (≥ 1/10000 до < 1/1000); дуже рідко (< 1/10000); частота невідома (неможливо оцінити за наявними даними).
Таблиця 4
Побічні реакції, про які повідомлялося при застосуванні ікатібанту
|
Клас системи органів (категорія захворюваності) |
Переважний термін |
|
З боку нервової системи |
|
|
часто |
Запаморочення, головний біль |
|
З боку шлунково-кишкового тракту |
|
|
часто |
Нудота |
|
З боку шкіри та підшкірної клітковини |
|
|
часто |
Висипання, еритема, свербіж |
|
частота невідома |
Кропив’янка |
|
Загальні порушення та стан у місці введення |
|
|
дуже часто |
Реакції в місці ін’єкції* |
|
часто |
Гарячка |
|
Лабораторні показники |
|
|
часто |
Підвищення рівня трансаміназ |
|
* Синці в місці ін’єкції, гематома в місці ін’єкції, печіння в місці ін’єкції, еритема в місці ін’єкції, гіпестезія в місці ін’єкції, подразнення в місці ін’єкції, оніміння в місці ін’єкції, набряк у місці ін'єкції, біль у місці ін’єкції, відчуття тиску в місці ін’єкції, свербіж у місці ін’єкції, припухлість у місці ін’єкції, кропив’янка у місці ін’єкції та підвищення температури у місці ін’єкції. |
|
Застосування дітям.
Загалом 32 педіатричні пацієнти (8 дітей віком від 2 до 11 років та 24 підлітки віком від 12 до 17 років) зі САН отримували лікування ікатібантом під час клінічних досліджень. 31 пацієнт отримав одноразову дозу ікатібанту та 1 пацієнт (підліток) отримав ікатібант з приводу двох нападів САН (всього дві дози). Ікатібант вводили підшкірно в дозі 0,4 мг/кг залежно від маси тіла до максимальної дози 30 мг. У більшості педіатричних пацієнтів, які отримували ікатібант підшкірно, спостерігалися реакції в місці ін’єкції, такі як еритема, набряк, відчуття печіння, шкірний біль і свербіж; вони виявились легкими або помірними за ступенем тяжкості та відповідали реакціям, про які повідомлялося у дорослих. У двох дітей розвинулися реакції у місці ін’єкції, які були оцінені як тяжкі та були повністю усунені протягом 6 годин. Такими реакціями були еритема, набряк, печіння та відчуття тепла. Під час клінічних досліджень не спостерігалося клінічно значущих змін репродуктивних гормонів.
Опис окремих побічних реакцій.
Імуногенність.
При повторному лікуванні дорослих у контрольованих дослідженнях фази III у поодиноких випадках спостерігалася минуща позитивна реакція на антитіла до ікатібанту. В усіх пацієнтів зберігалася ефективність. У одного пацієнта, який отримував лікарський засіб ікатібант, був позитивний результат на антитіла до ікатібанту до та після застосування лікарського засобу. За цим пацієнтом спостерігали протягом 5 місяців і наступні зразки були негативними на антитіла проти ікатібанту. Не повідомлялося про реакції гіперчутливості або анафілактичні реакції при застосуванні ікатібанту.
Повідомлення про підозрювані побічні реакції.
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua
Термін придатності. 2 роки.
Умови зберігання. Зберігати в оригінальній упаковці при температурі не вище 25ºС. Зберігати в недоступному для дітей місці.
Упаковка. По 3 мл у попередньо наповненому шприці, по 1 або 3 шприца в пачці.
Категорія відпуску. За рецептом.
Виробник. Нанг Куанг Фармасьютікал Ко., Лтд.
Місцезнаходження виробника та адреса місця провадження його діяльності.
№ 1001, 1001-1, Зхонгшан Рд., Ксіньхуа Діст, Тайнан Сіті, Тайвань (еР.О.Сі.).
