ХАДЛІМА
-
Республіка Корея Самсунг Біоепіс Ко., Лтд.Форма выпуску: ін'єкція адалімумабу, 40мг/0,8мл, по 0,8 мл у попередньо наповненому шприці, по 2 попередньо наповнених шприци в картонній коробці або по 2 автоінжектори пушТач у картонній коробціСклад: 0,8 мл розчину містять адалімумабу 40 мгУмови відпуску: за рецептомНомер реєстраційного посвідчення: UA/19090/01/01код АТС: L04AB04Термін придатності: 3 роки
-
Республіка Корея САМСУНГ БІОЕПІС КО., ЛТД.Форма выпуску: розчин для ін'єкцій, 40 мг/0,8 мл по 0,8 мл у попередньо наповненому одноразовому шприці зі скла типу І з голкою з нержавіючої сталі, ковпачком голки з жорсткою оболонкою та гумовим ущільнювачем; по 2 попередньо наповнених одноразових шприци з захисними корпусами, упорами для пальця та штоками поршня в стандартно-експортній упаковці в картонній коробці або по 2 попередньо наповнені одноразові ручки, що містять попередньо наповнені одноразові шприци в стандартно-експортній упаковці в картонній коробціСклад: 1 попередньо наповнений одноразовий шприц містить 40 мг адалімумабу в 0,8 мл розчину;/1 попередньо наповнена одноразова ручка містить 40 мг адалімумабу в 0,8 мл розчинуУмови відпуску: за рецептомНомер реєстраційного посвідчення: UA/20533/01/01код АТС: L04AB04Термін придатності: 42 місяці
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ХАДЛІМА
(HADLIMA)
Склад:
діюча речовина: адалімумаб;
1 попередньо наповнений одноразовий шприц містить 40 мг адалімумабу в 0,8 мл розчину;
1 попередньо наповнена одноразова ручка містить 40 мг адалімумабу в 0,8 мл розчину;
допоміжні речовини: натрію цитрат; кислота лимонна, моногідрат; L-гістидин; L-гістидину гідрохлорид моногідрат; сорбіт (Е 420); полісорбат 20; вода для ін’єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: від прозорого до опалесцентного, від безбарвного до блідо-коричневого кольору розчин.
Фармакотерапевтична група. Імуносупресанти. Інгібітори фактора некрозу пухлини-альфа (ФНП-альфа). Адалімумаб.
Код АТХ L04А В04.
Фармакологічні властивості.
Адалімумаб ¾ це рекомбінантний імуноглобулін (IgG1) людини, моноклональне антитіло, що містить тільки пептидні послідовності людини. Адалімумаб був створений за технологією фагового відображення, що дало змогу отримати характерні тільки для людини варіабельні ділянки важких та легких ланцюгів, які проявляють свою специфічність щодо фактора некрозу пухлини (ФНП), а також важкий ланцюг IgG1 людини та послідовність легких ланцюгів каппа-типу. Адалімумаб із високим ступенем спорідненості та специфічністю зв’язується з розчинним ФНП-альфа, але не з лімфотоксином (ФНП-бета). Адалімумаб продукується шляхом отримання рекомбінантної ДНК в експресуючій системі клітин ссавців. Складається з 1330 амінокислот, молекулярна маса становить близько 148 кілодальтонів.
Адалімумаб специфічно зв’язується з ФНП і нейтралізує його біологічні ефекти, інгібуючи його взаємодію з р55- та р75-рецепторами ФНП на поверхні клітини. ФНП ¾ це природний цитокін, який бере участь у нормальних запальних та імунних відповідях організму. Підвищені рівні ФНП виявляють у синовіальній рідині пацієнтів із ревматоїдним артритом, включаючи ювенільний ідіопатичний артрит, псоріатичним артритом та анкілозуючим спондилітом. ФНП відіграє важливу роль у розвитку патологічного запального процесу та в руйнуванні тканин суглобів, що є характерними рисами для цих захворювань. Підвищені рівні ФНП виявляються також у псоріатичних бляшках, що сприяє розвитку запальної відповіді, проліферації та зниженню дозрівання кератиноцитів і супутньому руйнуванню судин, що є характерним для цього захворювання. Взаємозв’язок між цими фармакодинамічними ефектами і механізмом (механізмами), через які адалімумаб проявляє свою клінічну ефективність, невідомий.
Адалімумаб також модулює біологічні реакції, що індукуються або регулюються ФНП, включаючи зміни рівнів молекул адгезії, відповідальних за міграцію лейкоцитів (ELAM-1, VCAM-1 та ICAM-1 при IC50 0,1-0,2 нМ).
Фармакодинаміка.
У пацієнтів із ревматоїдним артритом після лікування адалімумабом спостерігалося швидке зменшення, порівняно з початковими параметрами, рівнів показників гострої фази запалення [С-реактивного протеїну (СРП), швидкості осідання еритроцитів (ШОЕ) і цитокінів сироватки крові (IL-6)]. Після введення адалімумабу спостерігалося зниження рівнів матриксних металопротеїназ (MMP-1 та MMP-3) у сироватці крові, які спричиняють ремоделювання тканин, що лежить в основі руйнування хряща. При застосуванні адалімумабу у пацієнтів зазвичай спостерігалося покращення гематологічних ознак хронічного запалення.
Швидке зниження рівнів СРП спостерігалося також у пацієнтів із поліартикулярним ювенільним ідіопатичним артритом, хворобою Крона, виразковим колітом і гнійним гідраденітом після лікування адалімумабом. У пацієнтів із хворобою Крона спостерігалося зменшення кількості клітин, що експресують маркери запалення в товстому кишечнику, включаючи значне зниження експресії ФНП-альфа. Ендоскопічні дослідження слизової оболонки кишечника показали загоєння слизової оболонки у пацієнтів, які отримували адалімумаб.
Імуногенність. Протягом терапії адалімумабом можуть утворюватись антитіла до адалімумабу. Утворення антитіл до адалімумабу пов’язане зі збільшенням кліренсу та зниженням ефективності адалімумабу. Не спостерігалося жодної очевидної кореляції між наявністю антитіл і виникненням побічних реакцій.
Фармакокінетика.
Абсорбція та розподіл. Після одноразового підшкірного введення 40 мг адалімумабу абсорбція та розподіл адалімумабу були повільними, пікові концентрації в сироватці крові досягалися приблизно через 5 днів після введення. Середня абсолютна біодоступність адалімумабу, розрахована у трьох дослідженнях, після застосування одноразової дози 40 мг підшкірно становила 64 %. Після одноразових внутрішньовенних введень у дозах від 0,25 до 10 мг/кг концентрації були пропорційні дозам. Після застосування доз 0,5 мг/кг (приблизно 40 мг) кліренс коливався від 11 до 15 мл/год, об’єм розподілу (Vss) коливався від 5 до 6 літрів, а середній період напіввиведення в кінцевій фазі становив приблизно два тижні. Концентрації адалімумабу в синовіальній рідині у деяких пацієнтів із ревматоїдним артритом становили від 31 до 96 % від концентрації в сироватці крові.
Після підшкірного введення 40 мг адалімумабу 1 раз на 2 тижні дорослим пацієнтам із ревматоїдним артритом середні мінімальні концентрації у стаціонарному стані становили приблизно 5 мкг/мл без супутнього прийому метотрексату і 8-9 мкг/мл із супутнім прийомом метотрексату. Мінімальні концентрації адалімумабу в сироватці крові у стаціонарному стані збільшувалися майже пропорційно до підшкірного введення доз 20, 40 та 80 мг 1 раз на 2 тижні й 1 раз на тиждень.
Після підшкірного введення 24 мг/м2 (до 40 мг) 1 раз на 2 тижні дітям із поліартикулярним ювенільним ідіопатичним артритом віком від 4 до 17 років середні мінімальні концентрації адалімумабу в сироватці крові у стаціонарному стані (значення отримані з 20 до 48 тижня) становили 5,6 ± 5,6 мкг/мл (102 % CV [коефіцієнт варіації]) без супутнього прийому метотрексату і 10,9 ± 5,2 мкг/мл (47,7 % CV) із супутнім прийомом метотрексату.
У дітей із поліартикулярним ювенільним ідіопатичним артритом віком від 2 до 4 років або у дітей віком від 4 років, маса тіла яких менше 15 кг, після застосування адалімумабу в дозі 24 мг/м2 середні мінімальні концентрації адалімумабу в сироватці крові у стаціонарному стані становили 6,0 ± 6,1 мкг/мл (101 % CV) без супутнього прийому метотрексату і 7,9 ± 5,6 мкг/мл (71,2 % CV) із супутнім прийомом метотрексату.
Після введення 24 мг/м2 (до 40 мг) підшкірно 1 раз на 2 тижні дітям віком від 6 до 17 років із ентезитасоційованим артритом середні мінімальні концентрації адалімумабу в сироватці крові у стаціонарному стані (значення отримані на тижні 24) становили 8,8 ± 6,6 мкг/мл без супутнього прийому метотрексату і 11,8 ± 4,3 мкг/мл із супутнім прийомом метотрексату.
Після підшкірного введення 40 мг адалімумабу 1 раз на 2 тижні дорослим пацієнтам із аксіальним спондилоартритом без рентгенологічного підтвердження анкілозуючого спондиліту середня (± СВ [середнє відхилення]) мінімальна концентрація у стаціонарному стані на тижні 68 становила 8,0 ± 4,6 мкг/мл.
Після підшкірного введення 40 мг адалімумабу 1 раз на 2 тижні дорослим пацієнтам із псоріатичним артритом середня мінімальна концентрація у стаціонарному стані становила 5 мкг/мл.
Після підшкірного введення 0,8 мг/кг (до 40 мг) 1 раз на 2 тижні дітям із хронічним бляшковим псоріазом середня (± СВ) мінімальна концентрація адалімумабу в сироватці крові у стаціонарному стані становила приблизно 7,4 ± 5,8 мкг/мл (79 % CV).
У дорослих пацієнтів із гнійним гідраденітом після введення початкової дози адалімумабу 160 мг на тижні 0 з наступним введенням 80 мг на тижні 2 середні мінімальні концентрації адалімумабу в сироватці крові становили приблизно від 7 до 8 мкг/мл на тижнях 2 та 4. Після підшкірного введення 40 мг адалімумабу 1 раз на тиждень середні мінімальні концентрації у стаціонарному стані (значення отримані з 12 до 36 тижня) становили 8-10 мкг/мл.
Вплив адалімумабу на підлітків із гнійним гідраденітом було визначено за допомогою популяційного фармакокінетичного моделювання та моделювання на основі перехресних фармакокінетичних показань при інших показаннях у дітей (бляшковий псоріаз, ювенільний ідіопатичний артрит, хвороба Крона та ентезитасоційований артрит). Рекомендований режим дозування для підлітків із гнійним гідраденітом ¾ 40 мг 1 раз на 2 тижні. Оскільки вплив адалімумабу може залежати від маси тіла, для підлітків із надмірною масою тіла та недостатньою відповіддю на лікування може бути доцільним застосування рекомендованої дози для дорослих пацієнтів ¾ 40 мг 1 раз на тиждень.
У пацієнтів із хворобою Крона після введення початкової дози адалімумабу 80 мг на тижні 0 з наступним введенням 40 мг на тижні 2 середня мінімальна концентрація адалімумабу в сироватці крові становила приблизно 5,5 мкг/мл протягом індукційної терапії. Після введення початкової дози адалімумабу 160 мг на тижні 0 з наступним введенням 80 мг на тижні 2 середня мінімальна концентрація адалімумабу в сироватці крові становила приблизно 12 мкг/мл протягом індукційної терапії. Середня мінімальна концентрація у стаціонарному стані становила приблизно 7 мкг/мл у пацієнтів із хворобою Крона, які отримували підтримувальну дозу 40 мг 1 раз на 2 тижні.
У дітей із хворобою Крона помірного та високого ступеня активності початкова доза адалімумабу становила 160/80 мг або 80/40 мг на тижнях 0 та 2 залежно від порогового значення маси тіла 40 кг. На тижні 4 діти були рандомізовані у співвідношенні 1:1 у групи, які отримували залежно від маси тіла або стандартну дозу (40/20 мг 1 раз на 2 тижні), або низьку дозу (20/10 мг 1 раз на 2 тижні). Середні (± СВ) мінімальні концентрації адалімумабу на тижні 4 становили приблизно 15,7 ± 6,6 мкг/мл у дітей із масою тіла 40 кг або більше (160/80 мг) та 10,6 ± 6,1 мкг/мл у дітей із масою тіла менше 40 кг (80/40 мг).
У дітей, які продовжували рандомізовану терапію, середні (± СВ) мінімальні концентрації адалімумабу на тижні 52 становили 9,5 ± 5,6 мкг/мл у групі стандартної дози і 3,5 ± 2,2 мкг/мл у групі низької дози. Середні мінімальні концентрації зберігались у дітей, які продовжували лікування адалімумабом 1 раз на 2 тижні протягом 52 тижнів. У дітей, частоту застосування для яких було збільшено від прийому 1 раз на 2 тижні до прийому 1 раз на тиждень, середні (± СВ) концентрації адалімумабу в сироватці крові на тижні 52 становили 15,3 ± 11,4 мкг/мл (40/20 мг 1 раз на тиждень) і 6,7 ± 3,5 мкг/мл (20/10 мг 1 раз на тиждень).
У дорослих пацієнтів із виразковим колітом після введення початкової дози адалімумабу 160 мг на тижні 0 з наступним введенням 80 мг на тижні 2 середня мінімальна концентрація адалімумабу в сироватці крові становила приблизно 12 мкг/мл протягом індукційної терапії. Середня мінімальна концентрація у стаціонарному стані становила приблизно 8 мкг/мл у пацієнтів із виразковим колітом, які отримувати підтримувальну дозу 40 мг 1 раз на 2 тижні.
Після підшкірного введення 0,6 мг/кг (до 40 мг) 1 раз на 2 тижні дітям із виразковим колітом середні (± СВ) мінімальні концентрації адалімумабу в сироватці крові у стаціонарному стані на тижні 52 становили приблизно 5,01 ± 3,28 мкг/мл. Після введення 0,6 мг/кг (до 40 мг) 1 раз на тиждень середні (± СВ) мінімальні концентрації адалімумабу в сироватці крові у стаціонарному стані на тижні 52 становили приблизно 15,7 ± 5,60 мкг/мл.
У дорослих пацієнтів із увеїтом після введення початкової дози адалімумабу 80 мг на тижні 0 з наступним введенням 40 мг 1 раз на 2 тижні, починаючи з тижня 1, середні мінімальні концентрації у стаціонарному стані становили від 8 до 10 мкг/мл.
Вплив адалімумабу у дітей з увеїтом було визначено за допомогою популяційного фармакокінетичного моделювання та моделювання на основі перехресних фармакокінетичних показань при інших показаннях у дітей (бляшковий псоріаз, ювенільний ідіопатичний артрит, хвороба Крона та ентезитасоційований артрит). Немає клінічних даних щодо впливу застосування початкової дози дітям віком до 6 років. Прогнозовані експозиції вказують на те, що за відсутності метотрексату початкова доза може спричинити підвищення системного впливу.
Популяційне фармакокінетичне та фармакокінетичне/фармакодинамічне моделювання, а також симуляція передбачали порівняльну експозицію й ефективність адалімумабу у пацієнтів, яким вводили 80 мг 1 раз на 2 тижні та у пацієнтів, яким вводили 40 мг 1 раз на тиждень (включаючи дорослих пацієнтів із ревматоїдним артритом, гнійним гідрагенітом, виразковим колітом, хворобою Крона або бляшковим псоріазом, підлітків із гнійним гідрагенітом і дітей із хворобою Крона та виразковим колітом з масою тіла більше 40 кг).
Виведення. Популяційний фармакокінетичний аналіз даних більше ніж 1300 пацієнтів із ревматоїдним артритом виявив тенденцію до підвищення очевидного кліренсу адалімумабу зі збільшенням маси тіла. З урахуванням поправок щодо різниці маси тіла було встановлено, що стать та вік мають мінімальний вплив на кліренс адалімумабу. Спостерігалось, що рівні вільного адалімумабу (не зв’язаного з антитілами до адалімумабу [ААА]) в сироватці крові були нижчими у пацієнтів із виявленими ААА.
Порушення функції нирок або печінки. Немає жодних фармакокінетичних даних щодо пацієнтів з порушеннями функцій печінки або нирок.
Клінічні характеристики.
Показання.
Ревматоїдний артрит (РА).
ХАДЛІМА в комбінації з метотрексатом показана для:
- лікування ревматоїдного артриту середнього та високого ступеня активності у дорослих пацієнтів, які не мали адекватної відповіді на хворобомодифікуючі протиревматичні препарати (ХМПРП), включаючи метотрексат;
- лікування ревматоїдного артриту високого ступеня активності та прогресуючого ревматоїдного артриту у дорослих пацієнтів, які раніше не отримували метотрексат.
Лікарський засіб ХАДЛІМА можна застосовувати як монотерапію в разі непереносимості метотрексату або коли подальше лікування метотрексатом є неприйнятним.
Адалімумаб уповільнював темпи прогресування структурного пошкодження суглобів, що було підтверджено рентгенографічно, та покращував функціональний стан при одночасному застосуванні з метотрексатом.
Аксіальний спондилоартрит.
Анкілозуючий спондиліт (АС).
ХАДЛІМА показана для лікування анкілозуючого спондиліту високого ступеня активності у дорослих пацієнтів, які не мали адекватної відповіді на традиційну терапію.
Аксіальний спондилоартрит без рентгенологічного підтвердження АС.ХАДЛІМА показана для лікування аксіального спондилоартриту високого ступеня активності без рентгенологічного підтвердження АС, але з наявними ознаками запалення, на підставі підвищеного рівня СРП та/або за результатами МРТ (магнітно-резонансна томографія), у дорослих пацієнтів, які не мали адекватної відповіді на традиційну терапію або при наявності непереносимості нестероїдних протизапальних препаратів (НПЗП).
Псоріатичний артрит (ПсА).
ХАДЛІМА показана для лікування активного та прогресуючого псоріатичного артриту у дорослих пацієнтів, які не мали адекватної відповіді на попередню терапію ХМПРП.
Адалімумаб уповільнював темпи прогресування пошкодження периферичних суглобів, що було підтверджено рентгенографічно, у пацієнтів із симетричною поліартикулярною формою захворювання та покращував функціональний стан.
Бляшковий псоріаз (БП).
ХАДЛІМА показана для лікування хронічного бляшкового псоріазу середнього та тяжкого ступеня у дорослих пацієнтів, які потребують системної терапії.
Гнійний гідраденіт (ГГ).
ХАДЛІМА показана для лікування гнійного гідраденіту (acne inversa) помірного та високого ступеня активності у дорослих пацієнтів, які не мали адекватної відповіді на традиційну системну терапію ГГ (див. розділ «Фармакологічні властивості. Фармакодинаміка»).
Хвороба Крона (ХК).
ХАДЛІМА показана для лікування хвороби Крона помірного та високого ступеня активності у дорослих пацієнтів, які не мали адекватної відповіді на традиційну терапію, включаючи терапію кортикостероїдами та/або імуносупресантами, або при наявності непереносимості чи медичних протипоказань до таких видів терапій.
Виразковий коліт (ВК).
ХАДЛІМА показана для лікування виразкового коліту помірного та високого ступеня активності у дорослих пацієнтів, які не мали адекватної відповіді на традиційну терапію, включаючи терапію кортикостероїдами та/або 6-меркаптопурином чи азатіоприном, або при наявності непереносимості чи медичних протипоказань до таких видів терапій.
Увеїт.
ХАДЛІМА показана для лікування неінфекційного інтермедіарного, заднього увеїту та панувеїту у дорослих пацієнтів, які не мали адекватної відповіді на терапію кортикостероїдами, при необхідності знизити дозу кортикостероїдів або при наявності непереносимості чи медичних протипоказань до терапії кортикостероїдами.
В педіатрії
Застосування лікарського засобу ХАДЛІМА у вигляді попередньо наповненого одноразового шприца та попередньо наповненої одноразової ручки для дітей, яким потрібна доза менше 40 мг, неможливе.
Ювенільний ідіопатичний артрит (ЮІА).
Поліартикулярний ювенільний ідіопатичний артрит (пЮІА).
Адалімумаб в комбінації з метотрексатом показаний для лікування активного поліартикулярного ювенільного ідіопатичного артриту у дітей віком від 2 років, які не мали адекватної відповіді на терапію одним або кількома ХМПРП. Адалімумаб можна застосовувати як монотерапію у разі непереносимості метотрексату або коли подальше лікування метотрексатом є неприйнятним. Не було проведено досліджень застосування адалімумабу у дітей віком до 2 років.
Ентезитасоційований артрит.
Адалімумаб показаний для лікування активного ентезитасоційованого артриту у дітей віком від 6 років, які не мали адекватної відповіді або при наявності непереносимості традиційної терапії.
Бляшковий псоріаз (БП) у дітей.
Адалімумаб показаний для лікування хронічного бляшкового псоріазу тяжкого ступеня у дітей віком від 4 років, які не мали адекватної відповіді або при наявності протипоказань до місцевої терапії та фототерапії.
Гнійний гідраденіт (ГГ) у підлітків.
Адалімумаб показаний для лікування гнійного гідраденіту (acne inversa) помірного та високого ступеня активності у підлітків віком від 12 років, які не мали адекватної відповіді на традиційну системну терапію ГГ (див. розділ «Фармакологічні властивості. Фармакодинаміка»).
Хвороба Крона (ХК) у дітей.
Адалімумаб показаний для лікування хвороби Крона помірного та високого ступеня активності у дітей віком від 6 років, які не мали адекватної відповіді на традиційну терапію, включаючи первинну дієтотерапію, терапію кортикостероїдами та/або імуномодуляторами, або при наявності непереносимості чи протипоказань до таких видів терапій.
Виразковий коліт (ВК) у дітей.
Адалімумаб показаний для лікування виразкового коліту помірного та високого ступеня активності у дітей віком від 6 років, які не мали адекватної відповіді на традиційну терапію, включаючи терапію кортикостероїдами та/або 6-меркаптопурином чи азатіоприном, або при наявності непереносимості чи медичних протипоказань до таких видів терапій.
Увеїт у дітей.
Адалімумаб показаний для лікування хронічного неінфекційного переднього увеїту у дітей віком від 2 років, які не мали адекватної відповіді або при наявності непереносимості, або для яких традиційна терапія є неприйнятною.
Протипоказання.
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин лікарського засобу.
Активний туберкульоз або інші тяжкі інфекції, такі як сепсис та опортуністичні інфекції (див. розділ «Особливості застосування»).
Серцева недостатність середнього або тяжкого ступеня (ІІІ або IV функціональний клас за класифікацією NYHA [Нью-Йоркської Асоціації Кардіологів]) (див. розділ «Особливості застосування»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дію адалімумабу вивчали у пацієнтів із ревматоїдним артритом, поліартикулярним ювенільним ідіопатичним артритом та псоріатичним артритом, що отримували лікарський засіб як монотерапію або одночасно з метотрексатом. При одночасному застосуванні адалімумабу і метотрексату у 21 пацієнта з ревматоїдним артритом жодних статистично значущих змін у профілях концентрації метотрексату в сироватці крові не виявлено. Для порівняння, при одноразовому і багаторазовому застосуванні метотрексату зменшується кліренс адалімумабу на 29 % і 44 % відповідно. Однак зміна дози адалімумабу або метотрексату не потрібна. Рівень формування антитіл був нижчим при одночасному застосуванні адалімумабу з метотрексатом порівняно з монотерапією. Введення адалімумабу без метотрексату призводило до збільшення утворення антитіл, збільшення кліренсу та зниження ефективності адалімумабу.
Взаємодія між адалімумабом і іншими препаратами (крім метотрексату) не вивчалася у фармакокінетичних дослідженнях. У клінічних дослідженнях не спостерігалося ніяких взаємодій при застосуванні адалімумабу з хворобомодифікуючими протиревматичними препаратами (ХМПРП) (сульфасалазин, гідрохлорохін, лефлуномід та препарати золота), з глюкокортикоїдами, саліцилатами, нестероїдними протизапальними препаратами (НПЗП) або аналгетиками.
Не рекомендується одночасне застосування лікарського засобу ХАДЛІМА й анакінри (див. розділ «Особливості застосування»).
Не рекомендується одночасне застосування лікарського засобу ХАДЛІМА й абатацепту (див. розділ «Особливості застосування»).
Особливості застосування.
Відстежуваність.
З метою покращення відстежуваності біологічних лікарських засобів слід чітко вказувати торгову назву та номер серії введеного лікарського засобу.
Інфекції.
Пацієнти, які приймають інгібітори ФНП, більш схильні до виникнення тяжких інфекцій. Порушення функції легенів збільшує ризик виникнення інфекцій. Тому слід ретельно спостерігати за пацієнтами щодо наявності інфекцій, включаючи туберкульоз, до, під час та після лікування лікарським засобом ХАДЛІМА. Оскільки елімінація адалімумабу може відбуватися протягом чотирьох місяців, спостереження слід продовжувати протягом цього періоду.
Не слід розпочинати терапію лікарським засобом ХАДЛІМА у пацієнтів із активним інфекційним процесом, включаючи хронічні або локальні інфекції, поки інфекція не буде контрольованою. У пацієнтів, які перенесли туберкульоз або повернулися з країн із високим рівнем захворюваності на туберкульоз чи ендемічних мікозів, таких як гістоплазмоз, кокцидіоїдомікоз або бластомікоз, слід оцінити співвідношення користь/ризик перед початком застосування лікарського засобу ХАДЛІМА (див. нижче «Інші опортуністичні інфекції»).
Слід пройти повне діагностичне обстеження та ретельно спостерігати за пацієнтами, в яких під час лікування лікарським засобом ХАДЛІМА розвинулася нова інфекція. Лікування лікарським засобом ХАДЛІМА слід припинити у разі виникнення тяжкої інфекції або сепсису і розпочати відповідну протимікробну або протигрибкову терапію, поки інфекція не буде контрольованою. Лікарям слід проявляти обережність, розглядаючи питання про застосування лікарського засобу ХАДЛІМА пацієнтам із повторною інфекцією в анамнезі або з основними захворюваннями, які можуть спричинити розвиток інфекцій, включаючи одночасне застосування імуносупресантів.
Тяжкі інфекції.
Повідомлялося про тяжкі інфекції, включаючи сепсис, спричинені бактеріальними, мікобактеріальними, інвазивними грибковими, паразитарними, вірусними та іншими опортуністичними інфекціями, такими як лістеріоз, легіонельоз та пневмоцистна пневмонія у пацієнтів, які застосовували лікарський засіб ХАДЛІМА. Інші тяжкі інфекції, виявлені в клінічних дослідженнях, включають: пневмонію, пієлонефрит, септичний артрит та септицемію. Повідомлялося про госпіталізацію або летальні наслідки, пов’язані з інфекціями.
Туберкульоз.
Повідомлялося про туберкульоз, включаючи реактивацію та нові випадки туберкульозу, у пацієнтів, які отримували адалімумаб. Повідомлення включали випадки легеневого та позалегеневого (дисемінованого) туберкульозу.
Перед початком терапії лікарським засобом ХАДЛІМА пацієнтів слід обстежити на наявність активного та неактивного (латентного) туберкульозу. Обстеження повинно включати детальну медичну оцінку анамнезу пацієнта з туберкульозом або відомості про можливий попередній контакт із хворими на активний туберкульоз, а також про попередню та/або супутню імуносупресивну терапію. Відповідні скринінгові тести (наприклад, шкірний туберкуліновий тест (проба Манту) та рентгенографія органів грудної клітки) слід проводити всім пацієнтам відповідно до вимог чинного законодавства. Рекомендовано відображати проведення цих тестів у картці нагадування пацієнта. Слід враховувати ризик отримання хибнонегативних результатів шкірного туберкулінового тесту, особливо у тяжкохворих пацієнтів або у пацієнтів із ослабленим імунітетом.
Терапію лікарським засобом ХАДЛІМА не слід розпочинати, якщо діагностовано активний туберкульоз (див. розділ «Протипоказання»).
У всіх описаних нижче ситуаціях слід особливо ретельно оцінити співвідношення користь/ризик перед початком терапії.
При підозрі на латентний туберкульоз слід проконсультуватися з лікарем, який має досвід у лікуванні туберкульозу.
У разі діагностування латентного туберкульозу перед початком терапії лікарським засобом ХАДЛІМА слід розпочати відповідне протитуберкульозне профілактичне лікування відповідно до вимог чинного законодавства.
Також слід врахувати можливість протитуберкульозного профілактичного лікування перед початком застосування лікарського засобу ХАДЛІМА у пацієнтів із декількома або значною кількістю факторів ризику туберкульозу, незважаючи на негативний результат тесту на туберкульоз, а також у пацієнтів з латентним або активним туберкульозом в анамнезі, для яких відповідне лікування є неприйнятним. Рішення про початок протитуберкульозного лікування для таких пацієнтів приймають після консультації з лікарем, який має досвід у лікуванні туберкульозу, та оцінки ризику розвитку латентного туберкульозу і безпеки протитуберкульозного лікування.
Незважаючи на профілактичне лікування, випадки реактивації туберкульозу спостерігалися у пацієнтів, які отримували лікарський засіб ХАДЛІМА. У деяких пацієнтів, які раніше успішно перенесли лікування активного туберкульозу, спостерігався повторний розвиток туберкульозу під час лікування лікарським засобом ХАДЛІМА.
Під час застосування лікарського засобу ХАДЛІМА пацієнтів слід оглядати щодо появи симптомів активного туберкульозу, особливо з огляду на можливість отримання псевдонегативних результатів тестів на латентний туберкульоз (зокрема у тяжких хворих і в імуноскомпрометованих пацієнтів).
Пацієнтам слід звернутися до лікаря за консультацією, якщо під час або після терапії лікарським засобом ХАДЛІМА виникають ознаки/симптоми, що свідчать про туберкульозну інфекцію (наприклад, постійний кашель, зменшення маси тіла, субфебрильна температура, апатія).
Інші опортуністичні інфекції.
У пацієнтів, які отримували адалімумаб, повідомлялося про розвиток опортуністичних інфекцій, включаючи інвазивні грибкові інфекції. У пацієнтів, які отримували інгібітори ФНП, такі інфекції своєчасно не діагностувалися, що призводило до пізнього початку відповідного лікування та іноді до летального наслідку. Пацієнти, які застосовують інгібітори ФНП, більш схильні до розвитку серйозних грибкових інфекцій, таких як гістоплазмоз, кокцидіоїдомікоз, бластомікоз, аспергільоз, кандидоз тощо.
Усім пацієнтам у разі виникнення лихоманки, нездужання, зменшення маси тіла, підвищення пітливості, кашлю, задишки та/або інфільтратів у легенях або інших симптомів серйозного системного захворювання, з ознаками шоку або без, слід негайно обстежитися для виявлення збудників опортуністичних інфекцій та припинити застосування лікарського засобу ХАДЛІМА. Діагностичне обстеження та призначення емпіричної протигрибкової терапії у цих пацієнтів слід проводити після консультації з лікарем, який має досвід у лікуванні інвазивних грибкових інфекцій. Через існування підвищеного ризику розвитку гістоплазмозу або інших інвазивних грибкових інфекцій слід проводити емпіричну протигрибкову терапію до визначення збудника. У деяких пацієнтів результати тесту на виявлення гістоплазмозного антигену або антитіл могли бути негативними навіть при активній інфекції. Якщо потрібно, рішення щодо застосування емпіричної протигрибкової терапії таким хворим слід приймати після консультації зі спеціалістом у сфері діагностики та лікування інвазивних грибкових інфекцій, зважаючи на ризик розвитку грибкової інфекції, а також ризик внаслідок застосування протигрибкової терапії. Рекомендовано припинити застосування інгібітора ФНП у разі розвитку тяжкої грибкової інфекції, поки інфекція не буде контрольованою.
Реактивація гепатиту В.
Застосування інгібіторів ФНП, включаючи адалімумаб, пов’язувалося з реактивацією вірусу гепатиту В (ВГВ) у пацієнтів, які є хронічними носіями цього вірусу (тобто позитивний результат тесту на поверхневий антиген вірусу гепатиту В). У деяких випадках терапія була летальною. Перед початком лікування лікарським засобом ХАДЛІМА пацієнтів слід обстежити на наявність ознак ВГВ. Пацієнтам із позитивним результатом тесту на інфекцію гепатиту В слід проконсультуватися з лікарем, який має досвід у лікуванні гепатиту В.
За пацієнтами, які є носіями ВГВ і потребують лікування лікарським засобом ХАДЛІМА, слід ретельно спостерігати на наявність ознак та симптомів розвитку активної інфекції ВГВ протягом усього періоду терапії і протягом декількох місяців після її припинення. Немає достатніх даних щодо застосування пацієнтам, які є носіями ВГВ, противірусної терапії у комбінації з терапією інгібіторами ФНП із метою профілактики реактивації ВГВ. У пацієнтів, у яких розвивається реактивація ВГВ, слід припинити терапію лікарським засобом ХАДЛІМА та розпочати ефективну противірусну терапію з відповідним підтримувальним лікуванням.
Неврологічні розлади.
При застосуванні інгібіторів ФНП, включаючи адалімумаб, повідомлялося про поодинокі випадки появи або загострення клінічних симптомів та/або радіографічних ознак демієлінізуючого захворювання центральної нервової системи (ЦНС), включаючи розсіяний склероз, неврит зорового нерва, а також демієлінізуючого захворювання периферичної нервової системи, включаючи синдром Гієна ¾ Барре. Лікарям слід бути обережними при перегляді необхідності застосування лікарського засобу ХАДЛІМА для пацієнтів із наявними або нещодавно виниклими демієлінізуючими порушеннями центральної чи периферичної нервової системи, а у разі виникнення зазначених розладів терапію лікарським засобом ХАДЛІМА слід припинити. Відомо, що існує зв’язок між інтермедіарним увеїтом і демієлінізуючими розладами ЦНС. Неврологічне обстеження слід проводити у пацієнтів із неінфекційним інтермедіарним увеїтом перед початком терапії лікарським засобом ХАДЛІМА та регулярно протягом терапії з метою оцінки наявних ознак або розвитку демієлінізуючих розладів ЦНС.
Алергічні реакції.
Під час клінічних досліджень повідомлялося про поодинокі випадки серйозних алергічних реакцій, пов’язаних із застосуванням адалімумабу. Під час клінічних досліджень випадки несерйозних алергічних реакцій, пов’язаних із застосуванням адалімумабу, були нечастими. Повідомлялося про серйозні алергічні реакції, включаючи анафілаксію, після введення адалімумабу. У разі виникнення анафілактичної реакції або іншої серйозної алергічної реакції слід негайно припинити застосування лікарського засобу ХАДЛІМА та розпочати відповідну терапію.
Імуносупресія.
Під час клінічних досліджень за участю 64 пацієнтів із ревматоїдним артиритом, які отримували адалімумаб, випадків пригнічення гіперчутливості сповільненого типу, зниження рівня імуноглобулінів або кількісних змін ефекторних Т-, В- та NK-клітин, моноцитів/макрофагів і нейтрофілів не спостерігалося.
Злоякісні новоутворення та лімфопроліферативні розлади.
У контрольованих клінічних дослідженнях інгібіторів ФНП частіше повідомлялося про розвиток злоякісних новоутворень, включаючи лімфому, у пацієнтів, які отримували інгібітори ФНП, включаючи адалімумаб, ніж у пацієнтів контрольної групи. Однак такі явища були рідкісними. У ході післяреєстраційного застосування лікарського засобу повідомлялося про випадки лейкемії у пацієнтів, які отримували інгібітор ФНП. До того у пацієнтів із довготривалим високоактивним запальним ревматоїдним артритом існує високий фоновий ризик виникнення лімфоми та лейкемії, що ускладнює оцінку ризику. Однак не можна виключати ризик розвитку лімфом, лейкемії або інших злоякісних новоутворень у пацієнтів, які отримують інгібітор ФНП.
У ході післяреєстраційного застосування лікарського засобу також повідомлялося про окремі випадки розвитку злоякісних новоутворень із летальним наслідком у дітей, підлітків та молодих людей (віком до 22 років), які отримували лікування інгібіторами ФНП (початок терапії до 18 років), включаючи адалімумаб. Приблизно половина з цих випадків були лімфоми, включаючи ходжкінську та неходжкінську. Інші випадки були представлені різними видами злоякісних новоутворень і включали поодинокі випадки злоякісних новоутворень, які зазвичай пов’язані з імуносупресією. Тому не можна виключати ризик розвитку злоякісних новоутворень у дітей та підлітків, які отримують інгібітори ФНП.
У ході післяреєстраційного застосування лікарського засобу повідомлялося про поодинокі випадки гепатолієнальної Т-клітинної лімфоми у пацієнтів, які отримували адалімумаб. Цей рідкісний тип Т-клітинної лімфоми характеризується дуже агресивним перебігом захворювання та зазвичай має летальні наслідки. Деякі з цих пацієнтів раніше отримували терапію адалімумабом одночасно з азатіоприном або 6-меркаптопурином для лікування запальних захворювань кишечника. Слід ретельно оцінити потенційний ризик одночасного застосування азатіоприну або 6-меркаптопурину з адалімумабом. Не можна виключати ризик розвитку гепатолієнальної Т-клітинної лімфоми у пацієнтів, які отримують лікарський засіб ХАДЛІМА (див. розділ «Побічні реакції»).
Досліджень щодо застосування адалімумабу пацієнтам зі злоякісними новоутвореннями в анамнезі або продовження лікування у пацієнтів, у яких розвинулося злоякісне новоутворення, не проводилося. Тому слід з особливою обережністю приймати рішення щодо застосування лікарського засобу ХАДЛІМА таким пацієнтам (див. розділ «Побічні реакції»).
Всіх пацієнтів, зокрема тих, які в анамнезі мають довготривалу імуносупресивну терапію, або пацієнтів із бляшковим псоріазом, яким проводили PUVA-терапію (псорален у поєднанні з УФ-опроміненням променями довгохвильового спектра), слід обстежити на наявність немеланомного раку шкіри до та протягом лікування лікарським засобом ХАДЛІМА. Також повідомлялося про меланому та карциному Меркеля у пацієнтів, які отримували інгібітори ФНП, включаючи адалімумаб (див. розділ «Побічні реакції»).
У ході пошукового клінічного дослідження, в якому оцінювалося застосування іншого інгібітору ФНП (інфліксимабу), у пацієнтів із середнім та тяжким хронічним обструктивним захворюванням легенів (ХОЗЛ), які отримували інфліксимаб, повідомлялося про підвищення частоти виникнення злоякісних новоутворень, переважно в легенях, голові та шиї, порівняно з контрольною групою пацієнтів. У всіх пацієнтів в анамнезі було надмірне паління. Тому слід із обережністю застосувати будь-які інгібітори ФНП пацієнтам із ХОЗЛ, а також пацієнтам із підвищеним ризиком виникнення злоякісних новоутворень внаслідок надмірного паління.
На цей час невідомо, чи впливає застосування адалімумабу на ризик розвитку дисплазії або раку товстого кишечника. Усіх пацієнтів із виразковим колітом, у яких підвищений ризик розвитку дисплазії чи раку товстого кишечника (наприклад, пацієнти з довготривалим виразковим колітом або первинним склерозуючим холангітом), або пацієнтів, які в анамнезі мали дисплазію чи рак товстого кишечника, слід обстежити на наявність дисплазії перед початком терапії та спостерігати протягом усього періоду захворювання. Таке обстеження має включати колоноскопію та біопсію відповідно до вимог чинного законодавства.
Гематологічні реакції.
Повідомлялося про поодинокі випадки панцитопенії, включаючи апластичну анемію при застосуванні інгібіторів ФНП. Повідомлялося про побічні реакції з боку крові, включаючи розвиток цитопенії (наприклад, тромбоцитопенії та лейкопенії), що мала клінічне значення, при застосуванні адалімумабу. Пацієнтам слід негайно звернутися до лікаря у разі виникнення ознак та симптомів, що свідчать про дискразію крові (наприклад, персистуюча лихоманка, синці, кровотечі, блідість) під час лікування лікарським засобом ХАДЛІМА. Слід розглянути необхідність припинення терапії лікарським засобом ХАДЛІМА у пацієнтів із підтвердженими серйозними порушеннями з боку крові.
Вакцинація.
У дослідженні за участю 226 дорослих пацієнтів із ревматоїдним артритом, які отримували адалімумаб або плацебо, спостерігалися подібні відповіді антитіл на стандартну 23-валентну пневмококову вакцину та 3-валентну вакцину проти вірусу грипу.
Немає даних щодо вторинної передачі інфекції живими вакцинами у пацієнтів, які отримують адалімумаб.
Рекомендується, щоб перед початком терапії адалімумабом діти по можливості отримали всі щеплення у відповідності до чинних вказівок щодо імунізації.
Пацієнти, які отримують адалімумаб, можуть одночасно проходити вакцинацію, за винятком застосування живих вакцин. Застосування живих вакцин (наприклад, вакцини БЦЖ) немовлятам, які піддавалися впливу адалімумабу внутрішньоутробно, не рекомендується протягом 5 місяців після останньої ін’єкції адалімумабу матері в період вагітності.
Хронічна серцева недостатність.
У ході клінічного дослідження з іншим інгібітором ФНП спостерігалося загострення хронічної серцевої недостатності та збільшення летальних наслідків внаслідок хронічної серцевої недостатності. Також повідомлялося про випадки загострення хронічної серцевої недостатності у пацієнтів, які отримували адалімумаб. Лікарський засіб ХАДЛІМА слід з обережністю застосовувати пацієнтам із серцевою недостатністю легкого ступеня (I або II функціональний клас за класифікацією NYHA). ХАДЛІМА протипоказана при серцевій недостатності середнього або тяжкого ступеня (див. розділ «Протипоказання»). Лікування лікарським засобом ХАДЛІМА слід припинити у разі появи нових симптомів або загострення симптомів хронічної серцевої недостатності.
Аутоімунні процеси.
Лікування лікарським засобом ХАДЛІМА може спричинити утворення аутоантитіл. Вплив довготривалого лікування адалімумабом на розвиток аутоімунного захворювання невідомий. У разі виникнення симптомів, що вказують на вовчакоподібний синдром, після застосування лікарського засобу ХАДЛІМА та отримання позитивного результату на антитіла до дволанцюгової ДНК подальше лікування слід припинити (див. розділ «Побічні реакції»).
Одночасне введення біологічних ХМПРП або інгібіторів ФНП.
Спостерігалися тяжкі інфекції під час клінічних досліджень одночасного застосування анакінри й іншого інгібітора ФНП, етанерцепту, що не мало клінічної користі в порівнянні з монотерапією етанерцептом. З огляду на характер побічних реакцій, що спостерігалися при одночасній терапії етанерцептом і анакінрою, подібні побічні реакції можуть також виникати при комбінації анакінри й інших інгібіторів ФНП. Тому одночасне застосування адалімумабу й анакінри не рекомендується (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Одночасне застосування адалімумабу з іншими біологічними ХМПРП (наприклад з анакінрою та абатацептом) або іншими інгібіторами ФНП не рекомендується, зважаючи на підвищення ризику виникнення інфекцій, включаючи тяжкі інфекції та інші потенційні фармакологічні взаємодії (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Хірургічні втручання.
Доступні обмежені дані щодо безпеки хірургічних процедур у пацієнтів, які отримують адалімумаб. При плануванні хірургічної процедури слід враховувати довготривалий період напіввиведення адалімумабу. Пацієнта, який потребує хірургічного втручання під час прийому адалімумабу, слід ретельно обстежити на наявність інфекцій та вжити відповідних заходів. Доступні обмежені дані щодо безпеки застосування адалімумабу пацієнтам, які піддавались артропластиці.
Непрохідність тонкої кишки.
Відсутність відповіді на лікування хвороби Крона може свідчити про наявність фіксованої фіброзної стриктури, яка вимагає хірургічного втручання. Доступні дані свідчать про те, що адалімумаб не спричиняє виникнення або прогресування стриктур.
Пацієнти літнього віку.
Частота розвитку тяжких інфекцій у пацієнтів віком від 65 років (3,7 %), які отримували адалімумаб, була вищою, порівняно з пацієнтами віком до 65 років (1,5 %). Деякі випадки були летальними. Слід особливо зважати на ризик виникнення інфекцій при лікуванні пацієнтів літнього віку.
Діти.
Див. підрозділ «Вакцинація» вище.
Допоміжні речовини з відомими ефектами.
Цей лікарський засіб містить 20 мг сорбіту (Е 420) в кожному попередньо наповненому одноразовому шприці / попередньо наповненій одноразовій ручці. Якщо у Вас встановлена непереносимість деяких цукрів, проконсультуйтеся з лікарем, перш ніж приймати цей лікарський засіб.
Цей лікарський засіб містить менше 1 ммоль (23 мг)/0,8 мл натрію, тобто практично вільний від натрію.
Застосування в період вагітності або годування груддю.
Жінки репродуктивного віку.
Для запобігання вагітності жінкам репродуктивного віку слід використовувати надійні методи контрацепції під час лікування та протягом щонайменше п’яти місяців після введення останньої дози лікарського засобу ХАДЛІМА.
Вагітність.
В результаті проспективного аналізу даних щодо застосування адалімумабу під час вагітності (приблизно 2100 випадків вагітностей, що завершилися народженням живих дітей, в тому числі більше ніж у 1500 випадків застосування лікарського засобу протягом першого триместру) збільшення частоти виникнення вад розвитку у новонароджених не було виявлено.
У проспективний когортний реєстр було включено 257 жінок із ревматоїдним артритом (РА) або хворобою Крона (ХК), які отримували адалімумаб щонайменше протягом першого триместру, а також 120 жінок із РА або ХК, які не отримували адалімумаб. Первинною кінцевою точкою була частота розвитку значних вроджених вад у новонародженого. Частота випадків вагітностей, які завершилися народженням принаймні однієї живої дитини зі значною вродженою вадою, становила 6 з 69 (8,7 %) у групі жінок із РА, які отримували адалімумаб, та 5 з 74 (6,8 %) ¾ у групі жінок із РА, які не застосовували лікарський засіб (нескориговане відношення шансів [ВШ] ¾ 1,31, 95 % довірчий інтервал [ДІ] ¾ 0,38-4,52). У групі жінок із ХК, які отримували адалімумаб, частота таких випадків становила 16 з 152 (10,5 %), а у групі жінок із ХК, які не застосовували лікарський засіб, відповідно 3 з 32 (9,4 %) (нескориговане ВШ ¾ 1,14, 95 % ДІ ¾ 0,31-4,16). В об’єднаній групі жінок із РА та ХК скориговане ВШ (з поправкою на відмінності на вихідному рівні) становило 1,10 (95 % ДІ ¾ 0,45-2,73). Між жінками, які застосовували та не застосовували адалімумаб, не було виявлено чітко виражених відмінностей щодо вторинних кінцевих точок у вигляді спонтанних абортів, незначних вроджених вад, передчасних пологів, маси тіла та зросту новонароджених і тяжких або опортуністичних інфекцій, а також не було зареєстровано випадків мертвонародження або розвитку злоякісних пухлин. На інтерпретацію даних могли впливати методологічні обмеження дослідження, включаючи малий об’єм вибірки та нерандомізований дизайн дослідження.
У дослідженні токсичності на мавпах не було виявлено ознак токсичної дії на материнський організм, а також ембріотоксичної та тератогенної дії. Доклінічні дані щодо постнатальної токсичності адалімумабу відсутні.
Оскільки адалімумаб інгібує ФНП-альфа, його застосування під час вагітності може впливати на нормальну імунну реакцію у новонародженого. Вагітним жінкам слід застосовувати адалімумаб лише у разі очевидної необхідності.
Адалімумаб може проникати через плаценту в сироватку крові новонароджених, матері яких отримували адалімумаб під час вагітності. Тому в таких новонароджених підвищений ризик виникнення інфекції. Застосування живих вакцин (наприклад, вакцини БЦЖ) немовлятам, що піддавалися впливу адалімумабу внутрішньоутробно, не рекомендується протягом 5 місяців після останньої ін’єкції адалімумабу матері в період вагітності.
Період годування груддю.
Обмежені опубліковані дані свідчать про те, що адалімумаб екскретується в грудне молоко в дуже низьких концентраціях — від 0,1 % до 1 % від рівня в сироватці матері. Враховуючи те, що білки імуноглобуліну G піддаються протеолізу в кишечнику і мають низьку біодоступність, системний вплив адалімумабу на немовлят, які знаходяться на грудному вигодовуванні, малоймовірний. Отже, адалімумаб можна застосовувати в період годування груддю.
Фертильність.
Доклінічні дані щодо впливу адалімумабу на фертильність відсутні.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
ХАДЛІМА може мати незначний вплив на швидкість реакції при керуванні автотранспортом або іншими механізмами. Застосування лікарського засобу ХАДЛІМА може спричинити виникнення вертиго та порушення гостроти зору (див. розділ «Побічні реакції»).
Спосіб застосування та дози.
Терапію лікарським засобом ХАДЛІМА повинен призначати лікар, який має досвід у діагностуванні та терапії захворювань, при яких показана ХАДЛІМА. Офтальмологам рекомендовано проконсультуватися з відповідним спеціалістом перед тим, як призначати терапію лікарським засобом ХАДЛІМА (див. розділ «Особливості застосування»).
Пацієнти, які застосовують лікарський засіб ХАДЛІМА, повинні отримати картку нагадування пацієнта. Лікарський засіб ХАДЛІМА можна вводити самостійно тільки в разі, якщо пацієнт або батьки дитини, якій призначена терапія лікарським засобом ХАДЛІМА, пройшли відповідний інструктаж у лікаря щодо техніки проведення ін’єкції і лікар підтвердив, що це можливо.
Під час лікування лікарським засобом ХАДЛІМА інші супутні види терапії (наприклад, терапію кортикостероїдами та/або імуномодулюючими препаратами) слід оптимізувати.
Дозування
Ревматоїдний артрит.
Рекомендована доза лікарського засобу ХАДЛІМА для дорослих пацієнтів із ревматоїдним артритом становить 40 мг у вигляді одноразової дози 1 раз на 2 тижні підшкірно. Слід продовжувати застосування метотрексату під час лікування лікарським засобом ХАДЛІМА.
Терапію глюкокортикоїдами, саліцилатами, нестероїдними протизапальними препаратами (НПЗП) та аналгетиками може бути продовжено під час лікування лікарським засобом ХАДЛІМА. Щодо застосування інших хворобомодифікуючих протиревматичних препаратів (ХМПРП), окрім метотрексату, див. розділ «Особливості застосування».
При монотерапії для деяких пацієнтів, у яких спостерігається зниження відповіді на дозування лікарського засобу ХАДЛІМА 40 мг 1 раз на 2 тижні, може бути доцільним збільшення дозування до 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні.
Доступні дані свідчать про те, що клінічна відповідь зазвичай досягається протягом 12 тижнів терапії. Слід переглянути необхідність продовження терапії для пацієнтів, у яких протягом вказаного терміну не спостерігається клінічної відповіді на лікування.
Переривання терапії.
Слід переглянути необхідність у перериванні терапії, наприклад, перед хірургічним втручанням або у разі виникнення тяжкої інфекції.
Доступні дані свідчать про те, що після повернення до терапії адалімумабом через 70 днів або більше клінічна відповідь та профіль безпеки є подібними до тих, що були до переривання терапії.
Анкілозуючий спондиліт, аксіальний спондилоартрит без рентгенологічного підтвердження АС та псоріатичний артрит.
Рекомендована доза лікарського засобу ХАДЛІМА для пацієнтів із анкілозуючим спондилітом, аксіальним спондилоартритом без рентгенологічного підтвердження АС та псоріатичним артритом становить 40 мг адалімумабу у вигляді одноразової дози 1 раз на 2 тижні підшкірно.
Доступні дані свідчать про те, що клінічна відповідь зазвичай досягається протягом 12 тижнів лікування. Слід переглянути необхідність продовження терапії для пацієнтів, у яких протягом вказаного терміну не спостерігається клінічної відповіді на лікування.
Бляшковий псоріаз.
Рекомендована доза лікарського засобу ХАДЛІМА для дорослих пацієнтів: початкова доза — 80 мг підшкірно, а потім — починаючи через тиждень після початкової дози — 40 мг 1 раз на 2 тижні підшкірно.
Слід ретельно переглянути необхідність продовження терапії для пацієнтів, у яких протягом 16 тижнів не спостерігається клінічної відповіді на лікування.
Для пацієнтів, які не мали адекватної відповіді при застосуванні 40 мг 1 раз на 2 тижні протягом 16 тижнів терапії, може бути доцільним збільшення дозування до 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні. Доцільність терапії лікарським засобом ХАДЛІМА в дозі 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні слід ретельно переглянути для пацієнтів, які не мали адекватної відповіді. Якщо адекватну відповідь було отримано при застосуванні 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні, дозу можна поступово зменшити до 40 мг 1 раз на 2 тижні.
Гнійний гідраденіт.
Рекомендований режим дозування лікарського засобу ХАДЛІМА для дорослих пацієнтів із гнійним гідраденітом: початкова доза — 160 мг (день 1) у вигляді 4 ін’єкцій по 40 мг протягом 1 дня або у вигляді 2 ін’єкцій по 40 мг на день протягом 2 днів поспіль, потім — 80 мг через 2 тижні (день 15) у вигляді 2 ін’єкцій по 40 мг протягом 1 дня. Через 2 тижні (день 29) продовжити введення в дозі 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні у вигляді 2 ін’єкцій по 40 мг протягом 1 дня. У разі необхідності прийом антибіотиків може бути продовжений під час лікування лікарським засобом ХАДЛІМА. Також під час лікування гнійного гідраденіту лікарським засобом ХАДЛІМА рекомендовано щоденне місцеве промивання антисептиками уражених ділянок.
Слід ретельно переглянути необхідність продовження терапії більше ніж 12 тижнів для пацієнтів, у яких не спостерігається покращення.
При перериванні лікування можливе повернення до застосування лікарського засобу ХАДЛІМА в дозі 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні.
Рекомендується періодично оцінювати співвідношення користь/ризик під час довготривалого лікування.
Хвороба Крона.
Рекомендований режим індукційної дози лікарського засобу ХАДЛІМА для дорослих пацієнтів із хворобою Крона помірного та високого ступеня активності становить 80 мг на тижні 0, а потім 40 мг на тижні 2. У разі необхідності отримання більш швидкої відповіді на терапію можливе застосування такої схеми лікування: 160 мг на тижні 0 у вигляді 4 ін’єкцій по 40 мг протягом 1 дня або у вигляді 2 ін’єкцій по 40 мг на день протягом 2 днів поспіль, потім — 80 мг на тижні 2 у вигляді 2 ін’єкцій по 40 мг протягом 1 дня, — але слід звернути увагу, що протягом застосування індукційної дози ризик виникнення побічних реакцій збільшується.
Після індукційної терапії рекомендована доза становить 40 мг 1 раз на 2 тижні підшкірно. Альтернативно, якщо пацієнт припинив терапію і знову з’явилися симптоми захворювання, можливе повернення до застосування лікарського засобу ХАДЛІМА. Існує обмежений досвід повторної терапії після припинення лікування більше ніж на 8 тижнів після введення попередньої дози.
Під час підтримувальної терапії дозу кортикостероїдів можна зменшити відповідно до клінічної практики.
Для деяких пацієнтів, у яких спостерігається зниження відповіді на застосування 40 мг лікарського засобу ХАДЛІМА 1 раз на 2 тижні, може бути доцільним збільшення дози до 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні.
Для деяких пацієнтів, у яких не було досягнуто клінічної відповіді протягом 4 тижнів лікування, може бути доцільним продовження підтримувальної терапії до 12 тижнів. Слід переглянути необхідність продовження терапії для пацієнтів, у яких протягом вказаного терміну не спостерігається відповіді на лікування.
Виразковий коліт.
Рекомендований режим індукційної дози лікарського засобу ХАДЛІМА для дорослих пацієнтів із виразковим колітом помірного та високого ступеня активності: 160 мг на тижні 0 у вигляді 4 ін’єкцій по 40 мг протягом 1 дня або у вигляді 2 ін’єкцій по 40 мг на день протягом 2 днів поспіль, потім — 80 мг на тижні 2 у вигляді 2 ін’єкцій по 40 мг протягом 1 дня. Після індукційної терапії рекомендована доза становить 40 мг 1 раз на 2 тижні підшкірно.
Під час підтримувальної терапії дозу кортикостероїдів можна зменшити відповідно до клінічної практики.
Для деяких пацієнтів, у яких спостерігається зниження відповіді на застосування 40 мг лікарського засобу ХАДЛІМА 1 раз на 2 тижні, може бути доцільним збільшення дози до 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні.
Доступні дані свідчать про те, що клінічна відповідь зазвичай досягається протягом 2–8 тижнів лікування. Терапію лікарським засобом ХАДЛІМА не слід продовжувати пацієнтам, у яких протягом вказаного терміну не спостерігається клінічної відповіді на лікування.
Увеїт.
Рекомендована доза лікарського засобу ХАДЛІМА для дорослих пацієнтів із увеїтом: початкова доза — 80 мг, а потім — починаючи через тиждень після початкової дози — 40 мг 1 раз на 2 тижні.
Існує обмежений досвід щодо початку лікування лише лікарським засобом ХАДЛІМА. Лікування лікарським засобом ХАДЛІМА можна розпочати в поєднанні з кортикостероїдами та/або іншими небіологічними імуномодулюючими препаратами. Дози супутньої терапії кортикостероїдами можна зменшити відповідно до клінічної практики, починаючи через 2 тижні після початку лікування лікарським засобом ХАДЛІМА. Через 2 тижні після початку комбінованої терапії поступово можна перейти на монотерапію лікарським засобом ХАДЛІМА відповідно до клінічного досвіду.
Рекомендується щорічно оцінювати співвідношення користь/ризик довготривалої терапії.
Особливі групи пацієнтів
Пацієнти літнього віку.
Для цієї групи пацієнтів коригування дози не потрібне.
Порушення функції нирок або печінки.
Застосування адалімумабу таким групам пацієнтів не вивчалося, тому рекомендації щодо зміни дозування відсутні.
В педіатрії.
ХАДЛІМА у вигляді попередньо наповненого одноразового шприца та попередньо наповненої одноразової ручки доступна лише в дозі 40 мг. Тому застосування лікарського засобу ХАДЛІМА у вигляді попередньо наповненого одноразового шприца та попередньо наповненої одноразової ручки для дітей, яким потрібна доза менше 40 мг, неможливе. У разі необхідності отримання альтернативної дози слід застосовувати інші доступні лікарські форми.
Ювенільний ідіопатичний артрит.
Поліартикулярний ювенільний ідіопатичний артрит.
Рекомендована доза лікарського засобу ХАДЛІМА для дітей із поліартикулярним ювенільним ідіопатичним артритом із масою тіла 30 кг та більше становить 40 мг 1 раз на 2 тижні підшкірно.
Доступні дані свідчать про те, що клінічна відповідь зазвичай досягається протягом 12 тижнів лікування. Слід переглянути необхідність продовження терапії для дітей, у яких протягом вказаного терміну не спостерігається відповіді на лікування.
Адалімумаб не застосовують за цим показанням дітям віком до 2 років.
Ентезитасоційований артрит.
Рекомендована доза лікарського засобу ХАДЛІМА для дітей із ентезитасоційованим артритом із масою тіла 30 кг та більше становить 40 мг 1 раз на 2 тижні підшкірно.
Застосування адалімумабу дітям віком до 6 років із ентезитасоційованим артритом не вивчалося.
Бляшковий псоріаз у дітей.
Рекомендована доза лікарського засобу ХАДЛІМА для дітей із бляшковим псоріазом із масою тіла 30 кг та більше: початкова доза — 40 мг підшкірно, а потім — починаючи через тиждень після початкової дози — 40 мг 1 раз на 2 тижні підшкірно.
Слід ретельно переглянути необхідність продовження терапії для дітей, у яких протягом 16 тижнів не спостерігається відповіді на лікування.
Якщо призначено повторну терапію лікарським засобом ХАДЛІМА, необхідно дотримуватись схеми лікування, зазначеної вище.
Безпеку адалімумабу для дітей із бляшковим псоріазом вивчали в середньому протягом 13 місяців.
Адалімумаб не застосовують за цим показанням дітям віком до 4 років.
Гнійний гідраденіт у підлітків (з масою тіла не менше 30 кг).
Немає клінічних досліджень щодо застосування адалімумабу підліткам із гнійним гідраденітом. Дозування адалімумабу таким пацієнтам було визначено методом фармакокінетичного моделювання та симуляції (див. розділ «Фармакологічні властивості. Фармакодинаміка»).
Рекомендована доза лікарського засобу ХАДЛІМА становить 80 мг на тижні 0, потім — 40 мг 1 раз на 2 тижні, починаючи з тижня 1, підшкірно.
Для підлітків, які не мали адекватної відповіді на застосування 40 мг лікарського засобу ХАДЛІМА 1 раз на 2 тижні, може бути доцільним збільшення дози до 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні.
У разі необхідності прийом антибіотиків може бути продовжений під час лікування лікарським засобом ХАДЛІМА. Також під час лікування гнійного гідраденіту лікарським засобом ХАДЛІМА рекомендовано щоденне місцеве промивання антисептиками уражених ділянок.
Слід ретельно переглянути лікування для пацієнтів, у яких не спостерігалося покращення після 12 тижнів терапії.
При перериванні лікування можливе повернення до застосування лікарського засобу ХАДЛІМА, якщо це необхідно.
Рекомендується періодично оцінювати співвідношення користь/ризик під час довготривалого лікування.
Адалімумаб не застосовують за цим показанням дітям віком до 12 років.
Хвороба Крона у дітей.
Рекомендований режим індукційної дози лікарського засобу ХАДЛІМА для дітей із хворобою Крона з масою тіла 40 кг та більше становить 80 мг на тижні 0 та 40 мг на тижні 2 підшкірно.
У разі необхідності отримання більш швидкої відповіді на терапію можливе застосування такої схеми лікування: 160 мг на тижні 0 та 80 мг на тижні 2, — але слід звернути увагу, що протягом застосування індукційної дози ризик виникнення побічних реакцій збільшується.
Підтримувальна доза, починаючи з тижня 4, становить 40 мг 1 раз на 2 тижні підшкірно.
Для деяких дітей із масою тіла 40 кг та більше, які не мали адекватної відповіді, може бути доцільним збільшення дози: 40 мг 1 раз на тиждень або 80 мг 1 раз на 2 тижні.
Слід ретельно переглянути необхідність продовження терапії для дітей, у яких протягом 12 тижнів не спостерігається відповіді на лікування.
Адалімумаб не застосовують за цим показанням дітям віком до 6 років.
Виразковий коліт у дітей.
Рекомендована доза лікарського засобу ХАДЛІМА для дітей із виразковим колітом залежить від маси тіла (див. таблицю 1). Лікарський засіб ХАДЛІМА застосовують підшкірно.
Таблиця 1
Дозування лікарського засобу ХАДЛІМА для дітей із виразковим колітом
|
Маса тіла |
Індукційна доза |
Підтримувальна доза, починаючи з тижня 4* |
|
До 40 кг |
· 80 мг на тижні 0 у вигляді 2 ін’єкцій по 40 мг протягом 1 дня та · 40 мг на тижні 2 у вигляді 1 ін’єкції по 40 мг |
40 мг 1 раз на 2 тижні |
|
40 кг та більше |
· 160 мг на тижні 0 у вигляді 4 ін’єкцій по 40 мг протягом 1 дня або у вигляді 2 ін’єкцій по 40 мг на день протягом 2 днів поспіль та · 80 мг на тижні 2 у вигляді 2 ін’єкцій по 40 мг протягом 1 дня |
80 мг 1 раз на 2 тижні |
* Діти, яким виповнилось 18 років під час лікування лікарським засобом ХАДЛІМА, повинні продовжувати отримувати призначену підтримувальну дозу.
Слід ретельно переглянути необхідність продовження терапії для дітей, у яких протягом 8 тижнів не спостерігається відповіді на лікування.
Адалімумаб не застосовують за цим показанням дітям віком до 6 років.
Псоріатичний артрит, аксіальний спондилоартрит, включаючи анкілозуючий спондиліт.
Адалімумаб не застосовують за цим показанням дітям.
Увеїт у дітей.
Рекомендована доза лікарського засобу ХАДЛІМА для дітей із увеїтом із масою тіла 30 кг та більше становить 40 мг 1 раз на 2 тижні підшкірно в комбінації з метотрексатом.
Існує обмежений досвід щодо застосування адалімумабу без супутньої терапії метотрексатом у дітей.
Початкова навантажувальна доза лікарського засобу ХАДЛІМА становить 40 мг для дітей з масою тіла до 30 кг або 80 мг для дітей з масою тіла 30 кг та більше; її можна ввести за тиждень перед початком підтримувальної терапії. Немає клінічних даних щодо введення початкової навантажувальної дози адалімумабу дітям віком до 6 років (див. розділ «Фармакологічні властивості. Фармакодинаміка»).
Застосування адалімумабу дітям віком до 2 років при увеїті не обґрунтоване.
Рекомендується щорічно оцінювати співвідношення користь/ризик під час довготривалого лікування.
Спосіб введення
ХАДЛІМА призначена для застосування під наглядом лікаря.
Пацієнти можуть робити ін’єкції лікарського засобу ХАДЛІМА самостійно у разі, якщо їхній лікар визначить, що це можливо, та за умови медичного нагляду або, в разі необхідності, після проходження належного інструктажу з техніки підшкірного введення.
ХАДЛІМА випускається у вигляді попередньо наповненого одноразового шприца та попередньо наповненої одноразової ручки з дозою 40 мг.
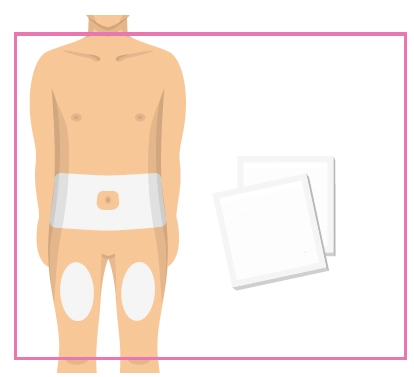
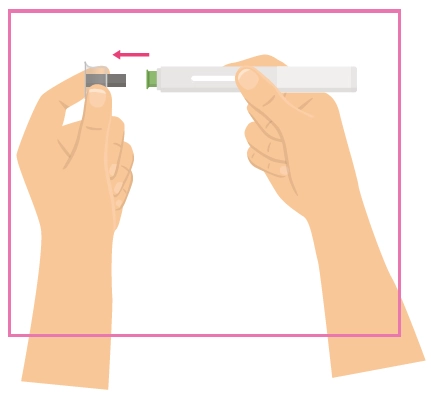
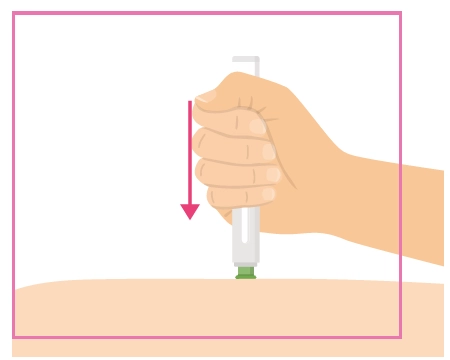
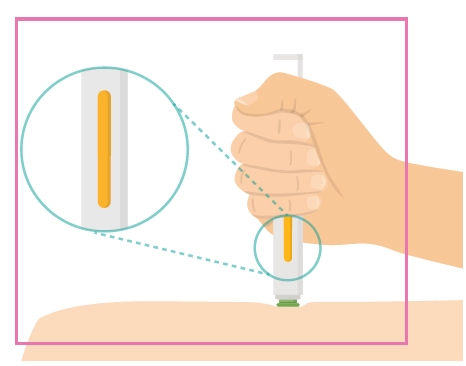
Інструкція для самостійного введення лікарського засобу ХАДЛІМА
|
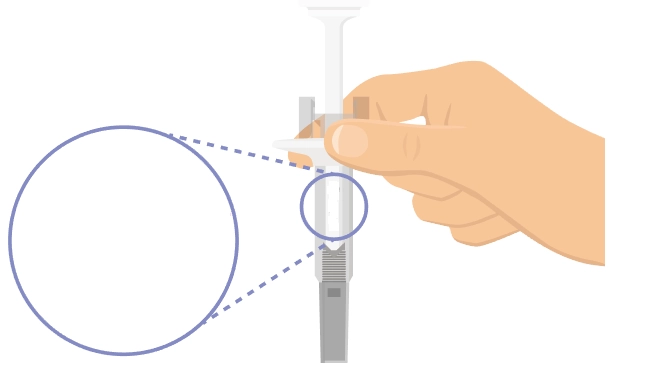
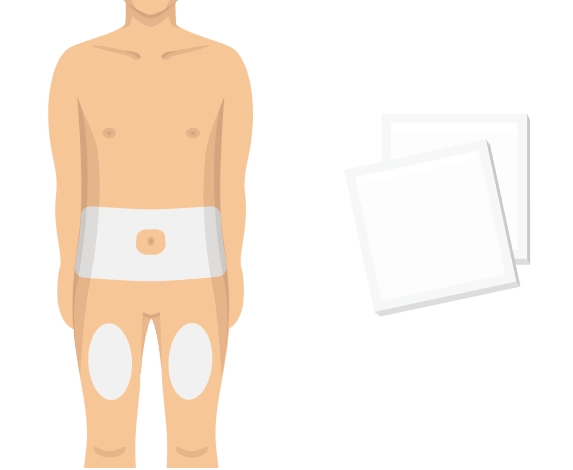
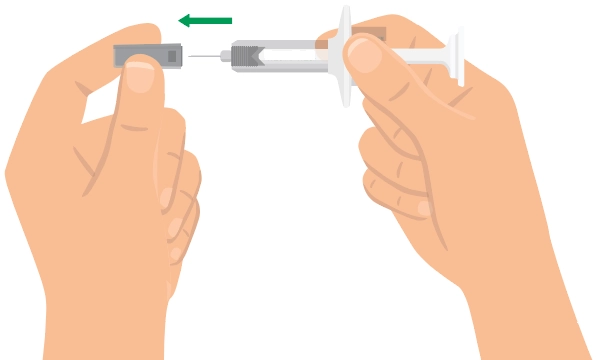
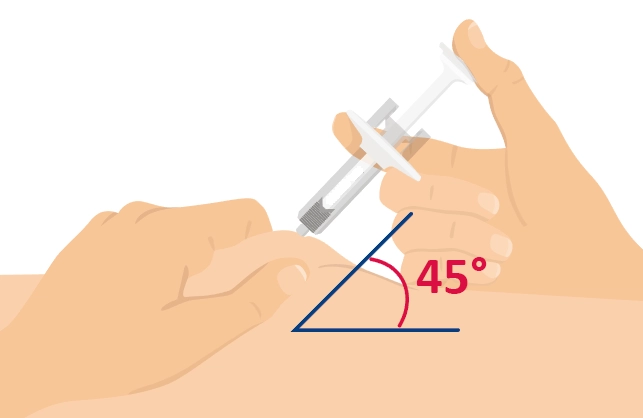
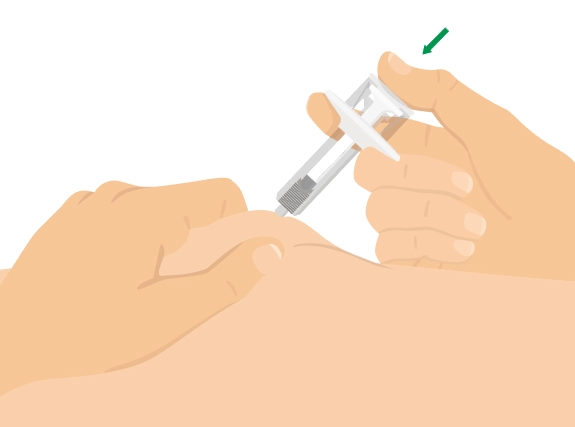
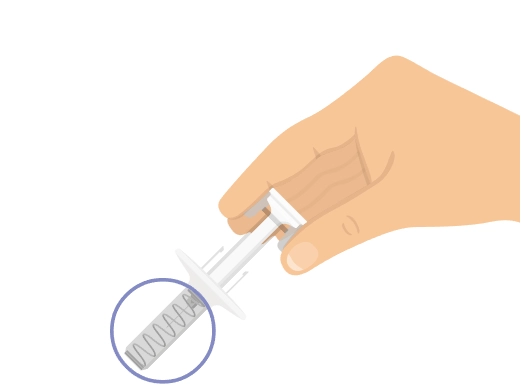
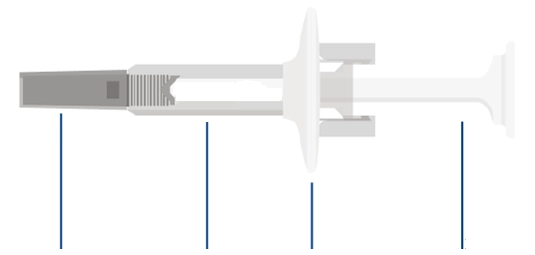
Попередньо наповнений одноразовий шприц Ця інструкція пояснює, як самостійно вводити лікарський засіб ХАДЛІМА. Будь ласка, уважно прочитайте її та виконуйте крок за кроком. Перш ніж самостійно виконувати ін’єкцію, Ваш лікар, медсестра або фармацевт повинен продемонструвати Вам, як правильно застосовувати попередньо наповнений одноразовий шприц ХАДЛІМА. Ваш лікар, медсестра або фармацевт повинні переконатися в тому, що ви можете правильно застосовувати попередньо наповнений одноразовий шприц ХАДЛІМА. Використовуйте кожен попередньо наповнений одноразовий шприц тільки для однієї ін’єкції. |
||||||||||||||||||
|
||||||||||||||||||
|
Не використовуйте попередньо наповнений одноразовий шприц та повідомте Вашого лікаря, якщо: · розчин є каламутним, змінив колір або містить механічні частинки; · закінчився термін придатності; · попередньо наповнений одноразовий шприц зламаний або пошкоджений; · попередньо наповнений одноразовий шприц впав без ковпачка. Зберігайте попередньо наповнений одноразовий шприц у холодильнику, але не заморожуйте його. Зберігайте в оригінальній упаковці для захисту від дії світла. Зберігайте в недоступному для дітей місці.
|
|
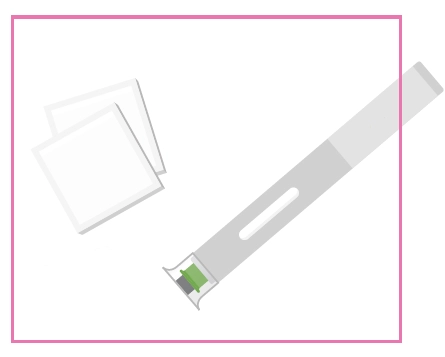
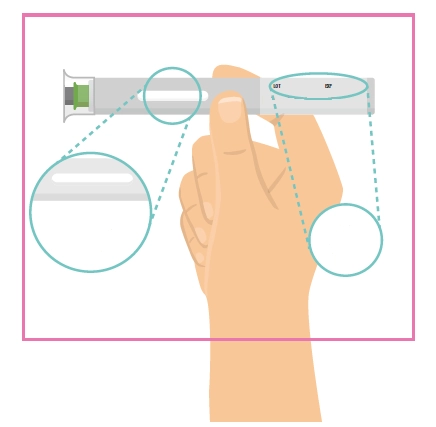
Попередньо наповнена одноразова ручка Ця інструкція пояснює, як самостійно вводити лікарський засіб ХАДЛІМА. Будь ласка, уважно прочитайте її та виконуйте крок за кроком. Перш ніж самостійно виконувати ін’єкцію, Ваш лікар, медсестра або фармацевт повинен продемонструвати Вам, як правильно застосовувати попередньо наповнену одноразову ручку ХАДЛІМА. Ваш лікар, медсестра або фармацевт повинні переконатися в тому, що ви можете правильно застосовувати попередньо наповнену одноразову ручку ХАДЛІМА. Використовуйте кожну попередньо наповнену одноразову ручку тільки для однієї ін’єкції. 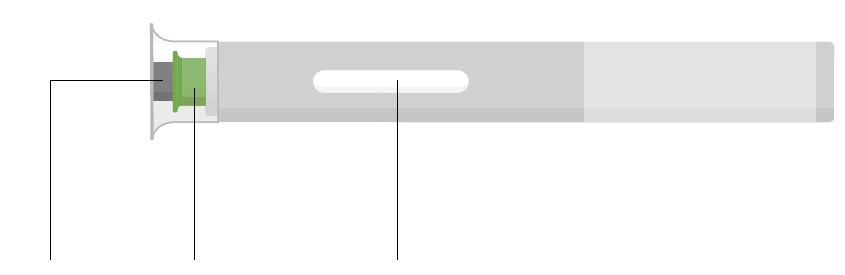
|
||||||||||||||||||||
|
Не використовуйте попередньо наповнену одноразову ручку та повідомте Вашого лікаря, якщо: · розчин є каламутним, змінив колір або містить механічні частинки; · закінчився термін придатності; · попередньо наповнена одноразова ручка зламана або пошкоджена; · попередньо наповнена одноразова ручка впала без ковпачка. Зберігайте попередньо наповнену одноразову ручку в холодильнику, але не заморожуйте її. Зберігайте в оригінальній упаковці для захисту від дії світла. Зберігайте в недоступному для дітей місці.
|
Діти.
ХАДЛІМА у вигляді попередньо наповненого одноразового шприца та попередньо наповненої одноразової ручки доступна лише в дозі 40 мг. Тому застосування лікарського засобу ХАДЛІМА у вигляді попередньо наповненого одноразового шприца та попередньо наповненої одноразової ручки для дітей, яким потрібна доза менше 40 мг, неможливе. У разі необхідності отримання альтернативної дози слід застосовувати інші доступні лікарські форми.
Безпека та ефективність застосування лікарського засобу ХАДЛІМА дітям з іншими показаннями, ніж ті, що зазначені в розділі «Показання», не встановлені.
Лікарський засіб застосовують дітям згідно з рекомендаціями, наведеними в розділі «Спосіб застосування та дози».
Передозування.
У ході клінічних досліджень адалімумабу не було виявлено випадків дозообмежувальної токсичності. Найбільшими дозами, які досліджували, були багаторазові внутрішньовенні дози 10 мг/кг, що приблизно в 15 разів перевищують рекомендовану дозу.
Побічні реакції.
Адалімумаб досліджували в основних контрольованих та відкритих дослідженнях за участю 9506 пацієнтів протягом 60 місяців та більше. У дослідженні брали участь пацієнти із раннім та довготривалим ревматоїдним артритом, ювенільним ідіопатичним артритом (поліартикулярним ювенільним ідіопатичним артритом та ентезитасоційованим артритом), а також з аксіальним спондилоартритом (анкілозуючим спондилітом, аксіальним спондилоартритом без рентгенологічного підтвердження АС), псоріатичним артритом, хворобою Крона, виразковим колітом, бляшковим псоріазом, гнійним гідраденітом та увеїтом. У основних контрольованих дослідженнях брали участь 6089 пацієнтів, які отримували адалімумаб, та 3801 пацієнт, які отримували плацебо або активний компаратор протягом контрольованого періоду.
Під час подвійно сліпого контрольованого періоду основних досліджень для всіх показань 5,9 % пацієнтів, які отримували адалімумаб, та 5,4 % пацієнтів контрольної групи припинили лікування через побічні реакції.
Найчастіше повідомлялося про виникнення побічних реакцій у вигляді інфекцій (таких як назофарингіт, інфекції верхніх дихальних шляхів та синусит), реакцій у місці введення (почервоніння, свербіж, геморагії, біль або набряк), головний біль та скелетно-м’язовий біль.
Повідомлялося про тяжкі побічні реакції адалімумабу. Інгібітори ФНП, такі як адалімумаб, впливають на імунну систему, а їх застосування може спричинити зниження опірності організму до інфекцій та раку.
Під час застосування адалімумабу також повідомлялося про виникнення інфекцій, які можуть становити загрозу життю людини та призвести до летального наслідку (включаючи сепсис, опортуністичні інфекції та туберкульоз), про реактивацію вірусу гепатиту В та виникнення різних новоутворень (включаючи лейкемію, лімфому та гепалієнальну Т-клітинну лімфому).
Також повідомлялося про серйозні гематологічні, неврологічні та аутоімунні реакції, а саме: поодинокі випадки панцитопенії, апластичної анемії, випадки центральних та периферичних демієлінізуючих розладів, виникнення вовчака, вовчакоподібних станів та синдрому Стівенса — Джонсона.
Побічні реакції, які спостерігалися протягом клінічних досліджень та післяреєстраційного застосування адалімумабу, представлені за системами органів та частотою: дуже часті (≥ 1/10); часті (від ≥ 1/100 до <1/10); нечасті (від ≥ 1/1000 до <1/100); поодинокі (від ≥ 1/10000 до <1/1000); частота невідома (частоту не можна оцінити за доступними даними) (див. таблицю 2). У межах кожної групи побічні реакції зазначені у порядку зменшення їх серйозності. Серед різних показань була включена найвища частота.
Таблиця 2
|
Системи органів |
Частота |
Побічні реакції |
|
Інфекції та інвазії* |
дуже часті |
інфекції дихальних шляхів (включаючи інфекції нижніх та верхніх дихальних шляхів, пневмонію, синусит, фарингіт, назофарингіт, пневмонію, спричинену вірусом герпесу) |
|
часті |
системні інфекції (включаючи сепсис, кандидоз та грип), кишкові інфекції (включаючи вірусний гастроентерит), інфекції шкіри та м’яких тканин (включаючи пароніхію, целюліт, імпетиго, некротичний фасциїт та оперізувальний герпес), інфекції вуха, інфекції ротової порожнини (включаючи вірус простого герпесу, герпес ротової порожнини та інфекції зубів), інфекції статевих органів (включаючи грибковий вульвовагініт), інфекції сечовивідних шляхів (включаючи пієлонефрит), грибкові інфекції, інфекції суглобів |
|
|
нечасті |
неврологічні інфекції (включаючи вірусний менінгіт), опортуністичні інфекції та туберкульоз (включаючи кокцидіоїдомікоз, гістоплазмоз та інфекції комплексу mycobacterium avium), бактеріальні інфекції, інфекції ока, дивертикуліт1) |
|
|
Новоутворення доброякісні, злоякісні та неуточненої етіології (включаючи кісти та поліпи)* |
часті |
рак шкіри, за винятком меланоми (включаючи базальноклітинну карциному та плоскоклітинну карциному), доброякісне новоутворення |
|
нечасті |
лімфома**, новоутворення паренхіматозних органів (включаючи рак молочної залози, пухлину легенів та пухлину щитовидної залози), меланома** |
|
|
поодинокі |
лейкемія1) |
|
|
частота невідома |
гепатолієнальна Т-клітинна лімфома1), карцинома Меркеля (нейроендокринна карцинома шкіри)1), саркома Капоші |
|
|
З боку крові та лімфатичної системи* |
дуже часті |
лейкопенія (включаючи нейтропенію та агранулоцитоз), анемія |
|
часті |
лейкоцитоз, тромбоцитопенія |
|
|
нечасті |
ідіопатична тромбоцитопенічна пурпура |
|
|
поодинокі |
панцитопенія |
|
|
З боку імунної системи* |
часті |
гіперчутливість, алергія (включаючи сезонну алергію) |
|
нечасті |
саркоїдоз1), васкуліт |
|
|
поодинокі |
анафілаксія1) |
|
|
Порушення обміну речовин та харчування |
дуже часті |
підвищення рівня ліпідів у крові |
|
часті |
гіпокаліємія, гіперурикемія, відхилення від норми концентрації натрію в плазмі крові, гіпокальціємія, гіперглікемія, гіпофосфатемія, дегідратація |
|
|
Психічні розлади |
часті |
зміни настрою (включаючи депресію), тривожність, безсоння |
|
З боку нервової системи* |
дуже часті |
головний біль |
|
часті |
парестезії (включаючи гіпестезію), мігрень, стиснення нервового корінця |
|
|
нечасті |
порушення мозкового кровообігу1), тремор, невропатія |
|
|
поодинокі |
розсіяний склероз, демієлінізуючі розлади (наприклад, неврит зорового нерва, синдром Гієна — Барре)1) |
|
|
З боку органів зору |
часті |
порушення гостроти зору, кон’юнктивіт, блефарит, набряк ока |
|
нечасті |
диплопія |
|
|
З боку органів слуху та вестибулярного апарату |
часті |
вертиго |
|
нечасті |
глухота, дзвін у вухах |
|
|
З боку серця* |
часті |
тахікардія |
|
нечасті |
інфаркт міокарда1), аритмія, хронічна серцева недостатність |
|
|
поодинокі |
зупинка серця |
|
|
З боку судин |
часті |
артеріальна гіпертензія, приливи жару, гематома |
|
нечасті |
аневризма аорти, оклюзія судинних артерій, тромбофлебіт |
|
|
З боку дихальної системи, органів грудної клітки та середостіння* |
часті |
бронхіальна астма, диспное, кашель |
|
нечасті |
легенева емболія1), інтерстиціальне захворювання легенів, хронічне обструктивне захворювання легенів, пневмоніт, плевральний випіт1) |
|
|
поодинокі |
легеневий фіброз1) |
|
|
З боку травної системи |
дуже часті |
біль у животі, нудота та блювання |
|
часті |
шлунково-кишкові кровотечі, диспепсія, гастроезофагеальна рефлюксна хвороба, сухий синдром (синдром Шегрена) |
|
|
нечасті |
панкреатит, дисфагія, набряк обличчя |
|
|
поодинокі |
перфорація кишечника1) |
|
|
З боку печінки та жовчовивідних шляхів* |
дуже часті |
підвищення рівня печінкових ферментів |
|
нечасті |
холецистит та жовчнокам’яна хвороба, стеатоз печінки, підвищення рівня білірубіну |
|
|
поодинокі |
гепатит, реактивація гепатиту В1), аутоімунний гепатит1) |
|
|
частота невідома |
печінкова недостатність1) |
|
|
З боку шкіри та підшкірної клітковини |
дуже часті |
висип (включаючи ексфоліативний висип) |
|
часті |
нові випадки або загострення перебігу бляшкового псоріазу (включаючи долонно-підошовний пустульозний псоріаз)1), кропив’янка, екхімози (включаючи пурпуру), дерматит (включаючи екзему), оніхоклазія, підвищена пітливість, алопеція1), свербіж |
|
|
нечасті |
нічна пітливість, рубці |
|
|
поодинокі |
мультиформна еритема, синдром Стівенса — Джонсона1), ангіоневротичний набряк1), шкірний васкуліт, ліхеноїдна реакція шкіри1) |
|
|
частота невідома |
загострення симптомів дерматоміозиту1) |
|
|
З боку кістково-м’язової системи та сполучної тканини |
дуже часті |
скелетно-м’язовий біль |
|
часті |
спазми м’язів (включаючи підвищення рівня креатинфосфокінази в плазмі крові) |
|
|
нечасті |
рабдоміоліз, системний червоний вовчак |
|
|
поодинокі |
вовчакоподібний синдром1) |
|
|
З боку нирок та сечовивідних шляхів |
часті |
порушення функції нирок, гематурія |
|
нечасті |
ніктурія |
|
|
Розлади репродуктивної системи та молочних залоз |
нечасті |
еректильна дисфункція |
|
Загальні порушення та реакції в місці введення* |
дуже часті |
реакції в місці введення (включаючи еритему в місці введення) |
|
часті |
біль у грудях, набряки, пірексія1) |
|
|
нечасті |
запалення |
|
Лабораторні показники |
часті |
коагуляція та порушення системи згортання крові (включаючи подовження активованого частково тромбопластинового часу [АЧТЧ]), позитивний тест на аутоантитіла (включаючи антитіла до дволанцюгової ДНК), підвищення рівня лактатдегідрогенази в плазмі крові |
|
частота невідома |
збільшення маси тіла2) |
|
|
Травми, отруєння та ускладнення процедури |
часті |
порушення процесів загоєння ран |
* Детально див. у розділах «Протипоказання», «Особливості застосування» та «Побічні реакції».
** Включаючи відкритий період розширених досліджень.
1) Включаючи дані спонтанної звітності.
2) Зміна середнього значення маси тіла від початкового значення у групі застосування адалімумабу коливалася в межах від 0,3 кг до 1,0 кг при всіх показаннях у дорослих пацієнтів та від –0,4 кг до 0,4 кг у групі плацебо протягом періоду лікування 4–6 місяців. Збільшення маси тіла на 5–6 кг також спостерігалось у довгострокових розширених дослідженнях із середньою тривалістю експозиції приблизно 1–2 роки в групі терапії адалімумабом (без контрольної групи), особливо у пацієнтів із хворобою Крона та виразковим колітом. Механізм дії цього ефекту з’ясований не повністю, але може бути пов’язаний із протизапальною дією адалімумабу.
Діти.
Зазвичай побічні реакції, що виникали у дітей, були подібні за частотою та характером до побічних реакцій, які спостерігалися у дорослих пацієнтів.
Гнійний гідраденіт.
Профіль безпеки для пацієнтів із гнійним гідраденітом, які отримували адалімумаб 1 раз на тиждень, відповідав встановленому профілю безпеки адалімумабу.
Увеїт.
Профіль безпеки для пацієнтів із увеїтом, які отримували адалімумаб 1 раз на 2 тижні, відповідав встановленому профілю безпеки адалімумабу.
Окремі побічні реакції
Реакції в місці введення.
У основних контрольованих клінічних дослідженнях у дорослих та дітей у 12,9 % пацієнтів, які отримували адалімумаб, спостерігалися реакції в місці введення (почервоніння та/або свербіж, геморагії, біль або набряк) порівняно з 7,2 % пацієнтів, які отримували плацебо або активний контроль. Більшість реакцій у місці введення зазвичай не потребували відміни лікарського засобу.
Інфекції.
У основних контрольованих дослідженнях у дорослих та дітей частота виникнення інфекцій становила 1,51/пацієнто-рік у пацієнтів, які отримували адалімумаб, та 1,46/пацієнто-рік у пацієнтів, які отримували плацебо та активний контроль. Переважно такими інфекціями були назофарингіт, інфекції верхніх дихальних шляхів та синусит. Більшість пацієнтів продовжували застосовувати адалімумаб після зникнення інфекції.
Частота виникнення тяжких інфекцій становила 0,04/пацієнто-рік у пацієнтів, які отримували адалімумаб, та 0,03/пацієнто-рік у пацієнтів, які отримували плацебо та активний контроль.
У контрольованих та відкритих дослідженнях у дорослих та дітей під час лікування адалімумабом повідомлялося про тяжкі інфекції (рідко з летальним наслідком), такі як туберкульоз (включаючи міліарний та позалегеневої локалізації) та інвазивні опортуністичні інфекції (наприклад, дисемінований гістоплазмоз, бластомікоз, кокцидіоїдомікоз, пневмоцистна пневмонія, кандидоз, аспергільоз та лістеріоз). Більшість випадків туберкульозу мали місце протягом перших восьми місяців після початку терапії і можуть свідчити про рецидив латентної хвороби.
Злоякісні новоутворення та лімфопроліферативні розлади.
Під час досліджень адалімумабу у дітей з ювенільним ідіопатичним артритом (поліартикулярним ювенільним ідіопатичним артритом та ентезитасоційованим артритом) розвитку злоякісних новоутворень не спостерігалося (n = 249; 655,6 пацієнто-року). Також не спостерігалося розвитку злоякісних новоутворень під час дослідження застосування адалімумабу у дітей із хворобою Крона (n = 192; 498,1 пацієнто-року). Про розвиток злоякісних новоутворень під час дослідження адалімумабу у дітей із хронічним бляшковим псоріазом не повідомлялося (n = 77; 80,0 пацієнто-року). Також, не повідомлялося про розвиток злоякісних новоутворень під час дослідження адалімумабу у дітей із виразковим колітом (n = 93; 65,3 пацієнто-року). Під час дослідження застосування адалімумабу у дітей з увеїтом розвитку злоякісних новоутворень не спостерігалося (n = 60; 58,4 пацієнто-року).
Під час контрольованого періоду основних досліджень застосування адалімумабу дорослим протягом щонайменше 12 тижнів у пацієнтів із ревматоїдним артритом середнього та високого ступеня активності, анкілозуючим спондилітом, аксіальним спондилоартритом без рентгенологічного підтвердження АС, пацієнтів із псоріатичним артритом, бляшковим псоріазом, гнійним гідраденітом, хворобою Крона, виразковим колітом та увеїтом частота виникнення новоутворень, за винятком лімфоми та немеланомного раку шкіри, становила (95 % довірчий інтервал) 6,8 (4,4; 10,5)/1000 пацієнто-років у 5291 пацієнта, які отримували адалімумаб, порівняно з частотою 6,3 (3,4; 11,8)/1000 пацієнто-років у 3444 пацієнтів контрольної групи (середня тривалість лікування становила 4,0 місяця в групі, яка отримувала адалімумаб та 3,8 місяця у пацієнтів контрольної групи). Частота виникнення немеланомного раку шкіри (95 % довірчий інтервал) становила 8,8 (6,0; 13,0)/1000 пацієнто-років у пацієнтів, які отримували адалімумаб, та 3,2 (1,3; 7,6)/1000 пацієнто-років у пацієнтів контрольної групи. Частота виникнення плоскоклітинної карциноми (95 % довірчий інтервал) становила 2,7 (1,4; 5,4)/1000 пацієнто-років у пацієнтів, які отримували адалімумаб, та 0,6 (0,1; 4,5)/1000 пацієнто-років у пацієнтів контрольної групи. Частота виникнення лімфом (95 % довірчий інтервал) становила 0,7 (0,2; 2,7)/1000 пацієнто-років у пацієнтів, які отримували адалімумаб, та 0,6 (0,1; 4,5)/1000 пацієнто-років у пацієнтів контрольної групи.
У контрольованих дослідженнях та в розширених дослідженнях відкритого періоду, тривалістю приблизно 3,3 року, які включали 6427 пацієнтів і більш ніж 26439 пацієнто-років терапії, частота виникнення злоякісних новоутворень, за винятком лімфоми та немеланомного раку шкіри, становила приблизно 8,5/1000 пацієнто-років. Частота виникнення немеланомного раку шкіри становила приблизно 9,6/1000 пацієнто-років, а частота виникнення лімфом — приблизно 1,3/1000 пацієнто-років.
У ході післяреєстраційного застосування з січня 2003 року по грудень 2010 року, переважно у пацієнтів із ревматоїдним артритом, частота виникнення злоякісних новоутворень становила приблизно 2,7/1000 пацієнто-років. Частота виникнення немеланомного раку шкіри та лімфоми становила приблизно 0,2 та 0,3/1000 пацієнто-років відповідно (див. розділ «Особливості застосування»).
У ході післяреєстраційного застосування лікарського засобу повідомлялося про поодинокі випадки гепатолієнальної Т-клітинної лімфоми у пацієнтів, які отримували адалімумаб (див. розділ «Особливості застосування»).
Аутоантитіла.
У ході досліджень ревматоїдного артриту I–V фази пацієнтам у різні проміжки часу проводили аналіз сироватки крові на наявність аутоантитіл. У цих дослідженнях у 11,9 % пацієнтів, які отримували адалімумаб, та у 8,1 % пацієнтів, які отримували плацебо та активний контроль з негативним титром базового рівня антинуклеарних антитіл, визначали позитивний титр на тижні 24. У 2 пацієнтів із 3441 з ревматоїдним артритом та псоріатичним артритом, які отримували адалімумаб протягом клінічних досліджень, розвинулись ознаки вовчакоподібного синдрому (вперше виявленого), що зникли після припинення лікування. У жодного пацієнта не розвинулися люпус-нефрит або симптоми ураження центральної нервової системи.
Порушення з боку печінки та жовчовивідних шляхів.
У контрольованих клінічних дослідженнях ІІІ фази застосування адалімумабу за участю пацієнтів із ревматоїдним артритом та псоріатичним артритом протягом контрольованого періоду від 4 до 104 тижнів підвищення рівня аланінтрансамінази (АЛТ) у 3 або більше разів від верхньої межі норми (ВМН) спостерігалося у 3,7 % пацієнтів, які отримували адалімумаб, та у 1,6 % у пацієнтів контрольної групи.
У контрольованих клінічних дослідженнях ІІІ фази застосування адалімумабу за участю дітей із поліартикулярним ювенільним ідіопатичним артритом віком від 4 до 17 років та дітей із ентезитасоційованим артритом віком від 6 до 17 років підвищення рівня АЛТ у 3 або більше разів від ВМН спостерігалося у 6,1 % дітей, які отримували адалімумаб, та у 1,3 % дітей контрольної групи. Більшість випадків підвищення рівня АЛТ спостерігалося при одночасному застосуванні метотрексату. Під час клінічного дослідження ІІІ фази застосування адалімумабу у дітей із поліартикулярним ювенільним ідіопатичним артритом віком від 2 до 4 років підвищення рівня АЛТ у 3 або більше разів від ВМН не спостерігалося.
У контрольованих клінічних дослідженнях ІІІ фази застосування адалімумабу за участю пацієнтів із хворобою Крона та виразковим колітом протягом контрольованого періоду від 4 до 52 тижнів підвищення рівня АЛТ у 3 або більше разів від ВМН спостерігалося у 0,9 % пацієнтів обох груп.
У клінічному дослідженні ІІІ фази застосування адалімумабу за участю дітей із хворобою Крона, в якому оцінювали ефективність та безпеку двократного режиму дозування підтримувальної терапії відповідно до маси тіла з подальшим режимом дозування індукційної терапії відповідно до маси тіла до 52 тижнів терапії, підвищення рівня АЛТ у 3 або більше разів вище ВМН спостерігалося у 2,6 % (5/192) дітей, з яких 4 одночасно отримували імуносупресори на початковому рівні.
У контрольованих клінічних дослідженнях ІІІ фази застосування адалімумабу за участю пацієнтів із бляшковим псоріазом протягом контрольованого періоду від 12 до 24 тижнів підвищення рівня АЛТ у 3 або більше разів від ВМН спостерігалося у 1,8 % пацієнтів обох груп.
У клінічному дослідженні ІІІ фази за участю дітей із бляшковим псоріазом підвищення рівня АЛТ у 3 або більше разів від ВМН не спостерігалося.
У контрольованих клінічних дослідженнях застосування адалімумабу (початкова доза 160 мг на тижні 0 та 80 мг на тижні 2, потім 40 мг 1 раз на тиждень, починаючи з тижня 4) за участю пацієнтів із гнійним гідраденітом протягом контрольованого періоду від 12 до 16 тижнів підвищення рівня АЛТ у 3 або більше разів від ВМН спостерігалося у 0,3 % пацієнтів, які отримували адалімумаб, та у 0,6 % пацієнтів контрольної групи.
У контрольованих клінічних дослідженнях застосування адалімумабу (початкова доза 80 мг на тижні 0, а потім, починаючи з тижня 1, по 40 мг 1 раз на 2 тижні) за участю дорослих пацієнтів із увеїтом протягом 80 тижнів із середніми значеннями 166,5 дня та 105 днів у групі терапії адалімумабом та у контрольній групі відповідно підвищення рівня АЛТ у 3 або більше разів від ВМН спостерігалося у 2,4 % пацієнтів обох груп.
У контрольованому клінічному дослідженні ІІІ фази застосування адалімумабу за участю дітей із виразковим колітом (n = 93), в якому оцінювали ефективність та безпеку дозування підтримувальної терапії 0,6 мг/кг (до 40 мг) 1 раз на 2 тижні (n = 31) та 0,6 мг/кг (до 40 мг) 1 раз на тиждень (n = 32) з подальшим режимом дозування індукційної терапії відповідно до маси тіла 2,4 мг/кг (до 160 мг) на тижні 0 та тижні 1 і 1,2 мг/кг (до 80 мг) на тижні 2 (n = 63) або з подальшим режимом дозування індукційної терапії відповідно до маси тіла 2,4 мг/кг (до 160 мг) на тижні 0, плацебо на тижні 1 та 1,2 мг/кг (до 80 мг) на тижні 2 (n = 30), підвищення рівня АЛТ у 3 або більше разів вище ВМН спостерігалося у 1,1 % (1/93) дітей.
При всіх показаннях у клінічних дослідженнях пацієнти мали безсимптомне підвищення рівня АЛТ і в більшості випадків підвищення було минущим та зникало під час довготривалого лікування. Однак були поодинокі післяреєстраційні повідомлення про печінкову недостатність та менш тяжкі порушення з боку печінки, що можуть призвести до печінкової недостатності, таких як гепатит, включаючи аутоімунний гепатит, у пацієнтів, які отримували адалімумаб.
Супутня терапія з азатіоприном/6-меркаптопурином.
В дослідженнях у дорослих пацієнтів із хворобою Крона, які одночасно отримували адалімумаб та азатіоприн/6-меркаптопурин, спостерігалося підвищення частоти побічних реакцій, пов’язаних із виникненням злоякісних новоутворень та тяжких інфекцій, порівняно з пацієнтами, які отримували адалімумаб.
Повідомлення про підозрювані побічні реакції.
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності.
42 місяці.
Умови зберігання.
Зберігати в холодильнику (при температурі від 2 до 8 ºС) в оригінальній упаковці для захисту від дії світла. Не заморожувати.
Можливе зберігання при температурі не вище 25 °С протягом не більше 28 діб у захищеному від світла місці. Не використовувати через 28 діб після вилучення з холодильника (навіть якщо лікарський засіб був знову поміщений у холодильник).
Зберігати в недоступному для дітей місці.
Несумісність.
Враховуючи відсутність досліджень щодо сумісності, не слід змішувати лікарський засіб ХАДЛІМА з іншими препаратами.
Упаковка.
По 0,8 мл у попередньо наповненому одноразовому шприці зі скла типу І з голкою з нержавіючої сталі, ковпачком голки з жорсткою оболонкою та гумовим ущільнювачем; по 2 попередньо наповнених одноразових шприци з захисними корпусами, упорами для пальця та штоками поршня в стандартно-експортній упаковці в картонній коробці або по 2 попередньо наповнені одноразові ручки, що містять попередньо наповнені одноразові шприци, в стандартно-експортній упаковці в картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Самсунг Біоепіс НЛ Б.В.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Олоф Палмештраат 10, Делфт, 2616 LR, Нідерланди.
Заявник.
САМСУНГ БІОЕПІС КО., ЛТД.
Місцезнаходження заявника.
76, Сондогйоюк-ро, Йонсугу, Інчхон, Республіка Корея.