НУБЕКА
-
Німеччина Байєр АГФорма выпуску: таблетки, вкриті плівковою оболонкою по 300 мг, по 16 таблеток у блістері, по 7 блістерів у картонній пачціСклад: 1 таблетка, вкрита плівковою оболонкою, містить 300 мг даролутамідуУмови відпуску: за рецептомНомер реєстраційного посвідчення: UA/20996/01/01код АТС: L02BB06Термін придатності: 3 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
НУБЕКА
(NUBEQA)
Склад:
діюча речовина: даролутамід;
1 таблетка, вкрита плівковою оболонкою, містить 300 мг даролутаміду;
допоміжні речовини: кальцію гідрофосфат, натрію кроскармелоза, лактози моногідрат, магнію стеарат, повідон К 30; плівкова оболонка: лак білий (гіпромелоза 15 cP, лактози моногідрат, макрогол 3350, титану діоксид (Е 171)).
Лікарська форма. Таблетки, вкриті плівковою оболонкою.
Основні фізико-хімічні властивості: овальні таблетки, вкриті плівковою оболонкою, від білого до майже білого кольору з маркуванням «BAYER» з одного боку та «300» з іншого.
Фармакотерапевтична група. Засоби, що застосовуються для гормональної терапії. Антагоністи гормонів та споріднені засоби. Антиандрогенні засоби. Даролутамід.
Код АТХ L02B B06.
Фармакологічні властивості
Фармакодинаміка
Механізм дії. Даролутамід є інгібітором андрогенного рецептора (АР) з гнучкою полярно заміщеною структурою піразолу, який зв’язується з високою афінністю безпосередньо з доменом зв’язування ліганду рецептора.
Даролутамід конкурентно пригнічує зв’язування андрогенів, ядерну транслокацію АР та опосередковану АР транскрипцію. Основний його метаболіт кето-даролутамід in vitro продемонстрував активність, подібну до активності даролутаміду. Лікування даролутамідом зменшує проліферацію клітин пухлини простати, результатом чого є потужна протипухлинна активність.
Фармакодинамічні ефекти. Не спостерігалося подовження середнього інтервалу QTcF (тобто понад 10 мс) після перорального прийому 600 мг даролутаміду двічі на день порівняно з відповідним показником при застосуванні плацебо.
Клінічна ефективність і безпека. Ефективність і безпека були встановлені в двох рандомізованих плацебо-контрольованих багатоцентрових дослідженнях фази III за участю пацієнтів з неметастатичним кастраційно-резистентним раком передміхурової залози (нмКРРПЗ) (дослідження ARAMIS) і метастатичним гормоночутливим раком передміхурової залози (мГЧРПЗ) (дослідження ARASENS). Усі пацієнти одночасно отримували аналог лютеїнізуючого гормону рилізинг-гормону (ЛГРГ) або мали двосторонню орхіектомію.
Неметастатичний кастраційно-резистентний рак передміхурової залози (нмКРРПЗ)
Ефективність і безпеку застосування даролутаміду оцінювали в рандомізованому подвійно сліпому плацебо-контрольованому багатоцентровому дослідженні фази ІІІ (ARAMIS) у пацієнтів із неметастатичним (за оцінкою звичайних методів КТ, сканування кісток, МРТ) кастраційно-резистентним раком передміхурової залози з часом подвоєння простатоспецифічного антигену (ЧППСА) ≤ 10 місяців.
Пацієнти були включені в дослідження, якщо у них було 3 підвищення рівнів простатоспецифічного антигену (ПСА) після найнижчого рівня, взятого щонайменше з 1-тижневою перервою під час андрогенної деприваційної терапії, ПСА ≥ 2 нг/мл під час скринінгу, а рівень посткастратного тестостерону в сироватці крові < 1,7 нмоль/л.
Пацієнти з судомами в анамнезі були допущені до участі в дослідженні. У групі даролутаміду було зареєстровано 12 пацієнтів (0,21 %), які мали судоми в анамнезі.
Пацієнти з неконтрольованою гіпертензією або нещодавнім (протягом останніх 6 місяців) інсультом, інфарктом міокарда, тяжкою/нестабільною стенокардією, шунтуванням коронарної/периферичної артерії, застійною серцевою недостатністю III або IV класу за класифікацією Нью-Йоркської асоціації серця були виключені з дослідження.
Пацієнти, які раніше отримували інгібітори андрогенного рецептора (АР) другого покоління, такі як ензалутамід, апалутамід і даролутамід, або інгібітори ферменту CYP17, такі як абіратерону ацетат, а також пацієнти, які отримували системні кортикостероїди в дозі, що перевищує еквівалент 10 мг преднізону на день протягом 28 днів до рандомізації, були виключено з дослідження.
Загалом 1509 пацієнтів були рандомізовані 2:1 для отримання 600 мг даролутаміду перорально двічі на день (n = 955) або плацебо (n = 554).
Пацієнти з наявністю тазових лімфатичних вузлів < 2 см по короткій осі нижче біфуркації аорти були включені в дослідження. Відсутність або наявність метастазів встановлювали за допомогою незалежного централізованого радіологічного оцінювання. Таке оцінювання було проведено у 89 пацієнтів, у яких ретроспективно виявлено метастази на початку дослідження. Рандомізацію стратифікували за ЧППСА (≤ 6 місяців або > 6 місяців) та за використанням таргетної терапії, спрямованої на остеокласти, на початку дослідження (так чи ні).
Демографічні характеристики пацієнтів і характеристики захворювання були збалансовані між групами лікування. Середній вік пацієнтів становив 74 роки (діапазон 48–95), 9 % пацієнтів були віком від 85 років; 79 % пацієнтів становили представники європеоїдної раси, 13 % були азіатського походження і 3 % мали темний колір шкіри. Більшість пацієнтів відповідали 7 балам або вище за шкалою Глісона на момент встановлення діагнозу (73 %). Медіана ЧППСА становила 4,5 місяця. Дев’ять відсотків (9 %) пацієнтів мали попередню орхіектомію, 25 % – попередню простатектомію, а 50 % – щонайменше одну попередню променеву терапію. Сімдесят шість відсотків (76 %) пацієнтів отримували більше одного попереднього антигормонального лікування. Пацієнти мали 0 балів (69 %) або 1 бал (31 %) за шкалою ефективності Східної кооперативної онкологічної групи (ECOG PS).
Лікування даролутамідом продовжувалося до прогресування захворювання за радіологічними даними, що оцінювалося за допомогою традиційної візуалізації (КТ, сканування кісток, МРТ) шляхом засліпленого централізованого оцінювання, неприйнятної токсичності або відмови пацієнта від продовження участі в дослідженні.
Первинною кінцевою точкою ефективності було виживання без метастазів (ВБМ). Вторинними кінцевими точками були загальне виживання (ЗВ), час до прогресування болю, час до початку першої цитотоксичної хіміотерапії раку передміхурової залози та час до перших симптоматичних скелетних уражень (визначається як поява будь-чого із такого переліку: зовнішня променева терапія для полегшення скелетних симптомів, новий симптоматичний патологічний перелом кісток, компресія спинного мозку або пов’язане з пухлиною ортопедичне хірургічне втручання).
Лікування даролутамідом призвело до покращення ВБМ порівняно з відповідним показником при застосуванні плацебо (див. таблицю 1 і рис. 1).
Показники ВБМ були співвідносними в усіх підгрупах пацієнтів незалежно від ЧППСА, попереднього використання агентів, що впливають на кісткову тканину, або локально-регіонального захворювання. Додаткові підгрупи з узгодженими результатами ВБМ включали показник ПСА на початку дослідження, бал за шкалою Глісона на момент встановлення діагнозу, вік пацієнта, географічний регіон, бал за ECOG PS на початку дослідження расову приналежність та кількість попередніх курсів гормональної терапії.
Після первинного аналізу ВБМ, як тільки дослідження було розкрито, пацієнтам, які отримували плацебо, було запропоновано лікування даролутамідом (перехресний варіант). З 554 хворих, рандомізованих в групу плацебо, 170 (31 %) перейшли на лікування даролутамідом. Аналіз ЗВ не був скоригований з урахуванням впливу перехресного переходу.
На момент остаточного аналізу результатом лікування даролутамідом було статистично значуще покращення показника загального виживання порівняно з відповідним показником при застосуванні плацебо (медіана не була досягнута в жодній групі, див. таблицю 1 і рис. 2). Також спостерігалося статистично значуще збільшення періоду часу до прогресування болю, до початку першої цитотоксичної хіміотерапії та до першої симптоматичної скелетної події порівняно з відповідними показниками при застосуванні плацебо (див. таблицю 1).
На момент остаточного аналізу середня тривалість лікування пацієнтів, які отримували даролутамід, становила 33,3 місяця (діапазон від 0,0 до 74,0 місяця) протягом комбінованого подвійно сліпого та відкритого періоду.
Усі аналізи проводились у повному наборі досліджень.
Таблиця 1. Результати ефективності з дослідження ARAMIS
|
Параметр ефективності |
Кількість (%) пацієнтів з подіями |
Медіана (місяці) (95 % ДІ) |
Відношення ризиків (ВР)b (95 % довірчий інтервал [ДІ]) p‑значення (двобічне) |
||
|
Даролутамід (N = 955) |
Плацебоa (N = 554) |
Даролутамід (N = 955) |
Плацебоa (N = 554) |
||
|
Виживання без метастазівc |
221 (23,1 %) |
216 (39,0 %) |
40,4 (34,3; НД) |
18,4 (15,5; 22,3) |
0,413 (0,341; 0,500) < 0,000001 |
|
Загальне виживання |
148 (15,5 %) |
106 (19,1 %) |
НД (56,1; НД) |
НД (46,9; НД) |
0,685 (0,533; 0.881) 0,003048 |
|
Час до прогресування болюc, d |
251 (26,3 %) |
178 (32,1 %) |
40,3 (33,2; 41,2) |
25,4 (19,1; 29,6) |
0,647 (0,533; 0,785) 0,000008 |
|
Час до початку першої цитотоксичної хіміотерапії |
127 (13,3 %) |
98 (17,7 %) |
НД (НД, НД) |
НД |
0,579 (0,444; 0,755) 0,000044 |
|
Час до першої симптоматичної скелетної події |
29 (3,0 %) |
28 (5,1 %) |
НД (НД, НД) |
(НД, НД) |
0,484 (0,287; 0,815) 0,005294 |
а В тому числі 170 пацієнтів, які перейшли на даролутамід без періоду засліплення.
b Коефіцієнт ризику < 1 щодо даролутаміду.
c Для ВБМ і часу до прогресування болю первинний аналіз важається остаточним аналізом.
d Результати, про які повідомляв пацієнт, згідно з оцінкою опитувальника Короткий опис болю – Коротка форма опитувальника.
НД – не досягнуто.
Результатом лікування даролутамідом був довший період виживання без прогресування (ВБП, медіана 36,8 проти 14,8 місяця, КР = 0,380, номінальний p < 0,000001) і часу до прогресування ПСА (медіана 29,5 проти 7,2 місяця, ЧСС = 0,164, номінальний p < 0,000001). Постійність ефекту спостерігалася для всіх показників виживання (ВБМ, ЗВ та ПСА).
Рис. 1. Криві Каплана – Маєра виживання без метастазів (ARAMIS)
Рис. 2. Криві Каплана – Маєра загального виживання (ARAMIS)
Пацієнти, які отримували даролутамід у дослідженні ARAMIS (подвійно сліпий період), продемонстрували значно вищу підтверджену частоту відповіді щодо рівня ПСА (визначається як зниження на ≥ 50 % від вихідного рівня) порівняно з пацієнтами, які отримували плацебо, 84,0 % проти 7,9 % (різниця = 76,1 %, p < 0,000001 (номінальне значення p, лише для інформації)).
Метастатичний гормоночутливий рак передміхурової залози (мГЧРПЗ)
Ефективність і безпеку застосування даролутаміду в комбінації з доцетакселом оцінювали в багатоцентровому подвійно сліпому плацебо-контрольованому дослідженні III фази (ARASENS) у пацієнтів з мГЧРПЗ. Загалом 1306 пацієнтів були рандомізовані 1:1 для отримання 600 мг даролутаміду перорально двічі на день (n = 651) або плацебо (n = 655) одночасно з 75 мг/м2 доцетакселу протягом 6 циклів. Лікування даролутамідом або плацебо продовжувалося до прогресування симптомів захворювання, зміни протипухлинної терапії, неприйнятної токсичності, смерті або вибуття пацієнта з дослідження.
Наявність метастазів оцінювали за допомогою незалежного централізованого радіологічного оцінювання. Пацієнти з ураженням лише регіонарних лімфатичних вузлів (M0) були виключені з дослідження. Рандомізація була стратифікована за ступенем захворювання (лише метастази в нерегіонарні лімфатичні вузли (M1a), метастази в кістки з метастазами в лімфатичні вузли або без них (M1b) або вісцеральні метастази з метастазами в лімфатичні вузли або без них, або з метастазами в кістки або без них (M1c)) та за рівнем лужної фосфатази (< або ≥ верхньої межі норми) на початку дослідження. Пацієнтів із метастазами в мозок дозволялося включати в дослідження, але таких пацієнтів не було.
Демографічні характеристики пацієнтів і характеристики захворювання були збалансовані між групами лікування. Середній вік становив 67 років (діапазон 41–89), 0,5 % пацієнтів були віком від 85 років, 52 % були європеоїдної раси, 36 % – азіатського походження і 4 % учасників дослідження мали темний колір шкіри. Більшість пацієнтів відповідали 8 або більше балам за шкалою Глісона на момент встановлення діагнозу (78 %). 71 % пацієнтів мали оцінку ECOG PS 0 балів, а 29 % – 1 бал. Було 86,1 % пацієнтів із захворюванням de novo та 12,9 % пацієнтів із рецидивом. На початку дослідження 3 % пацієнтів мали M1a, 79,5 % мали M1b і 17,5 % мали M1c; лужна фосфатаза була < ВМН у 44,5 % пацієнтів і ≥ ВМН у 55,5 % пацієнтів; середній вихідний рівень ПСА становив 30,3 мкг/л і 24,2 мкг/л у групах даролутаміду та плацебо відповідно. Пацієнти із судомами в анамнезі були допущені до участі в дослідженні, і 4 пацієнти (0,6 %) були включені в групу даролутамід + доцетаксел.
77,0 % пацієнтів мали захворювання великого обсягу, а 23,0 % мали захворювання малого обсягу. Захворювання великого обсягу визначалося як наявність вісцеральних метастазів або 4 чи більше уражень кісток, принаймні 1 метастаз за межі хребта та тазових кісток. Приблизно 25 % пацієнтів отримували супутнє лікування бісфосфонатами або деносумабом.
Основною кінцевою точкою ефективності було загальне виживання (ЗВ). Вторинними кінцевими точками були час до розвитку кастраційно-резистентного раку передміхурової залози, час до прогресування болю, час виживання без симптомів скелетного ураження, час до першої симптоматичної скелетної події, час до початку наступної протипухлинної терапії, час до погіршення фізичних симптомів, пов’язаних із захворюванням, та час до початку застосування опіоїдів протягом ≥ 7 днів поспіль. Прогресування болю оцінювали за повідомленими пацієнтом результатами згідно з опитувальником Короткий опис болю – Коротка форма, що було визначено як принаймні 2-бальне погіршення від початкового рівня та початок прийому опіоїдів короткої або тривалої дії для зняття болю протягом ≥ 7 днів поспіль.
Середня тривалість лікування становила 41,0 місяця (діапазон від 0,1 до 56,5 місяця) у пацієнтів, які отримували даролутамід + доцетаксел, і 16,7 місяця (діапазон від 0,3 до 55,8 місяця) у пацієнтів, які отримували плацебо + доцетаксел. 87,6 % і 85,5 % пацієнтів отримали повні 6 циклів доцетакселу, а 1,5 % і 2,0 % пацієнтів не отримували доцетаксел у групі даролутамід + доцетаксел і плацебо + доцетаксел відповідно.
Таблиця 2. Результати ефективності дослідження ARASENS
|
Параметр ефективності |
Кількість (%) пацієнтів з подіями |
Медіана (місяці) (95 % ДІ) |
Відношення ризиків (ВР)b (95 % довірчий інтервал [ДІ]) р-значення (одностороннє)c |
||
|
Даролутамід + доцетаксел (N = 651) |
Плацебо + доцетаксел (N = 654)а |
Даролутамід + доцетаксел (N = 651) |
Плацебо + доцетаксел (N = 654)а |
||
|
Загальне виживанняd |
229 (35,2 %) |
304 (46,5 %) |
НД (НД, НД) |
48,9 (44,4; НД) |
0,675 (0,568; 0,801) < 0,0001 |
а Один пацієнт у групі плацебо був виключений з усіх аналізів.
b Коефіцієнт ризику < 1 щодо даролутаміду.
c На основі стратифікованого логарифмічного рангового тесту.
d Результати ЗВ були однаковими в усіх підгрупах пацієнтів, включаючи ступінь захворювання та рівні лужної фосфатази.
НД – не досягнуто.
Вторинні кінцеві точки ефективності, за якими показано статистично значущу перевагу пацієнтів групи даролутамід + доцетаксел порівняно з пацієнтами групи плацебо + доцетаксел: час до розвитку кастраційно-резистентного раку передміхурової залози (медіана НД проти 19,1 місяця; КР = 0,357, p < 0,0001); час до першої симптоматичної скелетної події (медіана НД проти НД; КР = 0,712, p = 0,0081); час до початку наступної протипухлинної хіміотерапії (медіана НД проти 25,3 місяця; КР = 0,388, p < 0,0001); час до прогресування болю (медіана НД проти 27,5 місяця; КР = 0,792, p = 0,0058); час виживання без симптоматичних скелетних подій (медіана 51,2 проти 39,7 місяця; КР = 0,609, p < 0,0001).
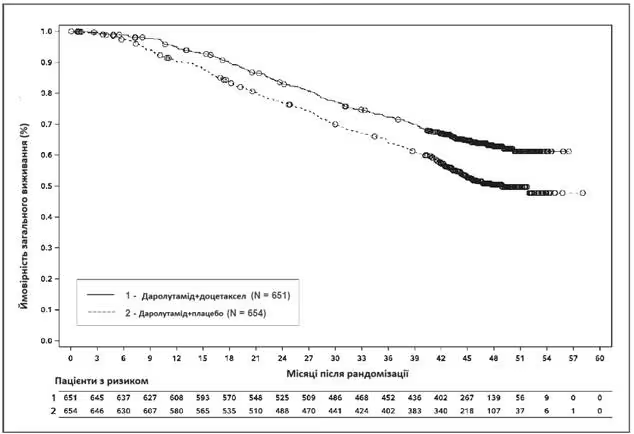 Рис.
3. Криві загального
виживання
Каплана – Маєра
(ARASENS)a
Рис.
3. Криві загального
виживання
Каплана – Маєра
(ARASENS)a
а ЗВ через 36 місяців становила 72,3 % (95 % ДІ, 68,8–75,8 ) у групі даролутамід +доцетаксел проти 63,8 % (95 % ДІ, від 60,1 до 67,6) у групі плацебо + доцетаксел.
Частота ЗВ через 48 місяців становила 62,7 % (95 % ДІ, 58,7–66,7) у групі даролутамід+доцетаксел проти 50,4 % (95 % ДІ, 46,3–54,6) у групі плацебо + доцетаксел.
Фармакокінетика
Даролутамід складається з двох діастереомерів [(S, R)-даролутамід і (S, S)-даролутамід], які взаємоперетворюються через основний циркулюючий метаболіт кето-даролутамід. In vitro всі три речовини демонструють однакову фармакологічну активність. Даролутамід погано розчиняється у водних розчинниках у широкому діапазоні рН і, як правило, краще розчиняється в органічних розчинниках.
Всмоктування
Після перорального прийому 600 мг (2 таблетки по 300 мг) двічі на добу пікові концентрації даролутаміду в плазмі в рівноважному стані становили 4,79 мг/л (коефіцієнт варіації 30,9 %) у пацієнтів з нмКРРПЗ у дослідженні ARAMIS і 3,84 мг/л (коефіцієнт варіації 35,6 %) у пацієнтів з мГЧРПЗ у дослідженні ARASENS. Середній час досягнення максимальної концентрації в плазмі становив 3–4 години. Співвідношення двох діастереомерів, (S, R)-даролутаміду до (S, S)-даролутаміду, змінилося з 1:1 у таблетці до приблизно 1:9 у плазмі на основі показника AUС0-12 у рівноважному стані. Після перорального застосування разом з їжею рівноважний стан досягається через 2–5 днів повторного прийому двічі на день.
Абсолютна біодоступність після перорального прийому натще таблетки Нубека, що містить 300 мг даролутаміду, становить приблизно 30 % такої при внутрішньовенній ін’єкції.
Біодоступність даролутаміду підвищувалася у 2,0–2,5 раза при прийомі з їжею. Подібне збільшення експозиції спостерігалося для основного метаболіту – кето-даролутаміду.
Розподіл
Уявний об’єм розподілу даролутаміду після внутрішньовенного введення становить 119 л, що вказує на те, що даролутамід широко розподіляється в організмі як у внутрішньоклітинному, так і позаклітинному рідинному просторі.
Даролутамід помірно (92 %) зв’язується з білками плазми людини, при цьому відсутня різниця між двома діастереомерами. Основний метаболіт даролутаміду кето-даролутамід значною мірою (99,8 %) зв’язується з білками плазми.
Проходження даролутаміду через гематоенцефалічний бар’єр клінічно не вивчалося. Проте вплив даролутаміду на головний мозок з точки зору AUC0-24 є дуже низьким: 4,5 % експозиції в плазмі після одноразової дози у щурів і 1,9–3,9 % після повторної дози у мишей. Це вказує на низьке проходження даролутаміду через інтактний гематоенцефалічний бар’єр у щурів і мишей та на низьку ймовірність того, що даролутамід перетинає інтактний гематоенцефалічний бар’єр у людей у клінічно значущій мірі.
Біотрансформація
Діастереомери (S, R)-даролутамід і (S, S)-даролутамід здатні взаємоперетворюватися за допомогою метаболіту кето-даролутаміду з перевагою (S, S)-даролутаміду.
Після одноразового перорального прийому 300 мг 14C-даролутаміду у вигляді перорального розчину кето-даролутамід є єдиним основним метаболітом із приблизно в 2 рази вищою загальною експозицією в плазмі порівняно з даролутамідом. На даролутамід і кето-даролутамід разом припадає 87,4 % 14C-радіоактивності в плазмі, що вказує на те, що всі інші метаболіти є незначущими.
Даролутамід метаболізується головним чином шляхом окислювального метаболізму, опосередкованого переважно CYP3A4, а також шляхом прямої глюкуронізації, опосередкованої переважно UGT1A9 та UGT1A1. Крім того, було показано, що переважно ізоформи AKR1C каталізують відновлення кето-даролутаміду до діастереомерів речовини.
Виведення
Ефективний період напіввиведення даролутаміду та кето-даролутаміду у плазмі крові пацієнтів становить приблизно 18–20 годин. З двох діастереомерів, що входять до складу даролутаміду, (S, R)-даролутамід має коротший ефективний період напіврозпаду – 9 годин порівняно з (S, S)-даролутамідом, ефективний період напіврозпаду якого становить 22 години. Кліренс даролутаміду після внутрішньовенного введення становив 116 мл/хв (CV 39,7 %). Загалом 63,4 % даролутаміду та його метаболітів, виводиться із сечею (приблизно 7 % у незміненому вигляді), 32,4 % виводиться з калом. Понад 95 % дози було виведено протягом 7 днів після прийому.
Лінійність/нелінійність
У діапазоні доз від 100 до 700 мг (після одноразової дози та в рівноважному стані) експозиція двох діастереомерів і основного метаболіту кето-даролутаміду зростає лінійно майже залежно від дози. Зважаючи на насичене поглинання, подальшого збільшення експозиції даролутаміду при дозі 900 мг двічі на день не спостерігалося.
Особливі групи пацієнтів
Пацієнти літнього віку. Клінічно значущих відмінностей у фармакокінетиці даролутаміду не спостерігалося (65–95 років).
Порушення функції нирок. У клінічному фармакокінетичному дослідженні AUC та Cmax даролутаміду були в 2,5 та 1,6 раза вищими у пацієнтів із тяжкою нирковою недостатністю (розрахована швидкість клубочкової фільтрації [рШКФ] від 15 до 29 мл/хв/1,73 м2) порівняно зі здоровими добровольцями.
Популяційний фармакокінетичний аналіз вказує на 1,1-, 1,3- та приблизно в 1,5 раза вищу експозицію (AUC) даролутаміду у пацієнтів із легким, помірним та тяжким порушенням функції нирок (рШКФ від 15 до 89 мл/хв/1,73 м2) порівняно з пацієнтами з нормальною функцією нирок.
Фармакокінетика даролутаміду не вивчалася у пацієнтів із термінальною стадією ниркової недостатності, які перебувають на діалізі (рШКФ < 15 мл/хв/1,73 м2).
Порушення функції печінки. У клінічному фармакокінетичному дослідженні Cmax і AUC даролутаміду були в 1,5 і 1,9 раза вищими у пацієнтів із помірною печінковою недостатністю (клас B за класифікацією Чайлда – П’ю) порівняно зі здоровими добровольцями. Немає даних щодо пацієнтів із тяжкою печінковою недостатністю (клас С за класифікацією Чайлда – П’ю).
Етнічні відмінності. Не спостерігалося жодних клінічно значущих відмінностей у фармакокінетиці даролутаміду залежно від етнічної приналежності пацієнта (пацієнти європеоїдної раси, пацієнти японського походження, пацієнти азіатського, але не японського походження, пацієнти з темним кольором шкіри або афроамериканського походження). Популяційний фармакокінетичний аналіз показав збільшення середнього геометричного впливу (AUC) до 1,56 раза (90 % ДІ 1,43–1,70) у пацієнтів японського походження порівняно з пацієнтами з інших регіонів у дослідженнях ARAMIS і ARASENS.
Доклінічні дані з безпеки
Системна токсичність. У дослідженнях токсичності повторних доз на тваринах основними висновками були зміни в репродуктивних органах самців (зменшення маси органа з атрофією передміхурової залози та епідидимідів). Ці ефекти виникали при системному впливі в діапазоні очікуваного впливу на людину або нижчому (на основі порівняння AUC). Додаткові зміни в репродуктивних тканинах включали мінімальне збільшення вакуолізації гіпофіза, атрофію та зниження секреторності насінних пухирців і молочних залоз у щурів, а також гіпоспермію яєчок, розширення сім’яних канальців і дегенерацію у собак. Зміни в чоловічих репродуктивних органах в обох видів відповідали фармакологічній активності даролутаміду та зникали або частково зникали після 4–8-тижневого періоду відновлення.
Ембріотоксичність/тератогенність. Дослідження токсичного впливу на плід не проводилися.
Репродуктивна токсичність. Дослідження репродуктивної токсичності не проводились. Однак фертильність самців, ймовірно, буде порушена з огляду на результати досліджень токсичності повторних доз у тварин, які узгоджуються з фармакологічною активністю даролутаміду.
Генотоксичність і канцерогенність. Даролутамід не індукував мутації в аналізі мікробного мутагенезу (Ames). У високих концентраціях даролутамід індукував структурні хромосомні аберації in vitro в культивованих лімфоцитах людини. Однак у комбінованому мікроядерному тесті кісткового мозку in vivo та аналізі Comet у печінці та дванадцятипалій кишці щура не спостерігалося генотоксичності при експозиціях, що перевищують максимальну експозицію для людини.
Пероральне введення даролутаміду самцям трансгенних мишей rasH2 протягом 6 місяців не виявило канцерогенного потенціалу при застосуванні в дозах до 1000 мг/кг/добу, що перевищує клінічну експозицію (AUC) даролутаміду в 0,9–1,3 раза та кето-даролутаміду в 2,1–2,3 раза при застосуванні у рекомендованій клінічній добовій дозі 1200 мг/добу. На основі цього дослідження не можна повністю виключити канцерогенний ризик при застосуванні даролутаміду.
Клінічні характеристики
Показання
Лікарський засіб Нубека показаний для лікування у дорослих чоловіків:
- неметастатичного кастраційно-резистентного раку передміхурової залози (нмКРРПЗ) з наявністю високого ризику метастазування (див. розділ «Фармакологічні властивості»);
- метастатичного гормоночутливого раку передміхурової залози (мГЧРПЗ) – у комбінації з доцетакселом та андрогендеприваційною терапією (див. розділ «Фармакологічні властивості»).
Протипоказання
Підвищена чутливість до діючої речовини або до допоміжних речовин.
Протипоказаний вагітним та жінкам репродуктивного віку.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Вплив інших лікарських засобів на даролутамід
Індуктори CYP3A4 і P-gp
Даролутамід є субстратом CYP3A4 і P-глікопротеїну (P-gp).
Використання сильних і помірних індукторів CYP3A4 та індукторів P-gp (наприклад карбамазепіну, фенобарбіталу, звіробою, фенітоїну та рифампіцину) під час лікування даролутамідом не рекомендується, за винятком випадків, коли немає терапевтичної альтернативи. Слід розглянути можливість вибору альтернативного супутнього лікарського засобу, який не індукує або має слабкий потенціал індукувати CYP3A4 або P-gp.
Повторний прийом рифампіцину (600 мг), потужного індуктора CYP3A4 та P-gp, разом з одноразовою дозою даролутаміду (600 мг) під час їди призводило до зниження середньої експозиції (AUC0-72) на 72 % і зниження Cmax даролутаміду на 52 %.
Інгібітори CYP3A4, P-gp і BCRP
Даролутамід є субстратом CYP3A4, P-gp і білка резистентності раку молочної залози (БРРМЗ).
У разі застосування інгібіторів CYP3A4, P-gp або БРРМЗ клінічно значущої взаємодії між препаратами не очікується. Даролутамід можна призначати одночасно з інгібіторами CYP3A4, P-gp або БРРМЗ. Одночасне застосування даролутаміду з комбінованим P-gp і потужним інгібітором CYP3A4 збільшує експозицію даролутаміду, що може збільшити ризик побічних реакцій на даролутамід. Рекомендується частіше контролювати стан пацієнта щодо появи побічних реакцій на даролутамід і за потреби змінювати дозу даролутаміду.
Застосування ітраконазолу (200 мг двічі на добу в день 1 і один раз на добу протягом наступних 7 днів), сильного інгібітора CYP3A4, P-gp і БРРМЗ, з одноразовою дозою даролутаміду (600 мг на день 5 разом з їжею) призвело до 1,7-кратного збільшення середньої експозиції (AUC0-72) і 1,4-кратного збільшення Cmax даролутаміду.
Інгібітори UGT1A9
Даролутамід є субстратом UGT1A9. У разі застосування інгібітора UGT1A9 клінічно значущої взаємодії між лікарськими засобами не очікується. Даролутамід можна призначати одночасно з інгібіторами UGT1A9.
Популяційний фармакокінетичний аналіз показав, що одночасне застосування інгібіторів UGT1A9 з даролутамідом призвело до 1,2-кратного збільшення експозиції (AUC0-72) даролутаміду.
Доцетаксел
Застосування даролутаміду в комбінації з доцетакселом не призвело до клінічно значущих змін фармакокінетики даролутаміду у пацієнтів з мГРРПЗ (див. розділ «Фармакологічні властивості»).
Вплив даролутаміду на інші лікарські засоби
Субстрати БРРМЗ, OATP1B1 і OATP1B3
Даролутамід є інгібітором білка резистентності раку молочної залози і поліпептидів, що транспортують органічні аніони (OATP) 1B1 і 1B3.
Слід уникати одночасного застосування розувастатину, за винятком випадків, коли немає терапевтичної альтернативи. Слід розглянути можливість вибору альтернативного супутнього лікарського засобу з меншим потенціалом інгібування БРРМЗ, OATP1B1 та OATP1B3.
Застосування даролутаміду (600 мг двічі на добу протягом 5 днів) перед одноразовим прийомом розувастатину (5 мг) разом з їжею призвело до приблизно 5-кратного збільшення середньої експозиції (AUC) і Cmax розувастатину.
Якщо це можливо, слід уникати одночасного застосування даролутаміду з іншими субстратами БРРМЗ. Одночасне застосування даролутаміду може підвищити концентрацію інших супутніх препаратів – субстратів БРРМЗ, OATP1B1 та OATP1B3 (таких як метотрексат, сульфасалазин, флувастатин, аторвастатин, пітавастатин) у плазмі крові. Тому рекомендується спостерігати за станом пацієнтів щодо виникнення побічних реакцій на застосування субстратів БРРМЗ, OATP1B1 та OATP1B3. Крім того, при одночасному застосуванні з даролутамідом слід дотримуватися відповідних рекомендацій, викладених в інформації про ці субстрати.
Субстрати P-gp
У разі введення субстрату P-gp не очікується клінічно значущої взаємодії між лікарськими засобами. Даролутамід можна призначати одночасно з субстратами P-gp (наприклад з дигоксином, верапамілом або ніфедипіном). Одночасне застосування даролутаміду разом із чутливим субстратом P-gp дабігатрану етексилатом не призвело до підвищення експозиції (AUC та Cmax) дабігатрану.
Субстрати CYP3A4
Даролутамід є слабким індуктором CYP3A4.
У разі введення субстрату CYP не очікується клінічно значущої взаємодії між лікарськими засобами. Даролутамід можна призначати одночасно із субстратами CYP (наприклад з варфарином, L-тироксином, омепразолом).
Застосування даролутаміду (600 мг двічі на добу протягом 9 днів) перед одноразовим прийомом одноразової дози чутливого субстрату CYP3A4 мідазоламу (1 мг) разом із їжею призвело до зниження середньої експозиції (AUC) і Сmax мідазоламу на 29 % і 32 % відповідно. Даролутамід не пригнічував метаболізм окремих субстратів CYP in vitro в клінічно значущих концентраціях.
Доцетаксел
Застосування даролутаміду в комбінації з доцетакселом не призводило до клінічно значущих змін фармакокінетики доцетакселу у пацієнтів з мГРРПЗ (див. розділ «Фармакологічні властивості»).
Лікарські засоби, що подовжують інтервал QT
Оскільки андрогендеприваційна терапія може подовжувати інтервал QT, слід ретельно оцінити одночасне застосування з лікарськими засобами, які, як відомо, подовжують інтервал QT, або лікарськими засобами, які можуть індукувати torsade de pointes. До них належать такі лікарські засоби, як антиаритмічні лікарські засоби класу IA (наприклад хінідин, дизопірамід) або класу III (наприклад аміодарон, соталол, дофетилід, ібутилід), метадон, моксифлоксацин та антипсихотичні засоби (наприклад галоперидол).
Особливості застосування
Порушення функції нирок
Наявні дані щодо застосування пацієнтам із тяжкою нирковою недостатністю обмежені.
Оскільки експозиція може бути збільшена, за станом таких пацієнтів слід ретельно спостерігати щодо виникнення побічних реакцій (див. розділ «Особливості застосування» та підрозділ «Фармакокінетика»).
Порушення функції печінки
Наявні дані щодо застосування пацієнтам із помірним порушенням функції печінки обмежені. Не вивчалося застосування даролутаміду пацієнтам із тяжким порушенням функції печінки.
Оскільки експозиція може бути збільшена, за станом пацієнтів слід ретельно спостерігати щодо побічних реакцій (див. розділ «Особливості застосування» та підрозділ «Фармакокінетика»).
Нещодавнє серцево-судинне захворювання
Пацієнти з клінічно значущими серцево-судинними захворюваннями протягом останніх 6 місяців, включаючи інсульт, інфаркт міокарда, тяжку/нестабільну стенокардію, шунтування коронарної/периферичної артерії та симптоматичну застійну серцеву недостатність, були виключені з клінічних досліджень. Таким чином, безпека застосування даролутаміду для цих пацієнтів не встановлена.
У разі призначення лікарського засобу Нубека пацієнту з клінічно значущим серцево-судинним захворюванням лікувати зазначене захворювання слід відповідно до встановлених рекомендацій.
Гепатотоксичність
У разі виявлення відхилень показників функції печінки, що вказує на ідіосинкратичне ураження печінки, спричинене застосуванням лікарських засобів, слід остаточно припинити лікування даролутамідом (див. розділ «Побічні реакції»).
Одночасне застосування з іншими лікарськими засобами
Застосування сильних індукторів CYP3A4 і P-gp під час лікування даролутамідом може знизити концентрацію даролутаміду в плазмі крові, тому не рекомендується, за винятком випадків, коли немає терапевтичної альтернативи. Слід розглянути можливість вибору альтернативного супутнього лікарського засобу з меншим потенціалом індукції CYP3A4 або P-gp (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
За станом пацієнтів слід спостерігати щодо виникнення побічних реакцій при застосуванні субстратів BCRP, OATP1B1 та OATP1B3, оскільки одночасне застосування з даролутамідом може підвищити концентрацію цих субстратів у плазмі.
Слід уникати одночасного застосування з розувастатином, за винятком випадків, коли немає терапевтичної альтернативи (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Терапія депривації андрогенів може подовжити інтервал QT
У пацієнтів з факторами ризику подовження інтервалу QT в анамнезі та у пацієнтів, які одночасно отримують лікарські засоби, здатні подовжувати інтервал QT (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»), лікарі повинні оцінити співвідношення користь/ризик, у тому числі ймовірність torsade de pointes, перед початком терапії лікарським засобом Нубека.
Інформація про допоміжні речовини
Лікарський засіб Нубека містить лактозу. Пацієнтам із рідкісними спадковими порушеннями, наприклад із непереносимістю галактози, дефіцитом лактази або порушенням всмоктування глюкози-галактози, не слід приймати цей лікарський засіб.
Застосування у період вагітності або годування груддю
Цей лікарський засіб протипоказаний жінкам репродуктивного віку. Він не повинен застосовуватися вагітними жінками або жінками, які годують груддю (див. розділи «Показання» та «Протипоказання»).
Жінки репродуктивного віку / контрацепція для чоловіків та жінок
Невідомо, чи присутні даролутамід або його метаболіти в спермі. Якщо пацієнт живе статевим життям з жінкою репродуктивного віку, під час та протягом 1 тижня після завершення терапії лікарським засобом Нубека для запобігання вагітності слід використовувати високоефективний метод контрацепції (< 1 % частоти невдач на рік).
Вагітність
З огляду на механізм дії даролутамід може завдати шкоди плоду. Доклінічні дослідження репродуктивної токсичності не проводились (див. розділ «Доклінічні дані з безпеки»).
Невідомо, чи присутні даролутамід або його метаболіти в спермі. Якщо пацієнт живе статевим життям з вагітною жінкою, під час та протягом 1 тижня після завершення терапії лікарським засобом Нубека слід використовувати презерватив. Слід уникати впливу інгібіторів андрогенних рецепторів на плід через передачу сім’яної рідини вагітній жінці, оскільки це може вплинути на розвиток плода.
Годування груддю
Невідомо, чи виділяється даролутамід або його метаболіти в грудне молоко. Дослідження на тваринах для оцінки виділення даролутаміду або його метаболітів з молоком не проводились (див. розділ «Доклінічні дані з безпеки»). Не можна виключити ризик для дитини, яка знаходиться на грудному вигодовуванні.
Фертильність
Немає даних про вплив даролутаміду на фертильність людини.
Згідно з дослідженнями на тваринах Нубека може погіршувати фертильність у чоловіків з репродуктивним потенціалом (див. розділ «Доклінічні дані з безпеки»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Лікарський засіб Нубека не впливає або має незначний вплив на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Спосіб застосування та дози
Лікування повинен розпочинати та контролювати лікар, який має досвід лікування раку простати.
Дозування
Рекомендована доза становить 600 мг даролутаміду (дві таблетки по 300 мг) двічі на добу, що еквівалентно загальній добовій дозі 1200 мг (див. підрозділ «Фармакокінетика»).
Застосування даролутаміду слід продовжувати до прогресування захворювання або неприйнятної токсичності.
Під час лікування пацієнтів, які не були кастровані хірургічним шляхом, слід продовжувати медикаментозну кастрацію за допомогою аналога ЛГРГ.
Метастатичний гормоночутливий рак передміхурової залози (мГЧРПЗ)
Пацієнти з мГЧРПЗ повинні розпочинати лікування даролутамідом у комбінації з доцетакселом (див. розділ «Фармакологічні властивості»). Перший із 6 циклів доцетакселу слід призначити протягом 6 тижнів після початку терапії даролутамідом. Слід дотримуватися рекомендацій, наведених в інструкції для медичного застосування доцетакселу. Лікування даролутамідом слід продовжувати до прогресування захворювання або неприйнятної токсичності, навіть якщо цикл застосування доцетакселу відкладається, переривається або припиняється.
Пропущена доза
Пропущену дозу слід прийняти, як тільки пацієнт згадає, але тільки в той же день. Пацієнт не повинен приймати 2 дози, щоб компенсувати пропущену дозу.
Зміна дозування
Якщо у пацієнта спостерігається токсичність ≥ 3-го ступеня або непереносима побічна реакція, пов’язана із застосуванням даролутаміду (див. розділи «Особливості застосування» та «Побічні реакції»), дозу не слід застосувати або слід зменшити дозування до 300 мг двічі на добу до полегшення симптомів. Надалі лікування можна відновити у дозі 600 мг двічі на добу. Зниження дози до менше 300 мг двічі на добу не рекомендується, оскільки ефективність такого застосування не встановлена.
Особливі групи пацієнтів
Пацієнти літнього віку. Для пацієнтів літнього віку корекція дози не потрібна (див. підрозділ «Фармакокінетика»).
Порушення функції нирок. Пацієнтам із легким або помірним порушенням функції нирок корекція дози не потрібна. Для пацієнтів із тяжкою нирковою недостатністю (ШКФ 15–29 мл/хв/1,73 м2), які не отримують гемодіаліз, рекомендована початкова доза становить 300 мг двічі на добу (див. розділ «Особливості застосування» та підрозділ «Фармакокінетика»).
Порушення функції печінки. Пацієнтам з легким ступенем печінкової недостатності корекція дози не потрібна. Наявні дані щодо фармакокінетики даролутаміду при помірній печінковій недостатності обмежені. Не досліджувалося застосування даролутаміду пацієнтам із тяжкою печінковою недостатністю.
Для пацієнтів із помірною та тяжкою печінковою недостатністю (класи B та C за Чайлдом – П’ю) рекомендована початкова доза становить 300 мг двічі на добу (див. розділ «Особливості застосування» та підрозділ «Фармакокінетика»).
Спосіб застосування
Лікарський засіб Нубека призначений для перорального застосування.
Таблетки слід приймати цілими під час їди (див. підрозділ «Фармакокінетика»).
Діти
Відсутній досвід застосування даролутаміду педіатричним пацієнтам.
Передозування
Найвища доза даролутаміду, досліджена клінічно, становила 900 мг двічі на день, що еквівалентно загальній добовій дозі 1800 мг. При цій дозі не спостерігалося токсичних ефектів, що обмежують дозу. Зважаючи на насичувальну абсорбцію (див. підрозділ «Фармакокінетика») та відсутність доказів гострої токсичності, не очікується, що прийом дози даролутаміду, яка перевищує рекомендовану, призведе до токсичних ефектів.
У разі прийому дози, що перевищує рекомендовану, лікування даролутамідом можна продовжити наступною дозою за розкладом.
Специфічного антидоту для даролутаміду немає і симптоми передозування не встановлені.
Побічні реакції
Найбільш часті побічні реакції, що спостерігалися у пацієнтів з:
- нмКРРПЗ, які отримували даролутамід, – втома/астенічні стани (15,8 %);
- мГЧРПЗ, які отримували даролутамід у комбінації з доцетакселом, – висипання (16,6 %) та гіпертензія (13,8 %).
Щоб отримати додаткову інформацію щодо безпеки при комбінованому застосуванні даролутаміду, потрібно звернутися до інструкції для медичного застосування окремих лікарських засобів.
Побічні реакції, що спостерігалися у пацієнтів з нмКРРПЗ, які отримували даролутамід, наведені в таблиці 3. Побічні реакції, що спостерігалися у пацієнтів з мГЧРПЗ, які отримували даролутамід у комбінації з доцетакселом, наведені в таблиці 4.
Побічні реакції класифікуються відповідно до систем органів. Вони згруповані відповідно до їхньої частоти. Частота виникнення побічних реакцій визначається таким чином: дуже часто (≥ 1/10), часто (≥ 1/100 до < 1/10), нечасто (≥ 1/1000 до < 1/100), рідко (≥ 1/10000 до < 1/1000), дуже рідко (< 1/10000), невідомо (не можна оцінити за наявними даними). У кожній групі за частотою побічні реакції представлено в порядку зменшення серйозності.
Таблиця 3. Побічні реакції, зареєстровані в дослідженні ARAMISa
|
Клас системи органів (MedDRA) |
Дуже часто |
Часто |
|
Серцеві розлади |
Ішемічна хвороба серцяb, серцева недостатністьc |
|
|
Розлади шкіри та підшкірної клітковини |
Висипd |
|
|
Розлади опорно-рухового апарату та сполучної тканини |
Біль у кінцівках, кістково-м’язовий біль, переломи |
|
|
Загальні розлади та реакції у місці введення |
Втома/ астенічні станиe |
|
|
Дослідженняf |
Зменшення кількості нейтрофілів, підвищення рівня білірубіну в крові, підвищення АСТ |
а Середня тривалість впливу становила 14,8 місяця (діапазон від 0,0 до 44,3 місяця) у пацієнтів, які отримували даролутамід, і 11,0 місяця (діапазон від 0,1 до 40,5 місяця) у пацієнтів, які отримували плацебо.
b Включає атеросклероз коронарної артерії, ішемічну хворобу коронарної артерії, оклюзію коронарної артерії, стеноз коронарної артерії, гострий коронарний синдром, гострий інфаркт міокарда, стенокардію, нестабільну стенокардію, інфаркт міокарда, ішемію міокарда.
c Включає серцеву недостатність, гостру серцеву недостатність, хронічну серцеву недостатність, застійну серцеву недостатність, кардіогенний шок.
d Включає висип, макулярний висип, макулопапульозний висип, папульозний висип, пустульозний висип, еритему, дерматит.
e Включає втому і астенію, млявість і нездужання.
f Загальні термінологічні критерії побічних реакцій, версія 4.03. Частота базується на значеннях, які повідомляються як відхилення лабораторних показників.
Таблиця 4. Побічні реакції, зареєстровані у пацієнтів з мГЧРПЗ, які отримували даролутамід у комбінації з доцетакселом у дослідженні ARASENSа, b
|
Клас системи органів (MedDRA) |
Дуже часто |
Часто |
|
Судинні розлади |
Артеріальна гіпертензіяc |
|
|
Розлади шкіри та підшкірної клітковини |
Висипd, e |
|
|
Розлади опорно-рухового апарату та сполучної тканини |
Переломи |
|
|
Розлади репродуктивної системи та молочних залоз |
Гінекомастія |
|
|
Дослідженняf |
Зменшення кількості нейтрофілів, підвищення рівня білірубіну в крові, підвищення АЛТ, підвищення АСТ |
а Середня тривалість впливу становила 41,0 місяця (діапазон від 0,1 до 56,5 місяця) у пацієнтів, які отримували даролутамід + доцетаксел, і 16,7 місяця (діапазон від 0,3 до 55,8 місяця) у пацієнтів , які отримували плацебо + доцетаксел.
b Частота побічних реакцій не може бути пов’язана з даролутамідом окремо, але може залежати від інших лікарських засобів, які використовуються в комбінації.
c Включає артеріальну гіпертензію, підвищення артеріального тиску, гіпертонічний криз.
d Включає висип, медикаментозний висип, еритематозний висип, фолікулярний висип, макулярний висип, макулопапульозний висип, папульозний висип, свербіж, пустульозний висип, везикулярний висип, еритему, дерматит.
e Частота була найвищою протягом перших 6 місяців лікування.
f Загальні термінологічні критерії побічних реакцій, версія 4.03. Частота базується на значеннях, які повідомляються як відхилення лабораторних показників.
Опис окремих побічних реакцій
Показники функції печінки
При лікуванні даролутамідом повідомлялося про випадки ідіосинкратичного ураження печінки, спричиненого прийомом лікарських засобів, із підвищенням аланінамінотрансферази (АЛТ) та/або аспартатамінотрансферази (АСТ) до ≥ 5 і ≥ 20 разів від верхньої межі норми (ВМН) 3 і 4 ступеня, включаючи підвищення рівня трансаміназ з одночасним підвищенням загального білірубіну до 2 × ВМН. Час до початку варіював від 1 місяця до 12 місяців після початку застосування даролутаміду. У багатьох випадках підвищення АЛТ і АСТ було оборотним після припинення прийому даролутаміду. Щодо рекомендації див. розділ «Особливості застосування».
Неметастатичний кастраційно-резистентний рак передміхурової залози (нмКРРПЗ)
Втома
Повідомлялося про втомлюваність/ астенічні стани у 15,8 % пацієнтів, які отримували даролутамід, і у 11,4 % пацієнтів, які отримували плацебо. Події з найгіршим ступенем 3 були зареєстровані у 0,6 % пацієнтів, які отримували даролутамід, і у 1,1 % пацієнтів, які отримували плацебо. Втома (не включаючи астенію, млявість або нездужання) спостерігалася у більшості випадків (12,1 % пацієнтів, які отримували даролутамід, і 8,7 % пацієнтів, які отримували плацебо).
Переломи
Переломи виникли у 4,2 % пацієнтів, які отримували даролутамід, і у 3,6 % пацієнтів, які отримували плацебо.
Ішемічна хвороба серця та серцева недостатність
Ішемічна хвороба серця виникла у 3,2 % пацієнтів, які отримували даролутамід, і у 2,5 % пацієнтів, які отримували плацебо. Події 5 ступеня спостерігалися у 0,3 % пацієнтів, які отримували даролутамід, і у 0,2 % пацієнтів, які отримували плацебо. Серцева недостатність виникла у 1,9 % пацієнтів, які отримували даролутамід, і у 0,9 % пацієнтів, які отримували плацебо.
Зменшення кількості нейтрофілів
Зменшення кількості нейтрофілів спостерігалося як відхилення лабораторних показників у 19,6 % пацієнтів, які отримували даролутамід, і у 9,4 % пацієнтів, які отримували плацебо. Середній час до досягнення найнижчої точки становив 256 днів.
Відхилення лабораторних показників виявлялися переважно 1–2 ступеня інтенсивності. Зменшення кількості нейтрофілів 3 і 4 ступеня спостерігалося у 3,5 % і 0,5 % пацієнтів відповідно. Лише один пацієнт назавжди припинив прийом даролутаміду через нейтропенію. Нейтропенія була тимчасовою або оборотною (88 % пацієнтів) і не була пов’язана з будь-якими клінічно значущими ознаками чи симптомами.
Підвищення рівня білірубіну у крові
Повідомлялося про підвищення рівня білірубіну як відхилення лабораторних показників у 16,4 % пацієнтів, які отримували даролутамід, і у 6,9 % пацієнтів, які отримували плацебо. Епізоди були переважно 1 або 2 ступеня інтенсивності, не пов’язані з будь-якими клінічно значущими ознаками чи симптомами та були оборотними після припинення застосування даролутаміду. Підвищення рівня білірубіну 3 ступеня спостерігалося у 0,1 % пацієнтів, які отримували даролутамід, і у 0 % пацієнтів, які отримували плацебо. У групі даролутаміду середній час до першого початку підвищення рівня білірубіну становив 153 дні, а середня тривалість першого епізоду становила 182 дні. У жодного пацієнта не було припинено лікування через підвищення рівня білірубіну.
Підвищення АСТ
Повідомлялося про підвищення АСТ як відхилення лабораторних показників у 22,5 % пацієнтів, які отримували даролутамід, і у 13,6 % пацієнтів, які отримували плацебо. Епізоди були переважно 1 або 2 ступеня інтенсивності, не пов’язані з будь-якими клінічно значущими ознаками чи симптомами та були оборотними після припинення застосування даролутаміду. Підвищення АСТ 3 ступеня спостерігалося у 0,5 % пацієнтів, які отримували даролутамід, і у 0,2 % пацієнтів, які отримували плацебо. У групі даролутаміду середній час до першого початку підвищення АСТ становив 258 днів, а середня тривалість першого епізоду становила 118 днів. У жодного пацієнта не було припинено лікування через підвищення АСТ.
Метастатичний гормоночутливий рак передміхурової залози (мГЧРПЗ)
Артеріальна гіпертензія
У дослідженні ARASENS про артеріальну гіпертензію повідомлялося у 13,8 % пацієнтів, які отримували даролутамід + доцетаксел, і у 9,4 % пацієнтів, які отримували плацебо + доцетаксел.
Артеріальна гіпертензія 3 ступеня була зареєстрована у 6,4 % пацієнтів, які отримували даролутамід + доцетаксел, порівняно з 3,5 % пацієнтів, які отримували плацебо + доцетаксел. По одному пацієнту з гіпертензію 4 ступеня було в кожній групі лікування.
Повідомлялося про один випадок гіпертензії 5 ступеня з артеріосклерозом 5 ступеня в групі даролутамід + доцетаксел. Цей пацієнт мав давню історію гіпертензії та паління, і випадок стався більше ніж через 3 роки після початку лікування даролутамідом. Про випадки артеріальної гіпертензії повідомлялося частіше у пацієнтів без гіпертензії в анамнезі в обох групах лікування.
Переломи
Переломи виникали у 7,5 % пацієнтів, які отримували даролутамід + доцетаксел, і у 5,1 % пацієнтів, які отримували плацебо + доцетаксел.
Зменшення кількості нейтрофілів
Повідомлялося про зниження кількості нейтрофілів як відхилення лабораторних показників у 50,6 % пацієнтів, які отримували даролутамід + доцетаксел, і у 45,5 % пацієнтів, які отримували плацебо + доцетаксел. Зменшення кількості нейтрофілів 3 і 4 ступеня спостерігалося у 34,4 % пацієнтів, які отримували даролутамід + доцетаксел, і у 31,4 % пацієнтів, які отримували плацебо + доцетаксел. В обох групах лікування кількість нейтрофілів зменшилася, а нейтропенія була найвищою протягом перших місяців лікування, після чого частота та тяжкість подій зменшилися.
Підвищення рівня білірубіну у крові
Підвищення рівня білірубіну у крові спостерігалося як відхилення лабораторних показників у 19,6 % пацієнтів, які отримували даролутамід + доцетаксел, і у 10,0 % пацієнтів, які отримували плацебо + доцетаксел. Події були переважно 1 або 2 ступеня інтенсивності. Підвищення білірубіну 3 і 4 ступеня спостерігалося у 0,5 % пацієнтів, які отримували даролутамід + доцетаксел, і у 0,3 % пацієнтів, які отримували плацебо + доцетаксел.
Підвищення АЛТ і АСТ
Повідомлялося про підвищення АЛТ як відхилення лабораторних показників у 42,3 % пацієнтів, які отримували даролутамід + доцетаксел, і у 38,0 % пацієнтів, які отримували плацебо + доцетаксел. Повідомлялося про підвищення АСТ як відхилення лабораторних показників у 43,9 % пацієнтів, які отримували даролутамід + доцетаксел, і у 39,3 % пацієнтів, які отримували плацебо + доцетаксел. Підвищення АЛТ і АСТ було переважно 1 ступеня інтенсивності. Підвищення АЛТ 3 і 4 ступеня спостерігалося у 3,7 % пацієнтів, які отримували даролутамід + доцетаксел, і у 3,0 % пацієнтів, які отримували плацебо + доцетаксел. Підвищення АСТ 3 і 4 ступеня спостерігалося у 3,6 % пацієнтів, які отримували даролутамід + доцетаксел, і у 2,3 % пацієнтів, які отримували плацебо + доцетаксел.
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності. 3 роки.
Умови зберігання
Не потребує спеціальних умов зберігання. Зберігати у недоступному для дітей місці.
Упаковка
По 16 таблеток у блістері, по 7 блістерів у картонній пачці.
Категорія відпуску. За рецептом.
Виробник. Оріон Корпорейшн, Оріон Фарма.
Місцезнаходження виробника та його адреса місця провадження діяльності
Джоенсуункату 7, 24100 Сало, Фінляндія.
