КСОЛАР
-
Швейцарія Новартіс Фарма АГФорма выпуску: розчин для ін'єкцій, 150 мг/1 мл; по 1 мл розчину для ін'єкцій у попередньо наповненому шприці з закріпленою голкою та кришкою на голку; по 1 попередньо наповненому шприцу у блістері; 1 блістер у картонній коробціСклад: 1 попередньо наповнений шприц з 1 мл розчину містить 150 мг омалізумабу*/* Омалізумаб – це гуманізоване моноклональне антитіло, що виробляється за технологією рекомбінантної ДНК у клітинах яєчника китайського хом’яка (СНО)Умови відпуску: за рецептомНомер реєстраційного посвідчення: UA/9055/02/02код АТС: R03DX05Термін придатності: 18 місяців
-
Швейцарія Новартіс Фарма АГФорма выпуску: розчин для ін'єкцій, 75 мг/0,5 мл; по 0,5 мл розчину для ін'єкцій у попередньо наповненому шприці з закріпленою голкою та кришкою на голку; по 1 попередньо наповненому шприцу у блістері; 1 блістер у картонній коробціСклад: 1 попередньо наповнений шприц з 0,5 мл розчину містить 75 мг омалізумабу*/* Омалізумаб – це гуманізоване моноклональне антитіло, що виробляється за технологією рекомбінантної ДНК у клітинах яєчника китайського хом’яка (СНО).Умови відпуску: за рецептомНомер реєстраційного посвідчення: UA/9055/02/01код АТС: R03DX05Термін придатності: 18 місяців
-
Швейцарія Новартіс Фарма АГФорма выпуску: порошок для розчину для ін`єкцій по 150 мг; 1 флакон з порошком у комплекті з розчинником (вода для ін`єкцій) по 2 мл в ампулах № 1 в упаковціСклад: 1 флакон містить 150 мг омалізумабу*; відтворений Ксолар містить 125 мг/мл омалізумабу (150 мг у 1,2 мл)Умови відпуску: за рецептомНомер реєстраційного посвідчення: UA/9055/01/02код АТС: R03DX05Термін придатності: 4 роки
-
Швейцарія Новартіс Фарма АГФорма выпуску: порошок для розчину для ін`єкцій по 75 мг; 1 флакон з порошком у комплекті з розчинником (вода для ін`єкцій) по 2 мл в ампулах № 1 в упаковціСклад: 1 флакон містить 75 мг омалізумабу*; відтворений Ксолар містить 125 мг/мл омалізумабу (75 мг у 0,6 мл)Умови відпуску: за рецептомНомер реєстраційного посвідчення: UA/9055/01/01код АТС: R03DX05Термін придатності: 4 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
КСОЛАР
(XOLAIRÒ)
Склад:
діюча речовина: omalizumab;
1 попередньо наповнений шприц з 0,5 мл розчину містить 75 мг омалізумабу*;
допоміжні речовини: L-аргініну гідрохлорид, L-гістидину гідрохлориду моногідрат; L-гістидин, полісорбат 20, вода для ін’єкцій
або
1 попередньо наповнений шприц з 1 мл розчину містить 150 мг омалізумабу*;
допоміжні речовини: L-аргініну гідрохлорид, L-гістидину гідрохлориду моногідрат; L-гістидин, полісорбат 20, вода для ін’єкцій.
* Омалізумаб – це гуманізоване моноклональне антитіло, що виробляється за технологією рекомбінантної ДНК у клітинах яєчника китайського хом’яка (СНО).
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: розчин від прозорого до дещо каламутного; від безбарвного до слабо коричнювато-жовтого кольору.
Фармакотерапевтична група. Засоби для системного застосування при обструктивних захворюваннях дихальних шляхів. Код АТХ R03D X05.
Фармакологічні властивості.
Фармакодинаміка.
Омалізумаб є гуманізованим моноклональним антитілом, отриманим з рекомбінантної ДНК, що селективно зв’язується з людським імуноглобуліном Е (IgE). Антитілом є каппа-IgG1, що містить людську каркасну ділянку з комплементарно-визначальною ділянкою мишиного вихідного антитіла, яка зв’язується з IgE. Лікування Ксоларом інгібує запалення, опосередковане IgE, про що свідчать зниження рівня еозинофілів крові та тканин та зменшення рівня медіаторів запалення, включаючи IL-4, IL-5 та IL-13, за допомогою вроджених, адаптивних та неімунних клітин.
Механізм дії
Омалізумаб зв’язується з IgE і попереджає його зв’язування з FсεRI (рецептором, що має високу спорідненість з IgE) на базофілах і опасистих клітинах, знижуючи таким чином кількість вільного IgE, здатного запустити алергічний каскад. Лікування омалізумабом пацієнтів з атопічними захворюваннями призводило до значної супресивної дії на FсεRI-рецептори базофілів.
Фармакодинамічні ефекти
Алергічна астма
In vitro вивільнення гістаміну після стимуляції алергеном базофілів, отриманих від пацієнтів, які застосовували Ксолар, було меншим приблизно на 90 % порівняно зі значенням, отриманим до лікування.
Під час клінічних досліджень у пацієнтів з алергічною астмою спостерігалося дозозалежне зниження рівня вільного IgE в сироватці крові протягом однієї години після введення першої дози, що зберігалося в проміжках між дозами. Через один рік після припинення лікування Ксоларом рівні IgE поверталися до показника до початку лікування, при цьому не спостерігалося зворотної реакції відносно рівня IgE після виведення з організму лікарського засобу.
Хронічний риносинусит з назальними поліпами (ХРСзНП)
У клінічних дослідженнях у пацієнтів з ХРСзНП лікування Ксоларом призвело до зменшення вмісту вільного IgE у сироватці крові (приблизно на 95 %) та збільшення загального рівня IgE у сироватці крові подібною мірою, як це спостерігалося у пацієнтів з алергічною астмою. Загальний рівень IgE у сироватці збільшився за рахунок утворення комплексів омалізумабу з IgE, які мають більш повільну швидкість виведення порівняно із вільним IgE.
Хронічна спонтанна кропив’янка (ХСК)
Механізм дії
Омалізумаб зв’язується з IgE та знижує рівні вільного IgE у сироватці. Далі відбувається пригнічення рецепторів IgE (FcεRI) на клітинах. Повністю не з’ясовано, яким чином це призводить до купірування симптомів хронічної спонтанної кропив’янки.
Фармакодинамічні ефекти
У клінічних дослідженнях у пацієнтів з ХСК максимальне пригнічення рівня вільного IgE спостерігали протягом трьох днів після першого підшкірного введення. Після повторного введення один раз на 4 тижні рівні вільного IgE в сироватці крові до введення залишались стабільними між 12-м та 24-м тижнями лікування. Після припинення прийому лікарського засобу Ксолар рівні вільного IgE збільшувались, досягаючи протягом 16 тижнів рівнів, що спостерігались до лікування.
Клінічний досвід при алергічній астмі
Дорослі і діти віком від 12 років
Ефективність та безпека застосування Ксолару були продемонстровані в ході 28-тижневого подвійно сліпого плацебо-контрольованого дослідження (дослідження 1) за участю 419 пацієнтів у віці 12–79 років з тяжкою алергічною астмою, у яких була знижена функція легень (ОФВ1 40–80 % від належного) і погано контролювалися симптоми астми, незважаючи на застосування високих доз інгаляційних кортикостероїдів і бета2-агоністів тривалої дії. У дослідження включали хворих з декількома випадками загостреннями астми, лікування яких вимагало системного застосування кортикостероїдів або госпіталізації, або невідкладної допомоги у зв’язку з загостренням бронхіальної астми, незважаючи на безперервне лікування високими дозами інгаляційних кортикостероїдів і бета2-агоністів тривалої дії. Ксолар або плацебо вводили підшкірно як доповнення до терапії беклометазону дипропіонатом (або еквівалентом) у дозі > 1000 мкг і бета2-агоністом тривалої дії. Також як підтримуюча терапія були дозволені пероральні кортикостероїди, теофілін і модифікатори лейкотрієну (22 %, 27 % і 35 % пацієнтів відповідно).
Частота загострень астми, які потребують лікування із застосуванням системних кортикостероїдів, була первинною кінцевою точкою. Омалізумаб знижував частоту загострень астми на 19 % (р = 0,153). Додаткові оцінки, які показали статистичну значущість (р < 0,05) на користь Ксолару, включали зниження частоти тяжких загострень (за яких легенева функція пацієнта була знижена до рівня нижче 60 % від найкращої особистої і вимагалося застосування системних кортикостероїдів) і пов’язаних з астмою позапланових візитів до лікаря (що складалися з госпіталізацій, невідкладної допомоги та незапланованого відвідування лікаря), а також покращання загальної оцінки лікарем ефективності лікування, пов’язаної з астмою якості життя (AQL), симптомів астми та легеневої функції.
При аналізі підгрупи пацієнтів із загальним рівнем IgE ≥ 76 МО/мл до лікування встановлено більш імовірну клінічно значущу користь застосування Ксолару. У цих хворих під час дослідження 1 Ксолар знижував частоту загострень на 40 % (р = 0,002). Крім того, у програмі вивчення застосування Ксолару при тяжкій астмі відзначено більше число пацієнтів з клінічно значущою відповіддю в групі із загальним рівнем IgE ≥ 76 МО/мл, див. таблицю 1.
Таблиця 1
Результати дослідження 1
|
Популяція дослідження 1 загалом |
||
|
Дослідження |
Ксолар N = 209 |
Плацебо N = 210 |
|
Загострення астми |
||
|
Частота за період 28 тижнів, |
0,74 |
0,92 |
|
% зниження, р-значення для співвідношення частоти |
19,4 %, p = 0,153 |
|
|
Тяжкі загострення астми |
||
|
Частота за період 28 тижнів, |
0,24 |
0,48 |
|
% зниження, р-значення для співвідношення частоти |
50,1 %, p = 0,002 |
|
|
Відвідування лікаря за невідкладними показаннями |
||
|
Частота за період 28 тижнів, |
0,24 |
0,43 |
|
% зниження, р-значення для співвідношення частоти |
43,9 %, p = 0,038 |
|
|
Загальна оцінка лікарем |
||
|
% пацієнтів, які реагували*, |
60,5 % |
42,8 % |
|
p-значення ** |
<0,001 |
|
|
Покращення AQL |
||
|
% пацієнтів ≥ 0,5 покращання, |
60,8 % |
47,8 % |
|
p-значення |
0,008 |
|
* Значне покращення або повний контроль.
** р-значення для загального розподілу оцінки.
У ході дослідження 2 оцінювали ефективність і безпеку застосування Ксолару в популяції 312 пацієнтів з тяжкою алергічною астмою, які збігалися за характеристиками з популяцією дослідження 1. Лікування Ксоларом у ході цього відкритого дослідження призвело до зменшення на 61 % частоти клінічно значущих загострень астми порівняно з поточною терапією астми окремо.
Чотири додаткові великі плацебо-контрольовані допоміжні дослідження Ксолару тривалістю від 28 до 52 тижнів були присвячені оцінці ефективності та безпеки застосування Ксолару у 1722 дорослих та дітей віком від 12 років (дослідження 3, 4, 5, 6) з тяжкою персистуючою астмою. У більшості пацієнтів був недостатній контроль астми, але вони отримували менше супутньої терапії астми, ніж пацієнти у дослідженнях 1 або 2. У ході досліджень 3–5 як первинну кінцеву точку використовували загострення, тоді як у ході дослідження 6 в першу чергу оцінювали зменшення потреби в інгаляційних кортикостероїдах.
Під час досліджень 3, 4 і 5 у пацієнтів, які застосовували Ксолар, скорочувалась частота загострень астми відповідно на 37,5 % (р = 0,027), 40,3 % (р < 0,001) і 57,6 % (р < 0,001) порівняно з плацебо.
У ході дослідження 6 значно більше пацієнтів з тяжкою алергічною астмою при застосуванні Ксолару змогли зменшити дозу флутиказону до ≤ 500 мкг/день без погіршення контролю за астмою (60,3 %) порівняно з групою плацебо (45,8 %, р < 0,05).
Якість життя, пов’язана з астмою, вимірювалася за допомогою анкети Джуніпер (Juniper). Для всіх шести досліджень відзначено достовірне покращання порівняно з початковою якістю життя у пацієнтів, які отримували Ксолар, порівняно з хворими з групи плацебо або контрольної групи.
Загальна оцінка лікарем ефективності лікування.
Загальна оцінка ефективності лікування проводилася лікарем в п’яти зазначених вище дослідженнях як контроль астми. Лікар мав можливість врахувати МШВ (максимальну швидкість видиху), симптоми в денний і нічний час, застосування препаратів першої допомоги, дані спірометрії і загострення астми. У всіх п’яти дослідженнях статистично значущо більша частка пацієнтів, які застосовували Ксолар, була визнана такою, що досягла значного покращання або повного контролю за астмою, порівняно з пацієнтами групи плацебо.
Діти віком від 6 до 12 років
Головне підтвердження безпеки і ефективності застосування Ксолару у віковій групі від 6 до 12 років отримане в одному рандомізованому подвійно сліпому плацебо-контрольованому багатоцентровому дослідженні (дослідження 7).
Дослідження 7 було плацебо-контрольованим дослідженням, яке включало особливу підгрупу (n = 235) пацієнтів, як це визначено у поточних показаннях, які лікувалися високими дозами інгаляційних кортикостероїдів (≥ 500 мкг/добу еквівалента флутиказону), а також бета-агоністів тривалої дії.
Клінічно значуще загострення визначалося як погіршення симптомів астми за клінічною оцінкою дослідника, що вимагало подвоєння початкової дози інгаляційних кортикостероїдів протягом принаймні 3 днів і/або лікування за життєвими показаннями системними кортикостероїдами (перорально або внутрішньовенно) протягом принаймні 3 днів.
В особливій підгрупі пацієнтів, які отримували високі дози інгаляційних кортикостероїдів, група застосування омалізумабу мала статистично достовірно нижчу частоту клінічно значущих загострень астми, ніж група плацебо. На 24 тижні різниця в частоті між групами лікування становила 34 % (співвідношення частоти 0,662, р = 0,047) зменшення порівняно з плацебо у пацієнтів, які отримували омалізумаб. У другому подвійно сліпому 28-тижневому періоді лікування різниця в частоті між групами лікування становила 63 % (співвідношення частоти 0,37, р < 0,001) зниження порівняно з плацебо у пацієнтів, які отримували омалізумаб.
Під час 52-тижневого подвійно сліпого періоду лікування (що включало 24-тижневу фазу застосування фіксованої дози стероїдів і 28-тижневу фазу корекції дози стероїдів) різниця у частоті між групами лікування становила 50 % (співвідношення частоти 0,504, р < 0,001) відносного зменшення частоти загострень у пацієнтів, які отримували омалізумаб.
Для групи пацієнтів, які отримували омалізумаб, показане більше зниження частоти застосування бета-агоністів за невідкладними показаннями, ніж для групи плацебо, наприкінці 52-тижневого періоду лікування, хоча різниця між групами не була статистично значущою. За загальною оцінкою ефективності лікування наприкінці 52-тижневого подвійно сліпого періоду лікування в підгрупі тяжких хворих, які застосовували високі дози інгаляційних кортикостероїдів плюс бета-агоністи тривалої дії, частка пацієнтів з «відмінною» оцінкою ефективності лікування була вища, а співвідношення пацієнтів із «задовільною» або «поганою» оцінкою ефективності лікування були нижчі в групі омалізумабу порівняно з групою плацебо, різниця між групами була статистично значущою (р < 0,001), водночас не було жодних відмінностей між групами застосування омалізумабу і плацебо щодо суб’єктивних оцінок якості життя.
Клінічний досвід застосування при хронічному риносинуситі з назальними поліпами (ХРСзНП)
Безпеку та ефективність застосування Ксолару оцінювали у двох рандомізованих подвійно сліпих плацебо-контрольованих дослідженнях за участю пацієнтів із ХРСзНП (таблиця 2). Пацієнти отримували Ксолар або плацебо підшкірно кожні 2 або 4 тижні (див. розділ «Спосіб застосування та дози»). Усі пацієнти отримували фонову інтраназальну терапію мометазоном протягом усього дослідження. Для включення у дослідження попередня синоназальна операція або попереднє системне застосування кортикостероїдів не вимагалось. Пацієнти отримували Ксолар або плацебо протягом 24 тижнів з наступним 4-тижневим періодом спостереження. Демографічні показники та вихідні характеристики, включаючи алергічні супутні захворювання, описані в таблиці 2.
Первинними кінцевими точками були двосторонні показники назальних поліпів (ПНП) та середній щоденний показник закладеності носа (ПЗН) на 24-му тижні. В обох дослідженнях назальних поліпів (дослідження 1 та 2) пацієнти, які отримували Ксолар, мали статистично значимо більші покращення порівняно з вихідним рівнем на 24-му тижні щодо ПНП та середнього тижневого ПЗН, ніж пацієнти, які отримували плацебо. Результати досліджень 1 та 2 щодо назальних поліпів наведені в таблиці 3.
Таблиця 2
Демографічні показники та вихідні характеристики у дослідженнях щодо назальних поліпів
|
Параметр |
Дослідження 1 щодо назальних поліпів N = 138 |
Дослідження 2 щодо назальних поліпів N = 127 |
|
Середній вік (роки) (СВ) |
51,0 (13,2) |
50,1 (11,9) |
|
% чоловіків |
63,8 |
65,4 |
|
Пацієнти, які приймали системні кортикостероїди у попередній рік (%) |
18,8 |
26,0 |
|
Двосторонній показник назальних поліпів (ПНП): середнє значення (СВ), шкала 0–8 |
6,2 (1,0) |
6,3 (0,9) |
|
Показник закладеності носа (ПЗН): середнє значення (СВ), шкала 0–3 |
2,4 (0,6) |
2,3 (0,7) |
|
Рівень відчуття запаху: середнє значення (СВ), шкала 0–3 |
2,7 (0,7) |
2,7 (0,7) |
|
ОСНП-22 сумарний бал: середнє значення (СВ), шкала 0–110 |
60,1 (17,7) |
59,5 (19,3) |
|
Еозинофіли крові (клітин/мкл): середнє значення (СВ) |
346,1 (284,1) |
334,6 (187,6) |
|
Загальний IgE, МО/мл: середнє значення (СВ) |
160,9 (139,6) |
190,2 (200,5) |
|
Астма (%) |
53,6 |
60,6 |
|
Легка (%) |
37,8 |
32,5 |
|
Помірна (%) |
58,1 |
58,4 |
|
Тяжка (%) |
4,1 |
9,1 |
|
Аспірин-індукована астма (%) |
19,6 |
35,4 |
|
Алергічний риніт |
43,5 |
42,5 |
СВ – стандартне відхилення;
ОСНП-22 – опитування з 22 питань щодо синоназальних проявів;
IgE – імуноглобулін E;
МО – міжнародні одиниці.
Вищий показник ПНП, ПЗН та ОСНП-22 вказує на більш тяжкий перебіг захворювання.
Таблиця 3
Зміна відносно вихідного рівня на 24-му тижні у клінічному оцінюванні під час досліджень 1 та 2 щодо назальних поліпів та об’єднані дані
|
Параметр |
Назальні поліпи, дослідження 1 |
Назальні поліпи, дослідження 2 |
Назальні поліпи, об’єднані данні |
|||
|
Плацебо |
Ксолар |
Плацебо |
Ксолар |
Плацебо |
Ксолар |
|
|
N |
66 |
72 |
65 |
62 |
131 |
134 |
|
Показник поліпів носа |
||||||
|
Середнє вихідне значення |
6,32 |
6,19 |
6,09 |
6,44 |
6,21 |
6,31 |
|
МНК-середнє значення на 24 тижні |
0,06 |
-1,08 |
-0,31 |
-0,90 |
-0,13 |
-0,99 |
|
Різниця (95 %) ДІ |
-1,14 (-1,59, -0,69) |
-0,59 (-1,05, -0,12) |
-0,86 (-1,18, -0,54) |
|||
|
p-значення |
< 0,0001 |
0,0140 |
< 0,0001 |
|||
|
Середнє значення (за 7 днів) щоденного ПЗН |
||||||
|
Середнє вихідне значення |
2,46 |
2,40 |
2,29 |
2,26 |
2,38 |
2,34 |
|
МНК-середнє значення на 24-му тижні |
-0,35 |
-0,89 |
-0,20 |
-0,70 |
-0,28 |
-0,80 |
|
Різниця (95 %) ДІ |
-0,55 (-0,84, -0,25) |
-0,50 (-0,80, -0,19) |
-0,52 (-0,73, -0,31) |
|||
|
p-значення |
0,0004 |
0,0017 |
< 0,0001 |
|||
|
ЗПНС |
||||||
|
Середнє вихідне значення |
9,33 |
8,56 |
8,73 |
8,37 |
9,03 |
8,47 |
|
МНК-середнє значення на 24-му тижні |
-1,06 |
-2,97 |
-0,44 |
-2,53 |
-0,77 |
-2,75 |
|
Різниця (95 %) |
-1,91 (-2,85, -0,96) |
-2,09 (-3,00, -1,18) |
-1,98 (-263, -1,33) |
|||
|
p-значення |
0,0001 |
< 0,0001 |
< 0,0001 |
|||
|
ОСНП-22 |
||||||
|
Середнє вихідне значення |
60,26 |
59,82 |
59,80 |
59,21 |
60,03 |
59,54 |
|
МНК-середнє значення на 24 тижні |
-8,58 |
-24,70 |
-6,55 |
-21,59 |
-7,73 |
-23,10 |
|
Різниця (95 %) |
-16,12 (-21,86, -10,38) |
-15,04 (-21,26, -8,82) |
-15,36 (-19,57, -11,16) |
|||
|
p-значення |
< 0,0001 |
< 0,0001 |
< 0,0001 |
|||
|
(МЗР = 8,9) |
||||||
|
ТВЗУП |
||||||
|
Середнє вихідне значення |
13,56 |
12,78 |
13,27 |
12,87 |
13,41 |
12,82 |
|
МНК-середнє значення на 24-му тижні |
0,63 |
4,44 |
0,44 |
4,31 |
0,54 |
4,38 |
|
Різниця (95 %) |
3,81 (1,38, 6,24) |
3,86 (1,57, 6,15) |
3,84 (2,17, 5,51) |
|||
|
p-значення |
0,0024 |
0,0011 |
< 0,0001 |
|||
МНК – метод найменших квадратів; ДІ – довірчий інтервал; ПЗН – показник закладеності носа; ЗПНС – загальний показник назальних симптомів; ОСНП-22 – опитування з 22 питань щодо синоназальних проявів; ТВЗУП – тест визначення запаху Університету Пенсильванії; МЗР – мінімально значуща різниця.
|
Вихідне значення |
|
Вихідне значення |
|
Первинний аналіз ефективності |
|
Вторинний аналіз ефективності |
|
Тиждень |
|
Тиждень |
|
Досл. 2 / Плацебо (N=65) Досл. 2 / Омалізумаб (N=62) |
|
Досл. 1 / Плацебо (N=66) Досл. 1 / Омалізумаб (N=72) |
|
Досл. 2 / Плацебо (N=65) Досл. 2 / Омалізумаб (N=62) |
|
Досл. 1 / Плацебо (N=66) Досл. 1 / Омалізумаб (N=72) |
|
Вторинний аналіз ефективності |
|
Первинний аналіз ефективності |
|
-1.25 |
|
-1.25 |
|
-1.00 |
|
-1.00 |
|
-0.75 |
|
-0.75 |
|
-0.50 |
|
-0.50 |
|
-0.25 |
|
-0.25 |
|
0.00 |
|
0.00 |
|
0.25 |
|
0.25 |
|
24 |
|
20 |
|
16 |
|
12 |
|
8 |
|
4 |
|
4 |
|
8 |
|
12 |
|
16 |
|
20 |
|
24 |
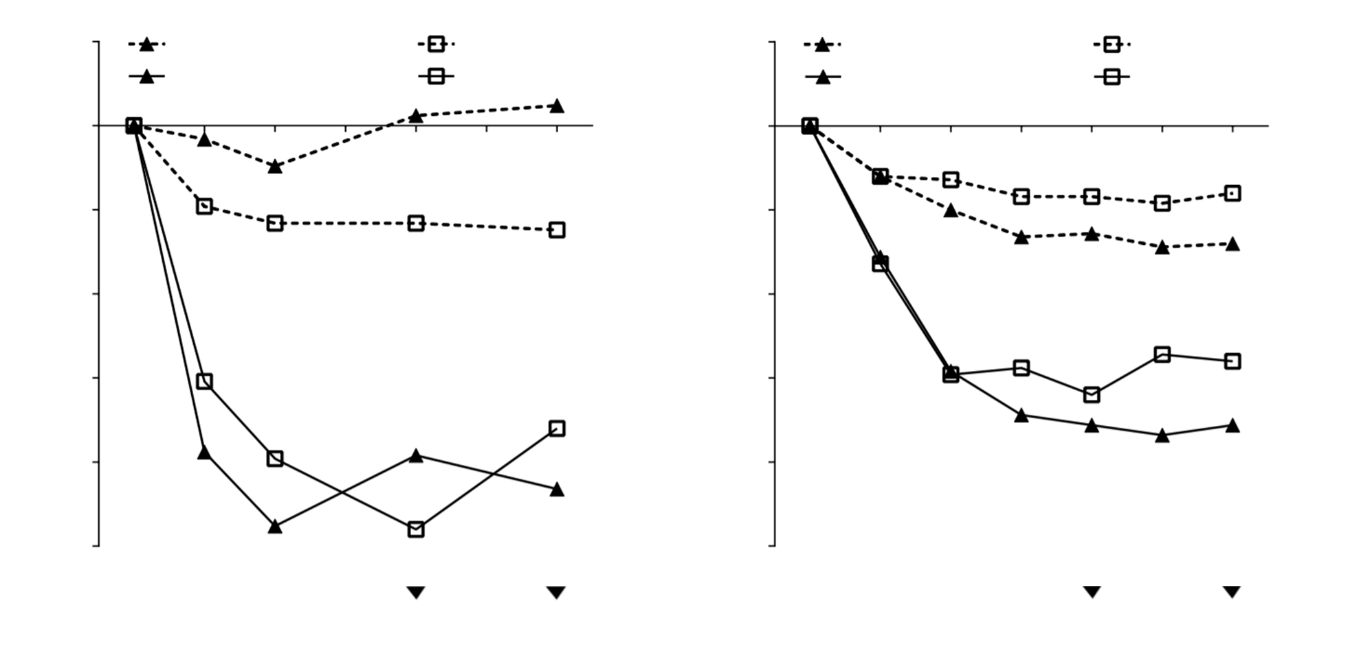
Рис. 1. Середня зміна відносно вихідних значень показника закладеності носа (ПЗН) та середня зміна відносно вихідних значень показника назальних поліпів (ПНП) у дослідженнях 1 та 2 щодо назальних поліпів.
У заздалегідь визначеному об’єднаному аналізі невідкладного лікування (системні кортикостероїди протягом 3 та більше днів поспіль або назальна поліпектомія) протягом 24-тижневого періоду лікування частка пацієнтів, які потребували невідкладного лікування, була нижчою у групі застосування Ксолару порівняно з плацебо (2,3 % проти 6,2 % відповідно). Співвідношення шансів потребувати невідкладного лікування для тих, хто отримував Ксолар, порівняно з плацебо становило 0,38 (95 % ДІ: 0,10, 1,49). У жодному дослідженні не повідомлялося про синоназальні операції.
Клінічний досвід застосування при хронічній спонтанній кропив’янці
Ефективність та безпека застосування Ксолару були продемонстровані під час двох рандомізованих, плацебо-контрольованих досліджень III фази (дослідження 1 та 2) у пацієнтів з ХСК, які продовжували відмічати ознаки захворювання, незважаючи на застосування H1-антигістамінних препаратів у затвердженій дозі. У третьому дослідженні (дослідження 3) початково оцінювалась безпека застосування Ксолару у пацієнтів з ХСК, які продовжували відмічати ознаки захворювання, незважаючи на лікування H1-антигістамінними препаратами в дозі, що приблизно у 4 рази перевищувала затверджену дозу, а також H2-антигістамінними препаратами та/або антагоністами рецепторів лейкотрієнів. У трьох дослідженнях брали участь 975 пацієнтів віком від 12 до 75 років (середній вік 42,3 року; 39 пацієнтів віком 12–17 років, 54 пацієнти віком ≥ 65 років; 259 чоловіків та 716 жінок). Всі пацієнти мали неналежно контрольовані симптоми, що оцінювались за 16-бальною шкалою для щотижневої оцінки тяжкості перебігу кропив’янки (UAS7, діапазон 0–42), а також за 8-бальною шкалою для щотижневої оцінки тяжкості перебігу свербежу (яка є частиною UAS7; діапазон 0–21) за 7 днів до рандомізації, незважаючи на прийом антигістамінних препаратів щонайменше за 2 тижні до цього.
Під час досліджень 1 та 2 середній бал за шкалою для щотижневої оцінки тяжкості перебігу свербежу у пацієнтів становив 13,7–14,5 на початку дослідження, а середній бал за шкалою UAS7 становив 29,5 та 31,7 відповідно. Під час дослідження 3 щодо безпеки середній бал за шкалою для щотижневої оцінки тяжкості перебігу свербежу у пацієнтів становив 13,8, а середній бал за шкалою UAS7 становив 31,2 на початку дослідження. В рамках всіх трьох досліджень пацієнти отримували в середньому 4–6 лікарських засобів (включаючи H1-антигістамінні препарати) для лікування симптомів ХСК до включення у дослідження. Пацієнти отримували лікарський засіб Ксолар в дозі 75 мг, 150 мг або 300 мг чи плацебо шляхом підшкірної ін’єкції кожні 4 тижні протягом 24 та 12 тижнів у дослідженнях 1 та 2 відповідно і лікарський засіб Ксолар в дозі 300 мг або плацебо шляхом підшкірної ін’єкції кожні 4 тижні протягом 24 тижнів у дослідженні 3. У всіх дослідженнях період без лікування становив 16 тижнів.
Первинною кінцевою точкою була зміна відносно вихідного рівня до 12-го тижня за шкалою для щотижневої оцінки тяжкості перебігу свербежу. Омалізумаб в дозі 300 мг зменшував показник за шкалою для щотижневої оцінки тяжкості перебігу свербежу на 8,55–9,77 (p < 0,0001) порівняно зі зменшенням на 3,63–5,14 в групі плацебо (див. таблицю 4). Швидкість відповіді за шкалою UAS7 ≤ 6 (на 12-му тижні) була статистично значуще вищою в групах застосування лікарського засобу Ксолар в дозі 300 мг (52–66 %) (p < 0,0001) порівняно з 11–19 % в групі плацебо, а повна ремісія (UAS7 = 0) досягалась у 34–44 % (p < 0,0001) пацієнтів, які застосовували дозу 300 мг, порівняно з 5–9 % пацієнтів в групах плацебо. Пацієнти, яких лікували дозою 300 мг, досягли найвищого середнього відсотка днів без появи епізодів ангіоневротичного набряку з 4-го по 12-й тиждень (91,0–96,1 %; p < 0,001) порівняно з пацієнтами групи плацебо (88,1–89,2 %). Середня зміна відносно вихідного рівня до 12-го тижня у загальному DLQI (дерматологічний індекс якості життя) в групах застосування лікарського засобу Ксолар в дозі 300 мг була вищою (p < 0,001), ніж в групах плацебо, що свідчить про покращення від 9,7 до 10,3 бала порівняно з 5,1–6,1 бала у відповідних групах плацебо.
Таблиця 4
Зміна відносно вихідного рівня до 12-го тижня за шкалою для щотижневої оцінки тяжкості перебігу свербежу, дослідження 1, 2 та 3 (популяція mITT*)
|
Показники |
Плацебо |
Омалізумаб 300 мг |
|
Дослідження 1 |
||
|
N |
80 |
81 |
|
Середній бал (СВ) |
−3,63 (5,22) |
−9,40 (5,73) |
|
Різниця в середніх значеннях за методом найменших квадратів порівняно з плацебо 1 |
- |
−5,80 |
|
95 % ДІ для різниці |
- |
−7,49−4,10 |
|
P-значення порівняно з плацебо 2 |
- |
< 0,0001 |
|
Дослідження 2 |
||
|
N |
79 |
79 |
|
Середній бал (СВ) |
−5,14 (5,58) |
−9,77 (5,95) |
|
Різниця в середніх значеннях за методом найменших квадратів порівняно з плацебо1 |
- |
−4,81 |
|
95 % ДІ для різниці |
- |
−6,49−3,13 |
|
P-значення порівняно з плацебо2 |
- |
< 0,0001 |
|
Дослідження 3 |
||
|
N |
83 |
252 |
|
Середній бал (СВ) |
−4,01 (5,87) |
−8,55 (6,01) |
|
Різниця в середніх значеннях за методом найменших квадратів порівняно з плацебо 1 |
- |
–4,52 |
|
95 % ДІ для різниці |
- |
−5,97 −3,08 |
|
P-значення порівняно з плацебо 2 |
- |
< 0,0001 |
*Модифікована популяція (mITT) за призначеним лікуванням: включено всіх пацієнтів, які були рандомізовані та отримували щонайменше одну дозу досліджуваного препарату.
BOCF (перенесення вихідного зафіксованого значення вперед) використовувалось для заповнення у разі відсутності даних.
1 Середній бал за методом найменших квадратів розраховувався за допомогою моделі ANCOVA. Змінною був вихідний рівень за шкалою для щотижневої оцінки тяжкості перебігу свербежу (< 13 порівняно з ≥ 13) та початкова маса тіла (< 80 кг порівняно з ≥ 80 кг).
2 Р-значення отримано за результатами ANCOVA t-тесту.
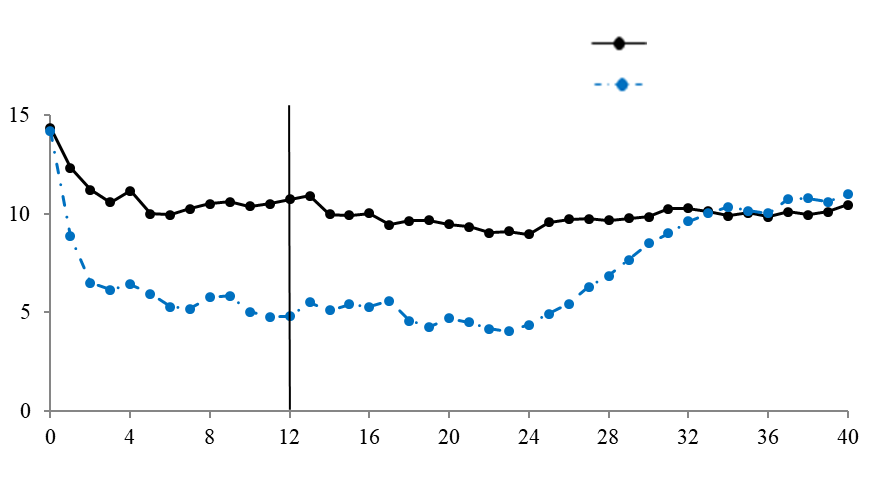
На рис. 2 зображено середній бал за шкалою для щотижневої оцінки тяжкості перебігу свербежу протягом тривалого часу в дослідженні 1. Середній бал за шкалою для щотижневої оцінки тяжкості перебігу свербежу значно знизився при досягненні максимального ефекту на 12-й тиждень протягом 24‑тижневого періоду лікування. У ході дослідження 3 було отримано однакові результати.
У всіх трьох дослідженнях середній бал за шкалою для щотижневої оцінки тяжкості перебігу свербежу поступово збільшувався протягом 16‑тижневого періоду без лікування відповідно до появи симптомів. Середні значення наприкінці періоду спостереження були аналогічні тим, які відмічались у групі плацебо, але нижчі, ніж відповідні середні значення на початку дослідження.
|
|
|
|
|
|
|
|
|
|
|
|
|
Тиждень 12 Первинна кінцева точка |
|
Омалізумаб в дозі 300 мг |
|
Плацебо |
|
Тиждень |
|
Застосований омалізумаб або плацебо |
 |
BOCF – перенесення вихідного зафіксованого значення вперед; mITT – модифікована популяція за призначеним лікуванням.
Рис. 2. Середній бал за шкалою для щотижневої оцінки тяжкості перебігу свербежу протягом тривалого часу, дослідження 1 (популяція mITT).
Ефективність через 24 тижні лікування
Результати ефективності, що спостерігалась на 24-му тижні лікування, порівнювали з показниками, що спостерігалась на 12-му тижні лікування.
При прийомі дози 300 мг у дослідженнях 1 та 3 середній рівень зниження на початку дослідження за шкалою для щотижневої оцінки тяжкості перебігу свербежу становив 9,8 та 8,6, відсоток пацієнтів за UAS7 ≤ 6 становив 61,7 % та 55,6 %, а відсоток пацієнтів з повною відповіддю (UAS7 = 0) становив 48,1 % та 42,5 % відповідно (всі p < 0,0001 порівняно з плацебо).
Клінічний досвід повторного застосування омалізумабу обмежений.
Дані клінічних випробувань за участю підлітків (віком від 12 до 17 років) включали дані про 39 пацієнтів, 11 з яких отримали дозу 300 мг. Результати щодо введення дози 300 мг отримані у 9 пацієнтів на 12-му тижні та у 6 пацієнтів на 24-му тижні та свідчать про однакову терапевтичну відповідь на лікування омалізумабом, як і у дорослих пацієнтів. Середня зміна на початку дослідження за шкалою для щотижневої оцінки тяжкості перебігу свербежу свідчила про зниження на рівні 8,25 на 12-ому тижні та на рівні 8,95 на 24-ому тижні. Швидкість відповіді – 33 % на 12-му тижні та 67 % на 24-му тижні для UAS7 = 0 і 56 % на 12-му тижні та 67 % на 24-му тижні для UAS7 ≤ 6.
Фармакокінетика.
Дія омалізумабу вивчалася у дорослих пацієнтів і дітей віком від 12 років з алергічною астмою, у дорослих пацієнтів з ХРСзНП, а також у дорослих та підлітків з ХСК. Загальні фармакокінетичні параметри омалізумабу для цих пацієнтів однакові.
Абсорбція
Після підшкірного введення омалізумаб абсорбується з середньою абсолютною біодоступністю 62 %. Після підшкірного введення разової дози дорослим і дітям віком від 12 років з астмою або ХСК омалізумаб повільно абсорбувався, досягаючи максимальної концентрації у сироватці крові в середньому через 7–8 днів. У пацієнтів з астмою після багаторазового введення омалізумабу площа під кривою «сироваткова концентрація – час» з 0-го по 14-й день у рівноважному стані була у 6 разів вищою, ніж після введення першої дози.
Фармакокінетика омалізумабу є лінійною при дозах, що перевищують 0,5 мг/кг. Після багаторазового введення омалізумабу площа під кривою «сироваткова концентрація – час» з 0-го по 14-й день у рівноважному стані була до 6 разів вищою, ніж після введення першої дози.
Застосування Ксолару у формі ліофілізату або розчину зумовило аналогічні профілі показника «сироваткова концентрація – час» омалізумабу.
Розподіл
In vitro омалізумаб утворює комплекси з IgE, що мають обмежений розмір. Комплекси, що преципітують, і комплекси з молекулярною масою більше одного мільйона дальтонів не виявлені ні in vitro, ні in vivo. З урахуванням фармакокінетики в популяції розподіл омалізумабу був однаковим у пацієнтів з алергічною астмою та пацієнтів з ХСК. Очікуваний об’єм розподілу після підшкірного введення становив 78 ± 32 мл/кг.
Виведення
У кліренсі омалізумабу задіяні процеси кліренсу IgG так само, як і виведення шляхом специфічного зв’язування і утворення комплексів з його цільовим лігандом – IgE. Печінкова елімінація IgG включає розщеплювання в ретикулоендотеліальній системі і в клітинах ендотелію. Незмінений IgG також екскретується з жовчю. У пацієнтів з астмою період напіввиведення омалізумабу із сироватки крові в середньому становив 26 днів при кліренсі в середньому 2,4 ± 1,1 мл/кг/день. Крім того, при масі тіла, більшій у 2 рази, кліренс збільшувався приблизно удвічі. У пацієнтів з ХСК, з урахуванням фармакокінетичних моделей, період напіввиведення омалізумабу із сироватки крові у рівноважному стані становив у середньому 24 дні, а явний кліренс у рівноважному стані у пацієнтів з масою тіла 80 кг становив 3,0 мл/кг/добу.
Характеристики в популяціях пацієнтів
Вік, расова/етнічна приналежність, стать, індекс маси тіла
Пацієнти з астмою та ХРСзНП
Фармакокінетика Ксолару в популяції аналізувалася з метою оцінки впливу демографічних характеристик. Аналіз цих обмежених даних свідчить, що корекція дози залежно від віку (6–76 років для пацієнтів з алергічною астмою; 18–75 років для пацієнтів з ХРСзНП), расової/етнічної приналежності, статі або індексу маси тіла не потрібна.
Пацієнти з ХСК
Вплив демографічних характеристик та інших факторів на експозицію Ксолару оцінювали за фармакокінетикою в популяції. Крім цього, вплив незалежної змінної був оцінений шляхом аналізу співвідношення концентрації омалізумабу та клінічної відповіді. Цей аналіз свідчить про те, що для пацієнтів з ХСК незалежно від віку (12–75 років), расової/етнічної приналежності, статі, маси тіла, індексу маси тіла, вихідного рівня IgE, анти-FceRI аутоантитіл, одночасного застосування H2-антигістамінних препаратів або антагоністів рецепторів лейкотрієнів корекція дози не потрібна.
Порушення функції нирок і печінки
Дані щодо фармакокінетики або фармакодинаміки у пацієнтів з нирковою або печінковою недостатністю відсутні.
Клінічні характеристики.
Показання.
Алергічна астма
Можливість лікування Ксоларом слід розглядати тільки для пацієнтів зі встановленою IgE (імуноглобулін Е)-опосередкованою астмою.
Дорослі та діти віком від 12 років
Ксолар показаний як додаткова терапія для досягнення кращого контролю за астмою у пацієнтів із тяжкою персистуючою алергічною астмою, у яких результат шкірного тесту або тесту in vitro на реактивність до постійно присутнього в повітрі алергену позитивний, у яких ослаблена функція легень (ОФВ1 (об’єм форсованого видиху) < 80 %), а також часті прояви симптомів вдень або часте пробудження в нічний час і які мають документальне підтвердження багаторазових тяжких загострень астми, незважаючи на застосування високих добових доз інгаляційних кортикостероїдів з додаванням інгаляційних бета2-агоністів тривалої дії.
Діти віком від 6 до 12 років
Ксолар показаний як додаткова терапія для досягнення кращого контролю за астмою у пацієнтів із тяжкою персистуючою алергічною астмою, у яких позитивний шкірний тест або тест in vitro на реактивність до постійно присутнього в повітрі алергену, а також часті прояви симптомів вдень або пробудження в нічний час і які мають документальні підтвердження багаторазових тяжких загострень астми, незважаючи на застосування високих добових доз інгаляційних кортикостероїдів з додаванням інгаляційних бета2-агоністів тривалої дії.
Хронічний риносинусит з назальними поліпами (ХРСзНП)
Ксолар показаний як додаткова терапія разом з інтраназальними кортикостероїдами (ІНК) для лікування дорослих (віком від 18 років) із тяжкою формою ХРСзНП, для яких терапія ІНК не забезпечує належного контролю захворювання.
Хронічна спонтанна кропив’янка (ХСК), дозування 150 мг
Лікарський засіб Ксолар показаний як додаткова терапія при хронічній спонтанній кропив’янці у дорослих та підлітків (віком від 12 років) із неадекватною відповіддю на лікування Н1-антигістамінними препаратами.
Протипоказання.
Підвищена чутливість до діючої речовини або до будь-якого іншого компонента лікарського засобу.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Оскільки IgE може залучатися до імунної відповіді, спричиненої деякими гельмінтними інвазіями, лікарський засіб Ксолар може непрямо знижувати ефективність лікарських засобів для лікування гельмінтних або інших паразитарних інфекцій.
Ферменти цитохрому Р450, рефлюксний насос і механізм зв’язування з білками в кліренсі омалізумабу не задіяні; таким чином, можливість взаємодії з іншими препаратами незначна. Досліджень взаємодії Ксолару з лікарськими засобами або вакцинами не проводилося. Відсутні фармакологічно обґрунтовані причини припускати, що лікарські засоби, які зазвичай застосовують для лікування астми, взаємодіятимуть з омалізумабом.
Алергічна астма
Під час клінічних досліджень Ксолар зазвичай застосовували у поєднанні з інгаляційними та пероральними кортикостероїдами, інгаляційними бета-агоністами короткочасної і тривалої дії, модифікаторами лейкотрієнів, теофіліном і пероральними антигістамінними препаратами. Не виявлено ознак зміни безпеки застосування Ксолару під впливом цих широковикористовуваних лікарських засобів для лікування астми. Доступні обмежені дані стосовго застосування Ксолару у поєднанні зі специфічною імунотерапією (гіпосенсибілізуюча терапія). У ході клінічних досліджень, у яких Ксолар застосовували сумісно з імунотерапією, безпека та ефективність Ксолару в поєднанні зі специфічною імунотерапією не відрізнялися від таких при застосуванні Ксолару як монотерапії.
Хронічна спонтанна кропив’янка
Під час клінічних досліджень пацієнтам з ХСК Ксолар застосовували одночасно з антигістамінними препаратами (анти-H1, анти-H2) та антагоністами рецепторів лейкотрієнів. Немає жодних даних, які підтверджують, що безпека омалізумабу змінювалась при застосуванні з цими лікарськими засобами відносно відомого профілю безпеки при алергічній астмі. Крім цього, популяційний фармакокінетичний аналіз не свідчив про відповідний вплив H2-антигістамінних лікарських засобів та антагоністів рецепторів лейкотрієнів на фармакокінетику омалізумабу.
Хронічний риносинусит з назальними поліпами
У клінічних дослідженнях Ксолар застосовували згідно з протоколом разом із мометазоном, інтраназальним спреєм. Інші часто застосовувані супутні лікарські засоби включали інші інтраназальні кортикостероїди, бронходилататори, антигістамінні препарати, антагоністи лейкотрієнових рецепторів, адренергічні засоби/ симпатоміметики та місцеві назальні анестетики. При цьому не було ознак того, що одночасний прийом інших часто застосовуваних лікарських засобів змінював безпеку застосування Ксолару.
Діти
У клінічні дослідження з ХСК були включені деякі пацієнти віком від 12 до 17 років, які приймали лікарський засіб Ксолар одночасно з антигістамінними препаратами (анти-H1, анти-H2) та антагоністами рецепторів лейкотрієнів. Дослідження за участю дітей віком до 12 років не проводились.
Особливості застосування.
Відстежування
Для поліпшення відстежування біологічних лікарських засобів слід чітко реєструвати назву та номер партії введеного препарату.
Загальні
Ксолар не показаний для лікування гострих нападів астми, гострого бронхоспазму або астматичного статусу.
Не проводилося досліджень застосування лікарського засобу Ксолар пацієнтам із синдромом підвищеного вмісту IgE або алергічним бронхолегеневим аспергільозом, а також з метою попередження анафілактичних реакцій, включаючи провоковані харчовою алергією, атопічним дерматитом або алергічним ринітом. Ксолар не показаний для лікування таких станів.
Не проводилося досліджень застосування лікарського засобу Ксолар пацієнтам із аутоімунними захворюваннями, станами, що опосередковані імунними комплексами, або вже наявним порушенням функції нирок чи печінки. Слід з обережністю призначати Ксолар таким пацієнтам.
Не рекомендується різке припинення прийому системних або інгаляційних кортикостероїдів після початку терапії Ксоларом при лікуванні алергічної астми чи ХРСзНП. Зниження дози кортикостероїдів слід проводити під безпосереднім спостереженням лікаря і, при необхідності, поступово.
Порушення з боку імунної системи
- Алергічні реакції І типу
Під час прийому омалізумабу можуть спостерігатися місцеві або системні алергічні реакції І типу, включаючи анафілаксію і анафілактичний шок; їх поява можлива навіть після тривалого лікування. Однак більшість цих реакцій розвиваються протягом 2 годин після першої або наступних ін’єкцій препарату Ксолар, але інколи побічні реакції виникають і через більше ніж 2 години, в деяких випадках навіть пізніше ніж через 24 години після ін’єкції. Більшість анафілактичних реакцій розвиваються під час застосування перших трьох доз Ксолару. Не пов’язані із застосуванням омалізумабу реакції гіперчутливості в анамнезі є фактором ризику розвитку анафілактичних реакцій при застосуванні Ксолару. Тому після введення Ксолару препарати для лікування анафілактичних реакцій повинні завжди бути доступні для негайного застосування. У разі розвитку анафілаксії або іншої серйозної алергічної реакції необхідно негайно припинити прийом Ксолару та розпочати відповідну терапію. Пацієнтів слід інформувати, що такі реакції можливі, і у разі розвитку алергічної реакції необхідно негайно звернутися за медичною допомогою.
Антитіла до омалізумабу були виявлені у невеликої кількості пацієнтів під час клінічних досліджень. Клінічна значущість антитіл до Ксолару не дуже добре визначена.
- Сироваткова хвороба
Сироваткова хвороба і реакції, подібні до сироваткової хвороби (уповільнені алергічні реакції ІІІ типу), зрідка спостерігаються у пацієнтів, які отримують гуманізовані моноклональні антитіла, включаючи омалізумаб. Ймовірний патофізіологічний механізм включає формування і депонування імунних комплексів у зв’язку з виробленням антитіл до омалізумабу. Типовим моментом початку є 1–5 день після введення першої або наступних ін’єкцій, а також після тривалого лікування. Симптоми, що вказують на сироваткову хворобу, включають артрит/артралгії, висипання (кропив’янка або інші форми), гарячку і лімфаденопатію. Для попередження або лікування цих розладів можуть бути показані антигістамінні препарати і кортикостероїди, а пацієнти повинні повідомляти лікарю про будь-які підозрілі симптоми.
- Синдром Чарга – Стросс і синдром гіпереозинофілії
У пацієнтів з тяжкою астмою в окремих випадках можуть спостерігатися синдром системної гіпереозинофілії або алергічний гранулематозний васкуліт (синдром Чарга –Стросс), обидва стани зазвичай лікують із застосуванням системних кортикостероїдів.
В окремих випадках у пацієнтів, які отримують лікування протиастматичними засобами, включаючи омалізумаб, можуть виявлятися або розвиватися системна еозинофілія і васкуліт. Ці явища зазвичай пов’язані зі зниженням дози пероральних кортикостероїдних препаратів, що застосовуються.
При лікуванні таких пацієнтів слід пам’ятати про розвиток вираженої еозинофілії, васкулітного висипу, погіршання легеневих симптомів, патології параназальних синусів, серцевих ускладнень і/або нейропатії.
У всіх тяжких випадках вищезгаданих імунних порушень слід розглянути питання про припинення прийому омалізумабу.
Паразитарні (гельмінтні) інвазії
IgE може залучатися до імунної відповіді, спричиненої деякими гельмінтними інвазіями. Плацебо-контрольоване дослідження за участю пацієнтів з постійним високим ризиком гельмінтних інвазій показало незначне зростання частоти інвазій на тлі прийому омалізумабу, хоча перебіг, тяжкість і відповідь на лікування залишалися незміненими. Рівень захворюваності гельмінтними інвазіями під час загальної клінічної програми, що не розроблялася спеціально для виявлення таких інвазій, був меншим ніж 1 випадок на 1000 пацієнтів. Однак пацієнтам із високим ризиком гельмінтної інфекції необхідно бути обережними, особливо при подорожах до місцевостей, в яких гельмінтні інфекції є ендемічними. Якщо пацієнт не відповідає на призначене антигельмінтне лікування, слід розглянути питання про відміну Ксолару.
Особи, чутливі до латексу
Кришка на голку попередньо заповненого шприца містить похідне натурального каучукового латексу. На сьогодні у кришці на голку не виявлено латексу з натурального каучуку. Однак застосування Ксолару, розчину для ін’єкцій у попередньо наповненому шприці, особам, чутливим до латексу, не вивчалось, і тому існує потенційний ризик реакцій гіперчутливості, який не можна повністю виключити.
Застосування у період вагітності або годування груддю.
Помірний обсяг даних про вагітних жінок (від 300 до 1 000 результатів вагітності), отриманих з реєстру вагітності та спонтанних повідомлень про постмаркетинговий період, вказує на відсутність мальформативної та фето/неонатальної токсичності. Перспективне дослідження реєстру вагітності (EXPECT) 250 вагітних жінок з астмою, які приймали Ксолар, показало, що поширеність основних вроджених аномалій була подібною (8,1 % проти 8,9 %) у пацієнтів з EXPECT та пацієнтів з відповідними захворюваннями (середня та тяжка астма). На інтерпретацію даних можуть вплинути методологічні обмеження дослідження, включаючи малий обсяг вибірки та нерандомізований дизайн.
Омалізумаб проникає через плацентарний бар’єр, однак дослідження на тваринах не виявили як прямої, так і непрямої шкідливої дії на репродуктивну функцію. Омалізумаб був пов’язаний з віковим зниженням кількості тромбоцитів у нижчих приматів з більшою відносною чутливістю у незрілих тварин. У разі клінічної необхідності лікування Ксоларом під час вагітності може бути розглянуто.
Імуноглобуліни G (Gs) присутні у грудному молоці людини, тому очікується, що омалізумаб може бути присутнім у грудному молоці людини. Омалізумаб виділяється з грудним молоком нижчих приматів.
Дослідження EXPECT за участю 154 немовлят, що піддавались впливу препарату Ксолар впродовж внутрішньоутробного періоду та під час годування груддю, встановило відсутність побічних реакцій у немовлят, яких годували груддю. На інтерпретацію даних можуть вплинути методологічні обмеження дослідження, включаючи малий обсяг вибірки та нерандомізований дизайн.
При прийомі перорально білки імуноглобуліну G піддаються кишковому протеолізу і мають низьку біодоступність. Не очікується впливу на новонароджених/немовлят, яких годують груддю. Отже, якщо це клінічно необхідно, лікування Ксоларом під час годування груддю може бути розглянуто.
Відсутні дані про вплив омалізумабу на фертильність людини. У спеціально розроблених доклінічних дослідженнях фертильності, в тому числі дослідженнях спаровування, погіршення чоловічої чи жіночої фертильності не спостерігалося після повторного застосування омалізумабу в дозах до 75 мг/кг. Крім того, не спостерігалися генотоксичні ефекти в окремому доклінічному дослідженні генотоксичності.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Ксолар не впливає або має лише незначний вплив на здатність керувати автомобілем і працювати з іншими механізмами.
Спосіб застосування та дози.
Ксолар повинен призначати лікар, який має досвід діагностики і лікування тяжкої персистуючої астми, хронічного риносинуситу з назальними поліпами (ХРСзНП) або хронічної спонтанної кропив’янки (ХСК).
Дозування
Алергічна астма та хронічний риносинусит з назальними поліпами (ХРСзНП)
При визначенні дозування для лікуванні алергічної астми та ХРСзНП дотримуються однакових принципів. Необхідну дозу і частоту прийому Ксолару при вказаних станах визначають за концентрацією IgE (МО/мл), яку встановлюють перед початком лікування, а також за масою тіла пацієнта (кг). До початку застосування для призначення дози у пацієнта потрібно визначити рівень IgE за допомогою кількісного аналізу загального IgE з використанням будь-якої промислової сироватки. Залежно від показників рекомендована доза Ксолару становить 75–600 мг. Цю дозу можна поділити на 1–4 введення.
Менша ймовірність позитивного ефекту відзначалась у пацієнтів з алергічною астмою, рівень IgE у яких перед початком лікування був нижче 76 МО/мл. До початку терапії лікарю слід переконатися, що у дорослих пацієнтів, дітей віком від 12 років з IgE нижче 76 МО/мл і дітей віком від 6 до 12 років з IgE нижче 200 МО/мл спостерігається безсумнівна in vitro реактивність (радіоалергосорбентний тест [RAST]) до постійно присутнього алергену.
Перерахунок дози наведено в таблиці 5, а визначення дози – у таблицях 6 і 7.
Не слід призначати Ксолар пацієнтам, у яких рівень IgE або маса тіла перевищує рівні, вказані у таблиці дозувань.
Максимальна рекомендована доза становить 600 мг омалізумабу кожні два тижні.
Таблиця 5
Перерахунок дози на кількість шприців, кількість ін’єкцій і загальний об’єм ін’єкції на кожне введення
|
Доза (мг) |
Кількість шприців |
Кількість ін’єкцій |
Загальний об’єм ін’єкції (мл) |
|
|
75 мг |
150 мг |
|||
|
75 |
1 |
0 |
1 |
0,5 |
|
150 |
0 |
1 |
1 |
1,0 |
|
225 |
1 |
1 |
2 |
1,5 |
|
300 |
0 |
2 |
2 |
2,0 |
|
375 |
1 |
2 |
3 |
2,5 |
|
450 |
0 |
3 |
3 |
3,0 |
|
525 |
1 |
3 |
4 |
3,5 |
|
600 |
0 |
4 |
4 |
4,0 |
Таблиця 6
ВВЕДЕННЯ КОЖНІ 4 ТИЖНІ.
Дози лікарського засобу Ксолар (мг/дозу), які вводять шляхом підшкірної ін’єкції кожні 4 тижні
|
Вихідний рівень IgE (МО/мл) |
Маса тіла (кг) |
|||||||||
|
> 20–25* |
> 25–30* |
> 30–40 |
> 40–50 |
> 50–60 |
> 60–70 |
> 70–80 |
> 80–90 |
> 90–125 |
> 125–150 |
|
|
≥ 30–100 |
75 |
75 |
75 |
150 |
150 |
150 |
150 |
150 |
300 |
300 |
|
> 100–200 |
150 |
150 |
150 |
300 |
300 |
300 |
300 |
300 |
450 |
600 |
|
> 200–300 |
150 |
150 |
225 |
300 |
300 |
450 |
450 |
450 |
600 |
|
|
> 300–400 |
225 |
225 |
300 |
450 |
450 |
450 |
600 |
600 |
||
|
> 400–500 |
225 |
300 |
450 |
450 |
600 |
600 |
||||
|
> 500–600 |
300 |
300 |
450 |
600 |
600 |
|||||
|
> 600–700 |
300 |
450 |
600 |
|||||||
|
> 700–800 |
||||||||||
|
> 800–900 |
ВВЕДЕННЯ КОЖНІ 2 ТИЖНІ, |
|||||||||
|
> 900–1000 |
див. ТАБЛИЦЮ 5 |
|||||||||
|
> 1000–1100 |
||||||||||
* В основних дослідженнях щодо ХРСзНП застосування пацієнтам з масою тіла нижче 30 кг не досліджувалось.
Таблиця 7
ВВЕДЕННЯ КОЖНІ 2 ТИЖНІ.
Дози лікарського засобу Ксолар (мг/дозу), які вводять шляхом підшкірної ін’єкції кожні 2 тижні
|
Вихідний рівень IgE (МО/мл) |
Маса тіла (кг) |
||||||||||
|
> 20–25* |
> 25–30* |
> 30–40 |
> 40–50 |
> 50–60 |
> 60–70 |
> 70–80 |
> 80–90 |
> 90–125 |
> 125– 150 |
||
|
≥ 30–100 |
ВВЕДЕННЯ КОЖНІ 4 ТИЖНІ |
||||||||||
|
> 100–200 |
див. ТАБЛИЦЮ 4 |
||||||||||
|
> 200–300 |
375 |
||||||||||
|
> 300–400 |
450 |
525 |
|||||||||
|
> 400–500 |
375 |
375 |
525 |
600 |
|||||||
|
> 500–600 |
375 |
450 |
450 |
600 |
|||||||
|
> 600–700 |
225 |
375 |
450 |
450 |
525 |
||||||
|
> 700–800 |
225 |
225 |
300 |
375 |
450 |
450 |
525 |
600 |
|||
|
> 800–900 |
225 |
225 |
300 |
375 |
450 |
525 |
600 |
||||
|
> 900–1000 |
225 |
300 |
375 |
450 |
525 |
600 |
|||||
|
> 1000–1100 |
225 |
300 |
375 |
450 |
600 |
Недостатньо даних, щоб рекомендувати дозу. |
|||||
|
> 1100–1200 |
300 |
300 |
450 |
525 |
600 |
||||||
|
> 1200–1300 |
300 |
375 |
450 |
525 |
|||||||
|
> 1300–1500 |
300 |
375 |
525 |
600 |
|||||||
* В основних дослідженнях щодо ХРСзНП застосування пацієнтам з масою тіла нижче 30 кг не досліджувалось.
Введення
Тільки для підшкірного введення. Не вводити внутрішньовенно або внутрішньом’язово.
Дози, що перевищують 150 мг (таблиця 5), слід розділити на дві або більше ін’єкції.
Для пацієнтів, що не мають анафілаксії в анамнезі, можливе самостійне введення Ксолару або за допомогою особи, що доглядає за ним, починаючи з 4-ї дози і далі, якщо лікар визначить, що це доцільно. Пацієнт або особа, що за ним доглядає, повинні бути навчені правильній техніці ін’єкцій та розпізнаванню ранніх ознак та симптомів серйозних алергічних реакцій.
Пацієнти або особи, що доглядають за ними, мають бути проінструктовані вводити повну дозу Ксолару відповідно до вказівок у інструкції з медичного застосування.
Дітям віком від 6 до 12 років не слід робити ін’єкції препарату Ксолар самостійно, однак, якщо лікар вважає це доцільним, особа, що доглядає за дитиною, може зробити їй ін’єкцію цього лікарського засобу після належного навчання.
Тривалість лікування, контроль і корекція дози
Алергічна астма
Ксолар призначений для тривалого лікування. Клінічні дослідження підтвердили ефективність лікування Ксоларом, який застосовують протягом принаймні 12–16 тижнів. На 16-му тижні терапії Ксоларом необхідно оцінити стан пацієнта щодо ефективності лікування до введення наступних ін’єкцій. Рішення про продовження терапії Ксоларом повинно ґрунтуватися на висновку про досягнення значного прогресу відносно загального контролю астми.
Хронічний риносинусит з назальними поліпами (ХРСзНП)
У клінічних дослідженнях ХРСзНП через 4 тижні спостерігались зміни показника назальних поліпів (ПНП) та показника закладеності носа (ПЗН). Слід періодично переоцінювати необхідність продовження терапії залежно від тяжкості захворювання пацієнта та рівня контролю симптомів.
Алергічна астма та хронічний риносинусит з назальними поліпами (ХРСзНП)
Припинення лікування Ксоларом у більшості випадків призводить до зворотного підвищення рівня вільного IgE і розвитку відповідних симптомів. Рівень загального IgE підвищений упродовж лікування і залишається підвищеним протягом одного року після припинення лікування. Таким чином, повторне визначення рівня IgE під час лікування Ксоларом не можна використовувати для встановлення необхідної дози препарату. Визначення дози після перерви в лікуванні, що триває менше одного року, потрібно проводити за рівнем IgE, отриманим при початковому визначенні дози. Рівень загального IgE сироватки може визначатися повторно з метою вибору дози, якщо лікування Ксоларом було перерване більше року тому.
При значних змінах маси тіла потрібна корекція дози.
Хронічна спонтанна кропив’янка (ХСП), дозування 150 мг/1 мл
Рекомендована доза становить 300 мг шляхом підшкірних ін’єкцій кожні 4 тижні.
Необхідно періодично переоцінювати потребу у подальшому продовженні прийому препарату.
Дані клінічних досліджень стосовно лікування тривалістю понад 6 місяців за цим показанням обмежені.
Особливі популяції
Літній вік (від 65 років)
Доступні обмежені дані щодо застосування лікарського засобу Ксолар пацієнтам віком понад 65 років, однак немає підстав вважати, що для пацієнтів літнього віку потрібний інший підхід до дозування, ніж для молодших дорослих пацієнтів.
Пацієнти з порушенням функції нирок або печінки
Дослідження впливу порушення функції нирок або печінки на фармакокінетику лікарського засобу Ксолар не проводилися. Оскільки кліренс омалізумабу в клінічних дозах відбувається переважно за участю ретикулярної ендотеліальної системи (РЕС), його зміна у зв’язку з порушенням функції нирок або печінки є малоймовірною. Хоча немає специфічних рекомендацій щодо коригування дози, Ксолар таким пацієнтам слід застосовувати з обережністю.
Діти
Безпека та ефективність Ксолару для лікування алергічної астми у пацієнтів віком до 6 років не встановлені. Немає даних.
Безпека та ефективність Ксолару для лікування ХРСзНП у пацієнтів віком до 18 років не встановлені.
Безпека та ефективність Ксолару для лікування ХСП у пацієнтів віком до 12 років не встановлені.
Спеціальні вказівки щодо застосування
Упаковка містить наповнений шприц, що запакований у пластиковий лоток (рис. 3).
|
Захисний кожух шприца |
|
Запобіжні крильця шприца |
|
Кришка на голку |
|
Оглядове віконце Маркування та термін придатності |
|
Захвати для пальців |
|
Поршень |
|
Поршнева головка |
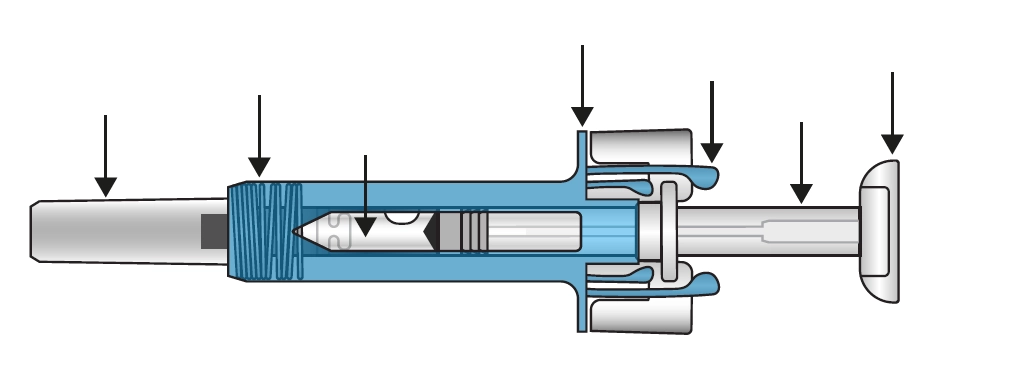
Рис. 3. Зовнішній вигляд Ксолару, розчину для ін’єкцій, 75 мг/0,5 мл або 150 мг/1 мл, у попередньо наповненому шприці (блакитний для 75 мг/0,5 мл; фіолетовий 150 мг/1 мл).
• Не відкривайте герметичну зовнішню пластикову упаковку, поки не будете готові використовувати Ксолар, розчин для ін’єкцій.
• Не використовуйте лікарській засіб, якщо ущільнення на зовнішній коробці або ущільнення пластикового лотка поламані, оскільки це може бути небезпечним.
• Не струшуйте шприц.
• Будьте обережні, щоб не торкатися запобіжних крилець шприца перед використанням. Якщо торкнутися крилець, захисний шприц може активуватися занадто рано.
• Знімайте кришку голки безпосередньо тільки перед тим, як робити ін’єкцію.
• Шприц не можна використовувати повторно. Утилізуйте використаний шприц відразу після використання.
• Перед використанням необхідно вийняти шприц з холодильника і дати йому досягти кімнатної температури (25 0С) перед тим, як готувати його до ін’єкції (це займе близько 20 хвилин). Залиште шприц у коробці, щоб захистити його від світла. Шприц можна повернути назад у холодильник за потреби. Загальний час, протягом якого шприц дозволяється тримати при кімнатній температурі (25 0С) перед використанням, не повинен перевищувати 48 годин.
Місце для ін’єкції
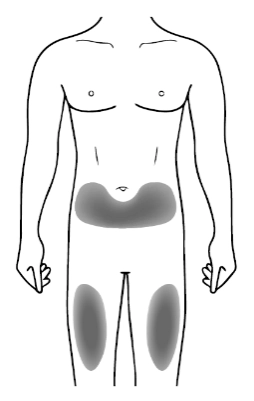
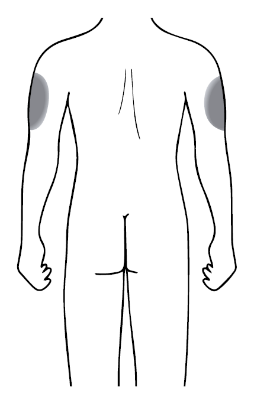
|
• Рекомендована ділянка для ін’єкції – передня частина стегон; також можна використовувати низ живота, крім ділянки приблизно 5 сантиметрів навколо пупка. • Якщо потрібно зробити більше однієї ін’єкції для отримання повної дози, вибирайте інше місце для проведення кожної ін’єкції. • Не робіть ін’єкції в місця, де шкіра ніжна, є синці, почервоніння або затвердіння. Уникайте також ділянок з рубцями або розтяжками. Якщо ін’єкцію робить особа, що доглядає за пацієнтом, то також можна використати ділянки зовнішнього боку плеча. |
Приготування Ксолару, розчину для ін’єкцій (75 мг/0,5 мл або 150 мг/1 мл) у попередньо наповненому шприці, до ін’єкції
Примітка: Залежно від дози, призначеної лікарем, вам може бути потрібно підготувати один або декілька попередньо наповнених шприців та вколоти вміст всіх підготовлених шприців. У таблиці 8 наведено приклади того, скільки ін’єкцій кожної дози потрібно для призначеної дози.
Таблиця 8
|
Кількість шприців, необхідних для введення дози |
|
Доза |
|
1. Вийміть коробку зі шприцом із холодильника та залиште її у відкритому стані приблизно на 20 хвилин, щоб вона досягла кімнатної температури (залиште шприц у коробці, щоб захистити від світла).
2. Коли ви будете готові використовувати шприц, ретельно вимийте руки водою з милом.
3. Очистіть місце уколу спиртовим тампоном.
4. Вийміть пластиковий лоток із коробки і відклейте паперовий шар. Витягніть шприц із лотка, взявши його за середину захисного кожуха.
5. Огляньте шприц. Розчин має бути від прозорого до дещо каламутного. Колір розчину може варіюватися від безбарвного до слабо коричнювато-жовтого. Ви можете побачити бульбашку повітря, що є нормальним явищем. НЕ ВИКОРИСТОВУЙТЕ, якщо шприц зламаний або якщо рідина помітно каламутна або явно коричнева чи містить частинки.
6. Тримаючи шприц горизонтально, перевірте в оглядовому вікні термін придатності, надрукований на етикетці. Примітка: Можна повернути внутрішню частину шприцевого вузла, щоб побачити етикетку у оглядовому вікні. НЕ ВИКОРИСТОВУЙТЕ, якщо термін придатності закінчився.
Як використовувати Ксолар, розчин для ін’єкцій (75 мг/0,5 мл або 150 мг/1 мл) у попередньо наповненому шприці
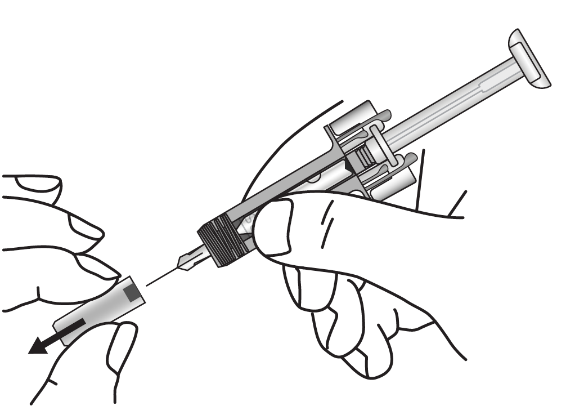
|
Обережно зніміть кришку голки зі шприца. Відкиньте кришку голки. На кінці голки ви можете побачити краплю рідини. Це нормально. |
|
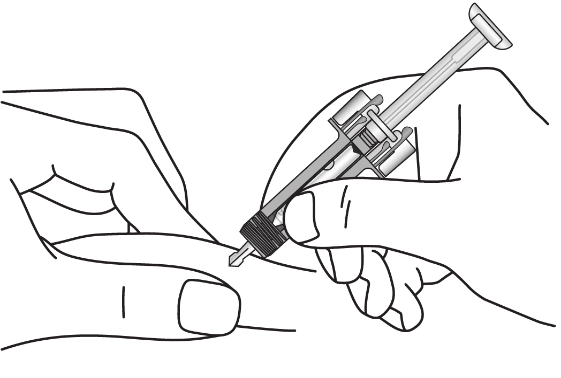
|
Акуратно затисніть шкіру в місці ін’єкції та повністю введіть голку, як показано, щоб забезпечити повне введення лікарського засобу. |
|
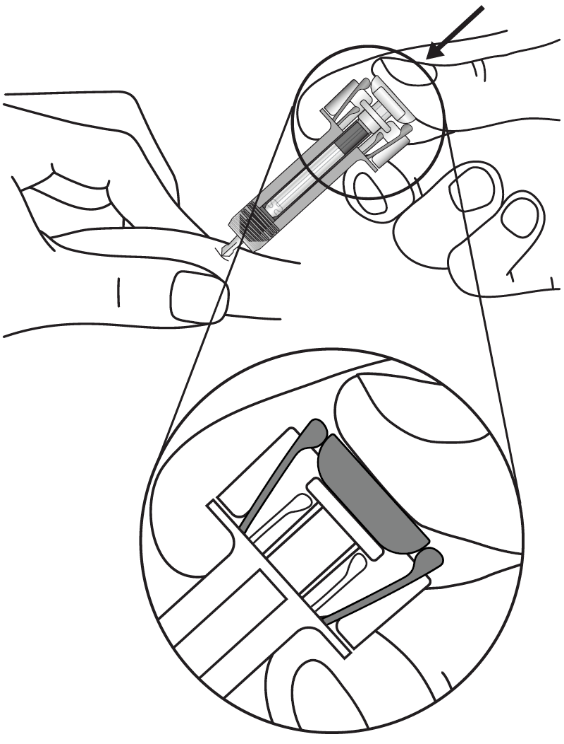
|
Тримайте шприц, як показано. Повільно натискайте на поршень до упору, щоб головка поршня повністю розмістилася між запобіжними крильцями шприца. |
|
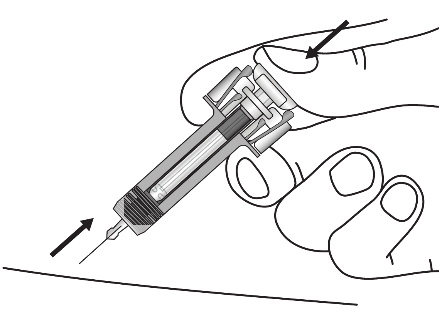
|
Тримайте поршень повністю натиснутим, поки обережно виймаєте голку з місця ін’єкції. |
|
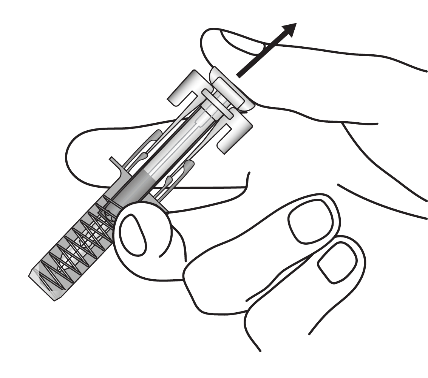
|
Повільно відпустіть поршень, після чого захисний кожух шприца автоматично закриє голку. У місці ін’єкції може бути невелика кількість крові. Можна натиснути ватним диском або марлею на місце ін’єкції і потримати протягом 30 секунд. Не натирайте місце ін’єкції. Якщо потрібно, місце ін’єкції можна заклеїти невеликим лейкопластиром. |
Будь-який невикористаний препарат або відходи потрібно утилізувати відповідно до місцевих вимог.
Діти.
Алергічна астма
Ксолар можна застосовувати дітям віком від 6 років, які вже отримують ліки від астми, але симптоми астми недостатньо добре контролюються такими ліками, як стероїдні інгалятори у високих дозах та інгалятори бета-агоністів.
Діти віком від 6 до 11 років не повинні самостійно застосовувати Ксолар у попередньо наповненому шприці. Однак, якщо лікар вважає це доцільним, то особа, що доглядає за дитиною, може зробити їй ін’єкцію Ксолару після належного навчання.
Хронічний риносинусит з назальними поліпами (ХРзНП)
Ксолар не слід застосовувати дітям (віком до 18 років) за цим показанням.
Хронічна спонтанна кропив’янка (ХСК)
Ксолар можна застосовувати дітям віком від 12 років, які вже отримують антигістамінні препарати, але симптоми ХСК не контролюються цими ліками належним чином. Доза для підлітків віком від 12 років така ж, як для дорослих.
Передозування.
Максимальна переносима доза Ксолару не визначалася. Внутрішньовенне введення пацієнтам разової дози до 4 000 мг не спричиняло проявів дозолімітуючої токсичності. Найвища кумулятивна доза, введена пацієнтові, становила 44 000 мг протягом 20-тижневого періоду і не спричинила при цьому будь-якого гострого побічного ефекту.
При підозрі на передозування слід проводити моніторинг стану пацієнта стосовно будь-яких незвичних симптомів. Слід належним чином визначити діагноз і застосувати лікування.
Побічні реакції.
Алергічна астма та хронічний риносинусит з назальними поліпами (ХРСзНП)
Під час клінічних досліджень за участю дорослих і дітей віком від 12 років з алергічною астмою найбільш частими побічними реакціями були головний біль і реакції в місці ін’єкції, включаючи біль у місці ін’єкції, набряк, почервоніння і свербіж. У ході клінічних досліджень у дітей віком від 6 до 12 років найбільш частими побічними реакціями, які пов’язані з лікарським засобом, були головний біль, гарячка і біль у верхній частині живота. Більшість реакцій були легкого або середнього ступеня тяжкості. Під час клінічних досліджень у пацієнтів віком від 18 років з ХРСзНП найбільш частими побічними реакціями, які пов’язані з лікарським засобом, були головний біль, запаморочення, артралгія, біль у верхній частині живота та реакції у місці ін’єкції.
У таблиці 9 побічні реакції, зареєстровані під час клінічних досліджень у загальній популяції дослідження безпеки щодо алергічної астми та ХРСзНП, вказано за класами систем органів MedDRA і частотою. В межах кожної групи за частотою побічні реакції представлено в порядку зменшення серйозності. Частота визначена таким чином: дуже часто (≥ 1/10), часто (≥ 1/100 – < 1/10), нечасто (≥ 1/1000 – < 1/100), рідко (≥ 1/10000 – < 1/1000) і дуже рідко (< 1/10000). Частота явищ, повідомлення про які отримано в період постмаркетингового спостереження, вказана як невідома (не можна визначити за наявними даними).
Таблиця 9
Побічні реакції, зареєстровані під час клінічних досліджень щодо алергічної астми та ХРСзНП
|
Частота |
Побічні реакції |
|
Інфекції та інвазії |
|
|
Нечасто |
Фарингіт |
|
Рідко |
Паразитарні інвазії |
|
З боку крові і лімфатичної системи |
|
|
Частота невідома |
Ідіопатична тромбоцитопенія, включаючи тяжкі випадки |
|
З боку імунної системи |
|
|
Рідко |
Анафілактична реакція, інші серйозні алергічні стани, розвиток антитіл до препарату |
|
Частота невідома |
Сироваткова хвороба, що може включати гарячку і лімфаденопатію |
|
З боку нервової системи |
|
|
Часто |
Головний біль* |
|
Нечасто |
Синкопе, парестезія, сонливість, запаморочення*** |
|
З боку судинної системи |
|
|
Нечасто |
Постуральна гіпотензія, припливи крові |
|
З боку органів дихання, грудної клітки і середостіння |
|
|
Нечасто |
Алергічний бронхоспазм, кашель |
|
Рідко |
Набряк гортані |
|
Частота невідома |
Алергічний гранулематозний васкуліт (синдром Чарга – Стросс) |
|
З боку шлунково-кишкового тракту |
|
|
Часто |
Біль у верхніх відділах живота**,*** |
|
Нечасто |
Ознаки або симптоми диспепсії, діарея, нудота |
|
З боку шкіри і підшкірної клітковини |
|
|
Нечасто |
Фоточутливість, кропив’янка, висипання, свербіж |
|
Рідко |
Ангіоневротичний набряк |
|
Частота невідома |
Алопеція |
|
З боку скелетно-м’язової системи і сполучної тканини |
|
|
Нечасто Рідко Частота невідома |
Артралгія**** Системний червоний вовчак (СЧВ) Міалгія, набряклість суглобів |
|
Загальні порушення і стани, пов’язані зі способом застосування препарату |
|
|
Дуже часто |
Пірексія** |
|
Часто |
Реакції в місці ін’єкції, такі як припухлість, еритема, біль, свербіж |
|
Нечасто |
Грипоподібне захворювання, набряклість верхніх кінцівок, збільшення маси тіла, стомлюваність |
* Дуже часто у дітей віком від 6 до 12 років.
** У дітей віком від 6 до 12 років.
*** Часто у дослідженнях щодо назальних поліпів.
**** Частота невідома у дослідженнях щодо алергічної астми.
Хронічна спонтанна кропив’янка
Безпеку та переносимість омалізумабу досліджували при застосуванні доз 75 мг, 150 мг та 300 мг кожні 4 тижні 975 пацієнтам з ХСК, 242 з яких одержували плацебо. Загалом 733 пацієнти отримували омалізумаб до 12 тижнів та 490 пацієнтів – до 24 тижнів. З них 412 пацієнтів отримували омалізумаб до 12 тижнів та 333 пацієнти отримували омалізумаб до 24 тижнів в дозі 300 мг.
Побічні реакції при ХСК виникали при введенні різних доз пацієнтам з достовірно різними факторами ризику, супутніми захворюваннями, віком та одночасно застосовуваними лікарськими засобами (наприклад, дослідження щодо астми включало дітей віком від 6 до 12 років), див. таблицю 10.
У таблиці 10 перераховано побічні реакції (події, що виникали в ≥ 1 % пацієнтів у будь-якій групі лікування на ≥ 2% частіше в будь-який з груп лікування омалізумабом порівняно з групою плацебо (після медичного обстеження)), які відзначалися при застосуванні дози 300 мг у трьох об’єднаних дослідженнях фази III. Наведені побічні реакції діляться на дві групи: реакції, що виникли протягом 12-тижневого і 24-тижневого періоду лікування.
Побічні реакції наведено за класами систем органів MedDRA. У межах кожного класу системи органів побічні реакції розподілено за частотою, найбільш часті – перші. Категорії частоти визначено таким чином: дуже часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); рідко (≥1/10000 до <1/1000); дуже рідко (<1/10000) та невідомо (частоту не можна визначити за наявними даними).
|
Таблиця 10 |
|||
|
Побічні реакції відповідно до об’єднаних баз даних з безпеки при ХСК (день 1 – тиждень 24) при прийомі омалізумабу в дозі 300 мг |
|||
|
12-тижневе лікування |
Об’єднані дослідження 1, 2 та 3 омалізумабу |
Категорія частоти |
|
|
Плацебо N = 242 |
300 мг N = 412 |
||
|
Інфекції та інвазії |
|||
|
Синусит |
5 (2,1 %) |
20 (4,9 %) |
Часто |
|
Порушення з боку нервової системи |
|||
|
Головний біль |
7 (2,9 %) |
25 (6,1 %) |
Часто |
|
Порушення з боку скелетно-м’язової системи і сполучної тканини |
|||
|
Артралгія |
1 (0,4 %) |
12 (2,9 %) |
Часто |
|
Загальні порушення та порушення у місці введення |
|||
|
Реакції в місці ін’єкції* |
2 (0,8 %) |
11 (2,7 %) |
Часто |
|
24-тижневе лікування |
Об’єднані дослідження 1 та 3 омалізумабу |
Категорія частоти |
|
|
Плацебо N = 163 |
300 мг N = 333 |
||
|
Інфекції та інвазії |
|||
|
Інфекція верхніх дихальних шляхів |
5 (3,1 %) |
19 (5,7 %) |
Часто |
* Хоча різниця у порівнянні з плацебо більше ніж 2 % не виявлена, реакції в місці введення були включені, оскільки в усіх випадках був встановлений причинно-наслідковий зв’язок, пов’язаний із лікуванням в рамках дослідження.
Опис окремих побічних реакцій
Порушення з боку імунної системи
Для отримання додаткової інформації див. розділ «Особливості застосування».
Анафілаксія
Анафілактичні реакції під час клінічних досліджень спостерігалися дуже рідко. Проте у результаті сумарного пошуку в базі даних щодо безпеки в постмаркетингових дослідженнях визначено загалом 898 випадків анафілаксії. На підставі розрахункової експозиції 566,923 пацієнто-років лікування, це призводить до рівня звітності приблизно у 0,20 %.
Артеріальна тромбоемболія (ATE)
У ході контрольованих клінічних досліджень та в поточному аналізі обсерваційних досліджень спостерігалась чисельна незбалансованість у АТЕ. Визначення комбінованої кінцевої АТЕ включало інсульт, транзиторну ішемічну атаку, інфаркт міокарда, нестабільну стенокардію та серцево-судинну смерть (включаючи смерть з невідомої причини). У кінцевому аналізі обсерваційного дослідження частота ATE на 1000 пацієнто-років становила 7,52 (115/15286 пацієнто-років) в групі пацієнтів, що приймали лікарський засіб Ксолар, та 5,12 (51/9963 пацієнто-років) в контрольній групі. У багатофакторному аналізі з урахуванням початкових факторів серцево-судинного ризику відношення ризиків становило 1,32 (95 % довірчий інтервал 0,91–1,91). У окремому аналізі об’єднаних клінічних досліджень, які включали всі рандомізовані подвійно сліпі плацебо-контрольовані клінічні дослідження тривалістю 8 або більше тижнів, частота ATE на 1000 пацієнто-років становила 2,69 (5/1856 пацієнто-років) в групі пацієнтів, що приймали лікарський засіб Ксолар, та 2,38 (4/1680 пацієнто-років) в групі плацебо (відношення ризиків 1,13, 95 % довірчій інтервал 0,24–5,71).
Тромбоцити
Під час клінічних досліджень у декількох пацієнтів виявлено кількість тромбоцитів, нижчу за нижню межу нормального діапазону лабораторних показників. У жодному з цих випадків така зміна не призводила до кровотеч і зниження кількості гемоглобіну. Випадків персистуючої тромбоцитопенії, подібних спостережуваним у нижчих приматів, у людей не відзначалося (пацієнти віком від 6 років), хоча під час постмаркетингового спостереження було отримано окремі повідомлення про випадки ідіопатичної тромбоцитопенії, в тому числі тяжкої.
Паразитарні інвазії
Плацебо-контрольоване дослідження виявило незначне підвищення рівня захворюваності у пацієнтів з постійним високим ризиком гельмінтних інвазій на тлі прийому омалізумабу, що не було статистично значущим. Перебіг, тяжкість і відповідь на лікування інвазій не зазнали змін.
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua
Термін придатності. 18 місяців.
Лікарський засіб можна тримати при температурі 25 °С протягом 48 годин (в цілому). У разі необхідності препарат можна повернути в холодильник для подальшого використання.
Умови зберігання.
Зберігати при температурі 2–8 °С у недоступному для дітей місці. Не заморожувати. Зберігати в оригінальній упаковці.
Упаковка.
Розчин для ін’єкцій, 75 мг/0,5 мл
По 0,5 мл розчину для ін’єкцій у попередньо наповненому шприці з закріпленою голкою та кришкою на голку. По 1 попередньо наповненому шприцу у блістері; 1 блістер у картонній коробці.
Розчин для ін’єкцій, 150 мг/1 мл
По 1 мл розчину для ін’єкцій у попередньо наповненому шприці з закріпленою голкою та кришкою на голку. По 1 попередньо наповненому шприцу у блістері; 1 блістер у картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
Новартіс Фарма ГмбХ, Німеччина / Novartis Pharma GmbH, Germany.
Місце знаходження виробника та адреса місця провадження його діяльності.
Рунштрассе 25, Гостенхоф, Нюрнберг, Баварія, 90429, Німеччина /
Roonstrasse 25, Gostenhof, Nuremberg, Bavaria, 90429, Germany.

