КАСПОФУНГІН АСІНО
-
Україна ТОВ "АСІНО УКРАЇНА"Форма выпуску: порошок для концентрату для розчину для інфузій 50 мг, по 50 мг у флаконі, по 1 флакону в картонній пачціСклад: 1 флакон містить каспофунгіну 50 мг у вигляді каспофунгіну ацетату (60,6 мг)Умови відпуску: за рецептомНомер реєстраційного посвідчення: UA/20924/01/01код АТС: J02AX04Термін придатності: 2 роки
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
Каспофунгін Асіно
(Caspofungin Acino)
Склад:
діюча речовина: каспофунгін;
1 флакон містить каспофунгіну 50 мг у вигляді каспофунгіну ацетату (60,6 мг);
допоміжні речовини: сахароза, маніт (E 421), кислота оцтова льодяна, натрію гідроксид.
Лікарська форма. Порошок для концентрату для розчину для інфузій.
Основні фізико-хімічні властивості: пориста маса або порошок від білого до майже білого кольору.
Фармакотерапевтична група
Протигрибкові засоби для системного застосування. Інші протигрибкові засоби для системного застосування. Каспофунгін.
Код АТХ J02A X04.
Фармакологічні властивості
Фармакодинаміка
Механізм дії
Каспофунгіну ацетат являє собою напівсинтетичну ліпопептидну сполуку (ехінокандин), синтезовану з продукту ферментації Glarea lozoyensis. Каспофунгіну ацетат пригнічує синтез
β-(1,3)-Dглюкану – важливого компонента клітинної стінки багатьох гіфоміцетів і дріжджів. У клітинах ссавців β-(1,3)-Dглюкан не присутній.
Фунгіцидна активність каспофунгіну була продемонстрована проти дріжджів Candida. Дослідження in vitro та in vivo демонструють, що експозиція Aspergillus до каспофунгіну призводить до лізису та смерті верхніх кінців і точок розгалуження гіфів, де відбувається ріст та розподіл клітин.
Фармакодинамічні ефекти
Каспофунгін in vitro демонструє активність проти штамів Aspergillus (Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus та Aspergillus candidus). Каспофунгін in vitro також є активним проти штамів Candida (Candida albicans, Canida dubliniensis, Candida glabrata, Candida guilliermondii, Candida kefyr, Candida krusei, Candida lipolytica, Candida lusitaniae, Candida parapsilosis, Candida rugosa та Candida tropicalis), включаючи ізоляти з множинними транспортними мутаціями та ізоляти з набутою внутрішньою резистентністю до флуконазолу, амфотерицину B та 5-флуцитозину.
Для дріжджів були розроблені стандартизовані методи тестування чутливості за допомогою EUCAST. Для каспофунгіну EUCAST ще не встановлено порогових значень через значну міжлабораторну варіабельність діапазонів МІК для каспофунгіну. Замість контрольних точок ізоляти Candida, чутливі до анідулафунгіну та мікафунгіну, слід вважати чутливими до каспофунгіну. Аналогічно, ізоляти C. parapsilosis є проміжними до анідулафунгіну та мікафунгін можна вважати проміжними до каспофунгіну.
Механізм резистентності
Ізоляти Candida зі зниженою чутливістю до каспофунгіну були виявлені у невеликої кількості пацієнтів під час лікування (МІК для каспофунгіну > 2 мг/л (збільшення МІК у 4-30 разів) були зареєстровані за допомогою стандартизованих методів тестування МІК, схвалених CLSI). Виявленим механізмом резистентності є мутації генів FKS1 та/або FKS2 (для C. glabrata ). Ці випадки були пов’язані з поганими клінічними результатами.
Було виявлено розвиток стійкості in vitro до каспофунгіну у видів Aspergillus. В обмеженому клінічному досвіді спостерігалася стійкість до каспофунгіну у пацієнтів з інвазивним аспергільозом. Механізм резистентності не встановлений. Випадки резистентності до каспофунгіну різних клінічних ізолятів Aspergillus виникають рідко. Спостерігалася резистентність Candida до каспофунгіну, але частота може відрізнятися залежно від виду або регіону.
Клінічна ефективність і безпека
Інвазивний кандидоз у дорослих пацієнтів
239 пацієнтів були залучені до початкового дослідження, у якому порівнювали каспофунгін та амфотерицин при лікуванні інвазивного кандидозу.
24 пацієнти мали нейтропенію. Найчастішими діагнозами були інфекції кровотоку (кандидемія) (77 %, n=186) та кандидозний перитоніт (8 %, n=19); пацієнти з кандидозним ендокардитом, остеомієлітом або менінгітом були виключені з цього дослідження. Каспофунгін застосовували в дозі 50 мг на добу (після введення навантажувальної дози 70 мг у перший день), тоді як амфотерицин В застосовували у дозі 0,6-0,7 мг/кг/добу пацієнтам без нейтропенії або 0,7-1,0 мг/кг/добу пацієнтам з нейтропенією. Середня тривалість внутрішньовенної терапії становила 11,9 дня з діапазоном від 1 до 28 днів. Сприятлива реакція передбачала як зникнення симптомів, так і мікробіологічного очищення від інфекції Candida. 224 пацієнти були включені в первинний аналіз ефективності (аналіз MITT) відповіді наприкінці внутрішньовенної досліджуваної терапії; сприятливі показники відповіді на лікування інвазивного кандидозу були порівнянними для каспофунгіну (73 % [80/109]) та амфотерицину В (62 % [71/115]) [% різниця 12,7 (95,6 % інтервал довіри – 0,7, 26,0)]. Серед пацієнтів із кандидемією сприятливі показники відповіді наприкінці внутрішньовенної досліджуваної терапії були порівнянними для каспофунгіну (72 % [66/92]) та амфотерицину В (63 % [59/94]) у первинному аналізі ефективності (аналіз MITT) [ % різниця 10,0 (95,0 % інтервал довіри – 4,5, 24,5)]. Більш обмежені дані є щодо лікування пацієнтів з вогнищами інфекції, які не кровоточать. Сприятлива частота відповіді у пацієнтів з нейтропенією становила 7/14 (50 %) у групі каспофунгіну та 4/10 (40 %) у групі амфотерицину B. Ці обмежені дані підтверджуються результатами емпіричного дослідження терапії.
У другому дослідженні пацієнти з інвазивним кандидозом отримували добову дозу каспофунгіну в дозі 50 мг на добу (після введення навантажувальної дози 70 мг у перший день) або каспофунгінат 150 мг/добу (див. розділ «Побічні реакції»). У цьому дослідженні дозу каспофунгіну вводили протягом 2 годин (замість звичайного введення протягом 1 години). Дослідження виключало пацієнтів із підозрою на ендокардит, менінгіт або остеомієліт, спричинені Candida. Оскільки це було дослідження первинної терапії, пацієнти, які були стійкі до попередніх протигрибкових засобів, також були виключені. Кількість пацієнтів з нейтропенією, залучених до цього дослідження, також була обмеженою (8,0 %). Ефективність була вторинною кінцевою точкою в цьому дослідженні. Пацієнти, які відповідали критеріям включення та отримували одну або кілька доз досліджуваної терапії каспофунгіну, були включені в аналіз ефективності. Сприятлива загальна відповідь наприкінці терапії каспофунгіном була подібною у 2 групах лікування: 72 % (73/102) і 78 % (74/95) для груп лікування каспофунгіном 50 мг і 150 мг відповідно (різниця 6,3 % [95 % інтервал довіри – 5,9, 18,4]).
Інвазивний аспергільоз у дорослих пацієнтів
69 дорослих пацієнтів (віком 18-80 років) з інвазивним аспергільозом були залучені до відкритого неконтрольованого дослідження для оцінки безпеки, переносимості та ефективності каспофунгіну. Пацієнти повинні були мати або рефрактерність (прогресування захворювання або відсутність покращення при застосуванні інших протигрибкових лікарських засобів протягом принаймні 7 днів) (84 % залучених пацієнтів), або непереносимість (16 % залучених пацієнтів) інших стандартних протигрибкових методів лікування. Більшість пацієнтів мали супутні захворювання (гематологічні злоякісні пухлини [n = 24], алогенна трансплантація кісткового мозку або трансплантація стовбурових клітин [n = 18], трансплантація органів [n = 8], солідна пухлина [n = 3] або інші захворювання [n = 10) ]). Для діагностики інвазивного аспергільозу та відповіді на терапію використовували суворі визначення, змодельовані за критеріями дослідницької групи мікозів (сприятлива відповідь вимагала клінічно значущого покращення рентгенограм, а також ознак і симптомів). Середня тривалість терапії становила 33,7 дня з діапазоном від 1 до 162 днів. Незалежна група експертів встановила, що 41 % (26/63) пацієнтів, які отримували принаймні одну дозу каспофунгіну, мали сприятливу відповідь. Серед тих пацієнтів, які отримували більше 7 днів терапії каспофунгіном, 50 % (26/52) мали сприятливу відповідь. Сприятливий рівень відповіді для пацієнтів, які або були рефрактерними до попередніх терапій, або не переносили її, становив 36 % (19/53) і 70 % (7/10) відповідно. Незважаючи на те, що дози попередньої протигрибкової терапії у 5 пацієнтів, зареєстрованих як рефрактерні, були нижчими, ніж дози, які часто призначали для інвазивного аспергільозу, частота сприятливої відповіді під час терапії каспофунгіном у цих пацієнтів була подібною до тієї, що спостерігалася в інших рефрактерних пацієнтів (2/5 проти 17/ 48 відповідно). Рівень відповіді серед пацієнтів із захворюванням легенів і позалегеневим захворюванням становив
47 % (21/45) і 28 % (5/18) відповідно. Серед пацієнтів із позалегеневими захворюваннями 2 з 8 пацієнтів, які також мали певне, вірогідне чи можливе ураження ЦНС, мали сприятливу відповідь.
Емпірична терапія при підозрі на грибкові інфекції (Candida або Aspergillus) у дорослих та дітей з фебрильною нейтропенією
Загалом 1111 пацієнтів зі стійкою гарячкою та нейтропенією були включені в клінічне дослідження та отримували або каспофунгін в дозі 50 мг на добу (після введення навантажувальної дози 70 мг у перший день), або ліпосомальний амфотерицин В у дозі 3,0 мг/кг/добу. Відповідні пацієнти отримували хіміотерапію з приводу злоякісних новоутворень або перенесли трансплантацію гемопоетичних стовбурових клітин і мали нейтропенію
(< 500 клітин/мм³ протягом 96 годин) і гарячку (> 38,0 °C), які не відповідали на ≥ 96 годин парентеральної антибактеріальної терапії.
Пацієнтів слід було лікувати до 72 годин після зникнення нейтропенії з максимальною тривалістю 28 днів. Однак пацієнтів, у яких виявлено підтверджену грибкову інфекцію, можна лікувати довше. Якщо лікарський засіб добре переносився, але гарячка у пацієнта зберігалася, а клінічний стан погіршувався після 5 днів терапії, дозу досліджуваного лікарського засобу можна було збільшити до 70 мг/добу каспофунгіну (13,3 % пацієнтів, які отримували лікування) або до 5,0 мг/кг/добу ліпосомального амфотерицину В (14,3 % пацієнтів, які отримували лікування). У первинний аналіз ефективності модифікованого наміру лікування (MITT) із загальною сприятливою відповіддю було включено 1095 пацієнтів; каспофунгін (33,9 %) був таким же ефективним, як ліпосомальний амфотерицин В (33,7 %) [% різниця 0,2 (95,2 % інтервал довіри – 5,6, 6,0)]. Загальна позитивна відповідь вимагає відповідності кожному з 5 критеріїв: (1) успішне лікування будь-якої вихідної грибкової інфекції (каспофунгін 51,9 % [14/27], ліпосомальний амфотерицин В 25,9 % [7/27]), (2) відсутність посилення перебігу грибкових інфекцій під час прийому досліджуваного лікарського засобу або протягом 7 днів після завершення лікування (каспофунгін 94,8 % [527/556], ліпосомальний амфотерицин В 95,5 % [515/539]), (3) тривалість відсутності грибкової інфекції протягом 7 днів після завершення дослідної терапії (каспофунгін 92,6 % [515/556], ліпосомальний амфотерицин В 89,2 % [481/539]), (4) відсутність припинення прийому досліджуваного лікарського засобу через пов’язану з лікарським засобом токсичність або недостатню ефективність (каспофунгін 89,7 % [499/556], ліпосомальний амфотерицин В
85,5 % [461/539]) і (5) зниження температури тіла в період нейтропенії (каспофунгін 41,2 % [229/556], ліпосомальний амфотерицин В 41,4 % [223/539]).
Рівень відповіді на каспофунгін та ліпосомальний амфотерицин В при базових інфекціях, спричинених видами Aspergillus, становив відповідно 41,7 % (5/12) та 8,3 % (1/12), а видами Candida становив 66,7 % (8/12) та 41,7 % ( 5/12). Пацієнти в групі каспофунгіну зазнали посилення перебігу інфекцій, спричинених такими незвичайними видами дріжджів та пліснявих грибків: види Trichosporon (1), види Fusarium (1), види Mucor (1) і види Rhizopus (1).
Педіатрична когорта пацієнтів
Безпеку та ефективність каспофунгіну оцінювали у педіатричних пацієнтів віком від 3 місяців до 17 років у двох проспективних багатоцентрових клінічних дослідженнях. Дизайн дослідження, діагностичні критерії та критерії оцінки ефективності були подібні до відповідних досліджень з участю дорослих пацієнтів (див. розділ «Фармакодинаміка»).
У першому рандомізованому подвійному сліпому дослідженні, що охоплювало 82 пацієнтів віком від 2 до 17 років, порівнювали каспофунгін (50 мг/м² внутрішньовенно один раз на добу після введення навантажувальної дози 70 мг/м² у перший день [не перевищуючи 70 мг на добу]) до ліпосомального амфотерицину В (3 мг/кг внутрішньовенно на добу) у режимі лікування 2:1 (56 -каспофунгін, 26 - ліпосомальний амфотерицин В) у якості емпіричної терапії у педіатричних пацієнтів зі стійкою гарячкою та нейтропенією. Загальні показники успішності в результатах MITT аналізу, скориговані за категоріями ризику, були такими: 46,6 % (26/56) для каспофунгіну та 32,2 % (8/25) для ліпосомального амфотерицину B.
У другому проспективному відкритому непорівняльному дослідженні оцінювалась безпека та ефективність каспофунгіну у 49 педіатричних пацієнтів (віком від 6 місяців до 17 років) з інвазивним кандидозом, кандидозом стравоходу та інвазивним аспергільозом (як терапію порятунку). Пацієнти отримували каспофунгін у дозі 50 мг/м² внутрішньовенно один раз на добу після введення навантажувальної дози 70 мг/м² у перший день (не перевищуючи 70 мг на добу). З цих пацієнтів 48 були включені в аналіз MITT, з яких 37 мали інвазивний кандидоз, 10 мали інвазивний аспергільоз і 1 пацієнт мав кандидоз стравоходу. У результаті проведенного аналізу MITT частота сприятливої відповіді за показаннями наприкінці терапії каспофунгіном була такою: 81 % (30/37) при інвазивному кандидозі, 50 % (5/10) при інвазивному аспергільозі та
100 % (1/1) при кандидозі стравоходу.
У подвійному сліпому рандомізованому (2:1) порівняльному дослідженні оцінювали безпеку, переносимість та ефективність каспофунгіну (2 мг/кг/добу внутрішньовенно, інфузія протягом
2 годин) порівняно з амфотерицину В дезоксихолатом (1 мг/кг/добу) у новонароджених та немовлят віком до 3 місяців з (культурально підтвердженим) інвазивним кандидозом. Через низьку кількість учасників дослідження було припинено достроково, і лише 51 пацієнт був рандомізований. Частка пацієнтів із відсутністю грибкової інфекції через 2 тижні після терапії в групі лікування каспофунгіном (71,0 %) була подібною до тієї, що спостерігалася в групі лікування дезоксихолатом амфотерицину В (68,8 %). На підставі цього дослідження не можна зробити жодних рекомендацій щодо дозування для новонароджених і немовлят.
Фармакокінетика
Розподіл
Каспофунгін активно зв’язується з білками крові. Незв’язана фракція каспофунгіну у плазмі крові варіює від 3,5 % у здорових добровольців до 7,6 % у пацієнтів із інвазивним кандидозом. Розподіл відіграє основну роль у фармакокінетиці каспофунгіну у плазмі крові та є етапом, що контролює швидкість фаз альфа- та бета-диспозиції. Максимальний розподіл у тканинах спостерігається через 1,5–2 дні після застосування лікарського засобу, коли 92 % прийнятої дози розподілено у тканинах. Вірогідно, лише мала фракція каспофунгіну, що проник у тканини, пізніше знову проникає у плазму крові у вигляді вихідної речовини. Тому виведення відбувається при відсутності рівноваги розподілу, і правильне визначення об’єму розподілу каспофунгіну на цей час отримати неможливо.
Біотрансформація
Каспофунгін зазнає спонтанного розпаду до сполуки з відкритим кільцем. Подальший метаболізм відбувається шляхом гідролізу білка та N-ацетилювання. Каспофунгін також підлягає спонтанному хімічному розпаду до пептидної сполуки з відкритим кільцем. Два проміжні продукти, що утворюються під час розпаду каспофунгіну до сполуки з відкритим кільцем, формують ковалентні продукти приєднання до білків плазми крові, призводячи до невисокого рівня та необоротного зв’язування з білками крові.
Дослідження іn vitro показують, що каспофунгін не є інгібітором ферментів 1A2, 2A6, 2C9, 2C19, 2D6 або 3A4 системи цитохрому P450. У клінічних дослідженнях каспофунгін не індукував або інгібував CYP3A4-метаболізм інших лікарських засобів. Каспофунгін не є субстратом
Р-глікопротеїну та є слабким субстратом ферментів цитохрому Р450.
Виведення
Каспофунгін повільно виводиться із плазми крові; кліренс становить 10–12 мл/хв. Після разової внутрішньовенної інфузії (тривалістю 1 годину) концентрації каспофунгіну у плазмі крові знижуються поліфазно. Коротка α-фаза настає одразу після проведення інфузії, після чого починається β-фаза з періодом напіввиведення від 9 до 11 годин. Також спостерігається додаткова γ-фаза з періодом напіввиведення 45 годин. Розподіл, порівняно з виведенням або біотрансформацією, є основним механізмом, що впливає на кліренс плазми крові.
У дослідженні з фармакокінетики із застосуванням разової дози з ізотопною міткою протягом 27 днів збирали плазму крові, сечу і фекалії. Приблизно 75 % від введеної радіоактивної дози визначалося протягом 27 днів: 41 % – у сечі та 34 % – у калі. Спостерігається незначне виведення або біотрансформація каспофунгіну протягом перших 30 годин після застосування лікарського засобу.
Виведення відбувається повільно, з кінцевим періодом напіввиведення радіоактивної дози від
12 до 15 днів. Незначна кількість каспофунгіну виводиться із сечею у незміненому вигляді (приблизно 1,4 % дози).
Каспофунгін виявляє помірну нелінійну фармакокінетику зі зростанням кумуляції при збільшенні дози, а також дозозалежність на час встановлення рівноважного стану при застосуванні повторних доз.
Окремі групи пацієнтів
Зростання експозиції каспофунгіну спостерігалися у дорослих пацієнтів із порушеннями функції печінки легкого ступеня тяжкості та порушеннями функції нирок, у жінок та у пацієнтів літнього віку. Як правило, зростання було помірним і не таким вираженим, щоб виникала необхідність у коригуванні дози лікарського засобу.
Для дорослих пацієнтів із порушенням функції печінки помірного ступеня тяжкості або для пацієнтів із більшою масою тіла може бути необхідним коригування дози лікарського засобу (див. нижче).
Маса тіла. При аналізі фармакокінетики дорослих пацієнтів із кандидозом було встановлено, що фармакокінетика каспофунгіну залежить від маси тіла. Концентрації лікарського засобу у плазмі крові зменшуються при збільшенні маси тіла. Розраховано, що середня експозиція у дорослих пацієнтів із масою тіла 80 кг на 23 % нижча, ніж у пацієнтів із масою тіла 60 кг (див. розділ «Спосіб застосування та дози»).
Порушення функції печінки. У дорослих пацієнтів із порушенням функції печінки легкого та помірного ступеня тяжкості значення показника площі під кривою концентрація – час (AUC) збільшується приблизно на 20 та 75 % відповідно. Немає клінічного досвіду застосування лікарського засобу дорослим пацієнтам із тяжкою формою порушення функції печінки та дітям із будь-якими порушеннями функції печінки. У дослідженні застосування багатократних доз відзначено, що при зниженні добової дози до 35 мг у дорослих пацієнтів із порушенням функції печінки помірного ступеня тяжкості значення AUC таке ж, як і в дорослих із нормальною функцією печінки при стандартному режимі дозування (див. розділ «Спосіб застосування та дози»).
Порушення функції нирок. У клінічному дослідженні при застосуванні разової дози 70 мг фармакокінетика каспофунгіну була подібною у дорослих добровольців із легкою формою порушення функції нирок (кліренс креатиніну від 50 до 80 мл/хв) та в учасників контрольної групи. При порушенні функції нирок помірного ступеня тяжкості (кліренс креатиніну від 31 до 49 мл/хв), прогресуючому порушенні (кліренс креатиніну від 5 до 30 мл/хв) та в термінальній стадії (кліренс креатиніну < 10 мл/хв та проведення діалізу) концентрації каспофунгіну у плазмі крові помірно зростали після застосування разової дози (AUC – у діапазоні від 30 до 49 %). Однак у пацієнтів з інвазивним кандидозом, кандидозом стравоходу або інвазивним аспергільозом, яким вводили багатократно каспофунгін у дозах 50 мг на добу, не спостерігали значущого впливу на концентрації каспофунгіну при легких та прогресуючих порушеннях функції нирок. Немає необхідності у коригуванні дози пацієнтам із порушеннями функції нирок. Каспофунгін не виводиться при проведенні діалізу, тому немає потреби у введенні додаткових доз після гемодіалізу.
Стать. Концентрація каспофунгіну у плазмі крові у жінок була в середньому на 17–38 % вищою, ніж у чоловіків.
Літній вік. Спостерігалося помірне зростання значень AUC (на 28 %) та C24h (на 32 %) у чоловіків літнього віку порівняно з молодшими чоловіками. У пацієнтів при емпіричному лікуванні та у хворих на інвазивний кандидоз спостерігали подібний помірно виражений вплив, що залежав від віку пацієнтів.
Раса. Дані фармакокінетики у пацієнтів вказують на відсутність клінічно значущих відмінностей фармакокінетичних показників у представників європеоїдної раси, негроїдної раси, латиноамериканців та метисів.
Діти. У дітей віком 12–17 років, які отримували каспофунгін у дозі 50 мг/м2 на добу (максимальна доза – 70 мг на добу), значення AUC0-24 у плазмі крові були, як правило, зіставними зі значеннями, що спостерігаються у дорослих при застосуванні каспофунгіну в дозі 50 мг на добу. Всі діти віком 12–17 років отримували лікарський засіб у дозах понад 50 мг на добу, а 6 із 8 пацієнтів отримували максимальну дозу – 70 мг на добу. Концентрації каспофунгіну у плазмі крові дітей віком 12–17 років були меншими порівняно з дорослими, яким вводили лікарський засіб у дозі 70 мг на добу (доза, яку найчастіше призначають дітям віком 12–17 років).
У дітей (2–11 років), які отримували каспофунгін у дозі 50 мг/м2 на добу (максимальна доза – 70 мг на добу), значення AUC0-24 у плазмі крові після багатократного застосування лікарського засобу були зіставними зі значеннями, що спостерігаються у дорослих при застосуванні каспофунгіну в дозі 50 мг на добу.
У дітей молодшого віку (віком 12–23 місяці), які отримували каспофунгін у дозі 50 мг/м2 на добу (максимальна доза – 70 мг на добу), значення AUC0-24 у плазмі крові після багатократного застосування лікарського засобу були зіставними зі значеннями, що спостерігаються у дорослих при застосуванні каспофунгіну в дозі 50 мг на добу та у дітей старшого віку (2–11 років), які отримували каспофунгін у дозі 50 мг/м2 на добу.
Загалом наявні дані щодо фармакокінетики, ефективності та безпеки застосування каспофунгіну пацієнтам віком від 3 до 10 місяців обмежені. Фармакокінетичні дані однієї 10-місячної дитини, яка отримувала добову дозу 50 мг/м2, вказують на те, що AUC0-24 знаходиться у межах того ж діапазону, що й у дітей старшого віку та дорослих при застосуванні доз 50 мг/м2 та 50 мг відповідно, тоді як в однієї 6-місячної дитини, яка отримувала дозу 50 мг/м2, AUC0-24 була дещо вищою.
У новонароджених та немовлят (віком < 3 місяців), яким призначали каспофунгін у дозі 25 мг/м2 на добу (середня добова доза – 2,1 мг/кг), максимальна (C1 год) та мінімальна (C24 год) концентрації каспофунгіну після застосування багатократних доз були зіставними з концентраціями, що визначалися у дорослих при застосуванні каспофунгіну в дозі 50 мг на добу. У таких дітей у перший день застосування каспофунгіну значення C1 год було подібним до такого у дорослих, а значення C24 год – помірно вищим (36 %). Однак спостерігалася мінливість значень як C1 год (на
4-й день геометричне значення – 11,73 мкг/мл, діапазон – від 2,63 до 22,05 мкг/мл), так і C24 год (на 4-й день геометричне значення – 3,55 мкг/мл, діапазон – від 0,13 до 7,17 мкг/мл). Показник AUC0-24 у цьому дослідженні не визначали з причини нечастого забору зразків. Слід зазначити, що ефективність і безпека каспофунгіну не були належним чином вивчені у проспективних клінічних дослідженнях з участю новонароджених і немовлят віком до 3 місяців.
Клінічні характеристики
Показання
· Лікування інвазивного кандидозу у дорослих та дітей.
· Лікування інвазивного аспергільозу у дорослих та дітей при рефрактерності або непереносимості до амфотерицину В, ліпідних форм амфотерицину В та/або ітраконазолу. Рефрактерність визначена як прогресування інфекції або недостатнє покращення стану після як мінімум 7 днів проведення ефективної протигрибкової терапії у терапевтичних дозах.
· Емпірична терапія при підозрі на грибкові інфекції (Candida або Aspergillus) у дорослих та дітей з фебрильною нейтропенією.
Протипоказання
Підвищена чутливість до діючої речовини або до будь-якої допоміжної речовини лікарського засобу (див. розділ «Склад»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Дослідження in vitro свідчать, що каспофунгін не є інгібітором будь-якого ферменту системи цитохрому P450 (CYP). У клінічних дослідженнях каспофунгін не індукував CYP3A4-метаболізм інших речовин. Каспофунгін не є субстратом для ферментів Pглікопротеїну і є поганим субстратом для ферментів цитохрому P450. Однак фармакологічні та клінічні дослідження показали взаємодію каспофунгіну з іншими лікарськими засобами (див. нижче).
У двох клінічних дослідженнях з участю здорових добровольців циклоспорин А (1 доза 4 мг/кг або 2 дози 3 мг/кг через 12 годин) підвищував показник площі під кривою концентрація – час (AUC) каспофунгіну приблизно на 35 %, що, можливо, пов’язано зі зниженням поглинання каспофунгіну печінкою. Каспофунгін не підвищував рівні циклоспорину у плазмі крові. Спостерігалося тимчасове підвищення активності печінкових трансаміназ (АЛТ та АСТ) (в 3 або менше разів порівняно з верхньою межею норми) при одночасному застосуванні каспофунгіну та циклоспорину, що зникало після відміни лікарських засобів.
У ретроспективному дослідженні 40 пацієнтів отримували каспофунгін та циклоспорин у післяреєстраційний період протягом 1–290 днів (середня тривалість – 17,5 дня); серйозних побічних реакцій з боку печінки не спостерігали (див. розділ «Особливості застосування»). Слід контролювати показники активності ферментів печінки, якщо каспофунгін та циклоспорин застосовувати одночасно.
Каспофунгін зменшував на 26 % мінімальну концентрацію такролімусу в крові у здорових добровольців. Пацієнтам, які отримують ці два лікарські засоби, обов’язково проводять стандартний моніторинг концентрацій у крові та відповідну корекцію дози такролімусу.
У клінічних дослідженнях з участю здорових добровольців фармакокінетика каспофунгіну суттєво не змінювалася при застосуванні ітраконазолу, амфотерицину В, мікофенолату, нелфінавіру або такролімусу. Каспофунгін не впливав на фармакокінетику амфотерицину В, ітраконазолу, рифампіцину або мікофенолату мофетилу. Хоча даних щодо безпеки недостатньо, немає спеціальних застережень щодо одночасного застосування каспофунгіну та амфотерицину В, ітраконазолу, нелфінавіру або мікофенолату мофетилу.
Рифампіцин спричиняв збільшення AUC на 60 % та збільшення мінімальної концентрації каспофунгіну на 170 % в перший день супутнього введення, коли обидва лікарські засоби застосовували здоровим дорослим добровольцям. Мінімальні рівні каспофунгіну поступово зменшувалися після повторного введення. Після 2 тижнів введення рифампіцин мав обмежений вплив на AUC, але мінімальні концентрації були нижчими на 30 %, ніж у дорослих пацієнтів, які приймали тільки каспофунгін. Механізм взаємодії пов’язаний, можливо, з початковою інгібіцією та наступною індукцією транспортування білків. Подібний ефект може спостерігатися з іншими лікарськими засобами, що індукують метаболізм ферментів.
Обмежені дані досліджень фармакокінетики вказують на те, що одночасне застосування каспофунгіну та індукторів ефавіренцу, невірапіну, рифампіцину, дексаметазону, фенітоїну або карбамазепіну може призводити до зменшення AUC каспофунгіну. При одночасному призначенні індукторів метаболізму ферментів слід розглянути питання про збільшення добової дози лікарського засобу Каспофунгін Асіно до 70 мг після призначення навантажувальної дози 70 мг для дорослих пацієнтів (див. розділ «Спосіб застосування та дози»).
У всіх згаданих вище дослідженнях взаємодій із іншими лікарськими засобами, проведених з участю дорослих пацієнтів, каспофунгін застосовували у дозах 50 або 70 мг на добу. Взаємодії каспофунгіну в більших дозах та з іншими лікарськими засобами не вивчали.
У дітей результати регресійного аналізу даних фармакокінетики вказують на те, що одночасне призначення дексаметазону та каспофунгіну може призводити до клінічно значущого зменшення мінімальних концентрацій каспофунгіну. Ці дані можуть свідчити про те, що при застосуванні індукторів у дітей спостерігатимуться такі ж зменшення мінімальних концентрацій, як і в дорослих. При одночасному призначенні дітям (у віці від 12 місяців до 17 років) лікарського засобу Каспофунгін Асіно та таких індукторів кліренсу препарату, як рифампіцин, ефавіренц, невірапін, фенітоїн, дексаметазон або карбамазепін, слід розглянути питання про збільшення дози лікарського засобу Каспофунгін Асіно до 70 мг/м2 на добу (не перевищуючи добову дозу 70 мг).
Особливості застосування
Під час введення каспофунгіну повідомлялося про випадки анафілаксії. При її появі введення каспофунгіну слід припинити та призначити відповідне лікування. Повідомлялося про побічні реакції, медіатором яких, можливо, є гістамін, такі як висипання, набряк обличчя, ангіоневротичний набряк, свербіж, відчуття тепла або бронхоспазм, такі реакції можуть вимагати припинення лікування та/або призначення відповідної терапії.
Обмежені дані вказують на те, що каспофунгін неефективний проти дріжджових грибів, що не належать до роду Candida, та пліснявих грибів, що не належать до роду Aspergillus. Ефективність каспофунгіну проти цих грибкових патогенів не доведена.
Одночасне застосування каспофунгіну та циклоспорину оцінювали з участю здорових дорослих добровольців та дорослих пацієнтів. У деяких дорослих здорових добровольців, які отримували по дві дози по 3 мг/кг циклоспорину і каспофунгіну, спостерігали транзиторне підвищення аланінамінотрансферази (АЛТ) і аспартатамінотрансферази (АСТ) до рівня, який перевищував верхню межу норми (ВМН) у 3 або менше разів. Таке підвищення зникало після припинення прийому ліків. У ретроспективному дослідженні 40 пацієнтів отримували каспофунгін та циклоспорин у післяреєстраційний період протягом 1–290 днів (середня тривалість – 17,5 дня), серйозних побічних реакцій з боку печінки не спостерігали. Ці дані вказують на те, що каспофунгін можна вводити пацієнтам, які приймають циклоспорин, якщо потенційна користь переважає над потенційним ризиком. Слід контролювати показники активності ферментів печінки, якщо каспофунгін та циклоспорин застосовувати одночасно.
У дорослих пацієнтів із порушенням функції печінки від легкого до помірного ступеня тяжкості показник AUC збільшувався приблизно на 20 % та 75 % відповідно. Рекомендовано зменшувати добову дозу до 35 мг при призначенні лікарського засобу дорослим пацієнтам із помірними порушеннями функції печінки. Немає клінічного досвіду застосування каспофунгіну пацієнтам із тяжкими порушеннями функції печінки та дітям із будь-якими порушеннями функції печінки. Очікується, що у таких пацієнтів експозиція лікарського засобу буде вищою, ніж при помірному ступені тяжкості порушення функції печінки, тому Каспофунгін Асіно слід призначати з обережністю цим пацієнтам (див. розділи «Фармакокінетика» і «Спосіб застосування та дози»).
У здорових добровольців, а також у дорослих пацієнтів і дітей, які приймали каспофунгін, спостерігалися відхилення у лабораторних показниках функції печінки. У деяких дорослих пацієнтів та дітей із тяжким основним захворюванням, які паралельно з каспофунгіном отримували декілька супутніх лікарських засобів, було зафіксовано окремі випадки клінічно значущої дисфункції печінки, гепатит та печінкову недостатність. Однак взаємозв’язку з прийомом каспофунгіну виявлено не було. З метою своєчасного виявлення ознак погіршення функції печінки та оцінки співвідношення ризик – користь подовження терапії лікарським засобом Каспофунгін Асіно необхідно спостерігати за пацієнтами, у яких під час лікування лікарським засобом Каспофунгін Асіно виникають відхилення в лабораторних показниках функції печінки.
До складу лікарського засобу входить сахароза. Пацієнтам із такими рідкісними спадковими захворюваннями як непереносимість фруктози або недостатність сахарази-ізомальтази не слід застосовувати цей лікарський засіб.
Повідомляли про випадки синдрому Стівенса–Джонсона та токсичного епідермального некролізу у постмаркетинговий період.
Каспофунгін слід призначати з обережністю пацієнтам з алергічними реакціями з боку шкіри в анамнезі (див. розділ «Побічні реакції»).
Цей лікарський засіб містить менше 1 ммоль (23 мг) / дозу натрію, тобто практично вільний від натрію.
Застосування у період вагітності або годування груддю
Вагітність
Клінічні дані про застосування лікарського засобу у період вагітності відсутні або обмежені. Каспофунгін не слід призначати протягом періоду вагітності, якщо немає безумовної необхідності. Немає відповідних даних про застосування каспофунгіну вагітним жінкам. Дослідження на тваринах показали токсичність для плода.
У вагітних самок щурів, яким вводили токсичну дозу 5 мг/кг каспофунгіну, лікарський засіб спричиняв зменшення маси тіла плода та збільшення частоти неповної осифікації хребців, груднини та черепа, що супроводжувалося такими побічними реакціями у вагітних самок як викид гістаміну. Також у плодів спостерігалося збільшення частоти порушення розвитку шийних ребер. У дослідженнях на тваринах показано, що каспофунгін проникає крізь плацентарний бар’єр.
Годування груддю
Невідомо, чи проникає лікарський засіб у грудне молоко у жінок.
Наявні фармакодинамічні / токсикологічні дані на тваринах свідчать про екскрецію каспофунгіну у молоко лактуючих щурів.
Тому жінкам, які застосовують Каспофунгін Асіно, не можна годувати груддю.
Фертильність
У дослідженнях, проведених на самцях і самках щурів, яким вводили токсичну дозу 5 мг/кг, каспофунгін не впливав на фертильність. Клінічні дані щодо впливу каспофунгіну на фертильність відсутні.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Дослідження впливу лікарського засобу на здатність керувати автотранспортом та іншими механізмами не проводилися.
Спосіб застосування та дози
Каспофунгін призначає лікар, який має досвід лікування інвазивних грибкових інфекцій.
Дозування
Дорослі пацієнти
У перший день слід ввести разову навантажувальну дозу 70 мг з подальшим щоденним введенням по 50 мг на добу.
Для пацієнтів із масою тіла понад 80 кг після введення початкової навантажувальної дози 70 мг рекомендовано застосовувати каспофунгін у дозі 70 мг на добу (див. розділ «Фармакокінетика»).
Немає потреби в корекції дози залежно від статі або раси пацієнта (див. розділ «Фармакокінетика»).
Діти (від 12 місяців до 17 років)
Для дітей віком від 12 місяців до 17 років дозування залежить від площі поверхні тіла пацієнта. Для всіх показань: у перший день разова навантажувальна доза становить 70 мг/м2 (не перевищувати фактичну дозу 70 мг) з подальшим введенням лікарського засобу в дозі 50 мг/м2 на добу (не перевищувати фактичну дозу 70 мг). Якщо доза 50 мг/м2 на добу переноситься добре, але не спостерігається достатньої клінічної відповіді, то добову дозу можна збільшити до 70 мг/м2 (не перевищувати фактичну добову дозу 70 мг).
Ефективність та безпека застосування каспофунгіну не були достатньо вивчені у клінічних дослідженнях з участю новонароджених та немовлят віком до 12 місяців. Лікарський засіб з обережністю слід призначати цій групі пацієнтів. Обмежені дані вказують на можливість застосування каспофунгіну для лікування новонароджених та немовлят віком до 3 місяців у дозі 25 мг/м2 на добу та для лікування дітей віком від 3 до 11 місяців у дозі 50 мг/м2 на добу (див. розділ «Фармакокінетика»).
Тривалість лікування
Тривалість емпіричної терапії залежить від клінічної відповіді пацієнта. Лікування слід продовжувати протягом періоду до 72 годин після зникнення нейтропенії (абсолютна кількість нейтрофілів ≥ 500). Пацієнтів із виявленою грибковою інфекцією слід лікувати мінімум 14 днів, і після зникнення нейтропенії та клінічних симптомів лікування слід продовжувати принаймні 7 днів.
Тривалість лікування інвазивного кандидозу визначається клінічною та мікробіологічною відповіддю пацієнта. Після того як зникли симптоми інвазивного кандидозу та отримано негативний результат аналізу культури, можна розглянути можливість застосування пероральної протигрибкової терапії. Загалом протигрибкову терапію слід продовжувати принаймні 14 днів після останнього позитивного результату аналізу культури.
Тривалість лікування інвазивного аспергільозу визначається у кожному окремому випадку та повинна базуватись на оцінці тяжкості основного захворювання пацієнта, відновлення після імуносупресії та клінічної відповіді. Загалом терапію слід продовжувати принаймні 7 днів після зникнення симптомів.
Інформація про безпеку застосування протягом періоду понад 4 тижні є обмеженою. Однак наявні дані вказують на те, що каспофунгін переноситься добре при триваліших курсах терапії (тривалістю до 162 днів у дорослих пацієнтів та до 87 днів у дітей).
Особливі групи пацієнтів
Пацієнти літнього віку
У пацієнтів віком від 65 років спостерігається збільшення показника площі під кривою концентрація – час (AUC) приблизно на 30 %. Однак немає потреби у коригуванні систематичного дозування. Досвід застосування лікарського засобу пацієнтам віком від 65 років є обмеженим (див. розділ «Фармакокінетика»).
Пацієнти з порушеннями функцій нирок
Немає необхідності у коригуванні дози лікарського засобу (див. розділ «Фармакокінетика»).
Пацієнти з порушеннями функцій печінки
Для дорослих пацієнтів із легкими порушеннями функцій печінки (5–6 балів за шкалою Чайлда–П’ю) немає потреби в коригуванні дози лікарського засобу. Дорослим пацієнтам із помірними порушеннями функцій печінки (7–9 балів за шкалою Чайлда–П’ю) рекомендовано призначати лікарський засіб у дозі 35 мг на добу, беручи до уваги дані фармакокінетики. У перший день слід застосовувати початкову навантажувальну дозу 70 мг. Немає клінічного досвіду застосування лікарського засобу дорослим пацієнтам із тяжкими порушеннями функцій печінки (понад 9 балів за шкалою Чайлда–П’ю) та в дітей із будь-якими порушеннями функцій печінки (див. розділ «Особливості застосування»).
Одночасне застосування з індукторами ферментів метаболізму
При одночасному призначенні дорослим лікарського засобу Каспофунгін Асіно та певних індукторів ферментів метаболізму (ефавіренц, невірапін, рифампіцин, дексаметазон, фенітоїн або карбамазепін) добову дозу лікарського засобу Каспофунгін Асіно слід збільшити до 70 мг (після введення навантажувальної дози 70 мг) (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
При одночасному призначенні дітям віком 12 місяців – 17 років лікарського засобу Каспофунгін Асіно та вищевказаних індукторів ферментів метаболізму слід розглянути питання про збільшення добової дози лікарського засобу Каспофунгін Асіно до 70 мг/м2 (не перевищувати фактичну добову дозу 70 мг) (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Спосіб введення
Після відновлення та розведення розчин слід вводити шляхом повільної внутрішньовенної інфузії приблизно протягом 1 години. Каспофунгін Асіно слід застосовувати у вигляді одноразової щоденної інфузії.
Відновлення лікарського засобу Каспофунгін Асіно
Етап 1-й. Відновлення стандартних флаконів
Для відновлення лікарського засобу охолоджений флакон дістати з холодильника та залишити до досягнення кімнатної температури, потім в асептичних умовах додати 10,5 мл води для ін’єкцій. Концентрація відновленого розчину становитиме 5,2 мг/мл (у флаконах по 50 мг).
Білий або майже білого кольору ліофілізований порошок розчиниться повністю. Обережно перемішати до отримання прозорого розчину. Оглянути відновлений розчин, щоб упевнитися у відсутності механічних часток або зміни кольору. Цей відновлений розчин можна зберігати до 24 годин при температурі ≤ 25 °C.
Етап 2-й. Додавання відновленого лікарського засобу Каспофунгін Асіно до розчину для інфузій
Розчинники для отримання кінцевого розчину для інфузій: 0,9 % розчин натрію хлориду для ін’єкцій або розчин Рінгера з лактатом. Стандартний інфузійний розчин для введення пацієнту готується в асептичних умовах шляхом додавання відповідної кількості відновленого концентрату (як показано у таблиці 1) у мішок або пляшку з розчинником для інфузій ємністю 250 мл. Для добових доз 50 мг або 35 мг, якщо є терапевтична потреба, об’єм інфузії зменшують до 100 мл.
Візуально слід перевірити інфузійний розчин на наявність частинок або зміну кольору. Не застосовувати розчин, якщо він каламутний або містить осад.
З мікробіологічної точки зору розчин для інфузії слід використовувати безпосередньо після приготування. Якщо він не використовується одразу, тривалість та умови зберігання, які не повинні перевищувати 24 годин при температурі від 2 до 8 °C, слід контролювати.
Таблиця 1
Приготування розчину для інфузії для застосування дорослим
Примітка: лікарський засіб Каспофунгін Асіно не представлений у флаконах по 70 мг.
|
Доза* |
Об’єм відновленого лікарського засобу Каспофунгін Асіно для перенесення у мішок або пляшку з розчинником для інфузій |
Стандартний лікарський засіб (відновлений Каспофунгін Асіно додається до 250 мл розчинника) Кінцева концентрація |
Зменшений об’єм інфузії (відновлений Каспофунгін Асіно додається до 100 мл розчинника) Кінцева концентрація |
|
50 мг |
10 мл |
0,20 мг/мл |
− |
|
50 мг при зменшеному об’ємі |
10 мл |
− |
0,47 мг/мл |
|
35 мг при помірних порушеннях функції печінки (з одного флакона по 50 мг) |
7 мл |
0,14 мг/мл |
− |
|
35 мг при помірних порушеннях функції печінки (з одного флакона по 50 мг) при зменшеному об’ємі |
7 мл |
− |
0,34 мг/мл |
|
70 мг (з двох флаконів по 50 мг)** |
14 мл |
0,28 мг/мл |
Не рекомендується |
* Вміст усіх флаконів слід відновлювати у 10,5 мл.
**Дозу 70 мг можна приготувати з двох флаконів по 50 мг.
Приготування розчину для інфузії для застосування дітям
Визначення площі поверхні тіла
|
Площа поверхні тіла (м2) = 3 600 |
Приготування розчину для інфузій для введення у дозах 70 мг/м2 та 50 мг/м2 дітям віком від 3 місяців (використовуючи флакони по 50 мг).
1. Вирахувати фактичну навантажувальну дозу / денну підтримувальну дозу для дитини, використовуючи показник площі поверхні тіла:
Для дози 70 мг/м2:
площа поверхні тіла (м2) × 70 мг/м2 = навантажувальна доза.
Для дози 50 мг/м2:
площа поверхні тіла (м2) × 50 мг/м2 = денна підтримувальна доза.
Максимальна навантажувальна доза в перший день не має перевищувати 70 мг незалежно від того, якою є вирахувана доза.
Денна підтримувальна доза не має перевищувати 70 мг незалежно від того, якою є вирахувана доза.
2. Охолоджений флакон лікарського засобу Каспофунгін Асіно дістати з холодильника та залишити до досягнення кімнатної температури.
3. В асептичних умовах додати 10,5 мл води для ін’єкцій. Ліофілізована маса білого або майже білого кольору розчиниться повністю. Обережно перемішати до отримання прозорого розчину. Цей відновлений розчин можна зберігати протягом до 24 годин при температурі ≤ 25 ºС. Оглянути відновлений розчин, щоб упевнитися у відсутності механічних часток або зміни кольору. Не застосовувати розчин, якщо він каламутний або містить осад. Остаточна концентрація відновленого розчину становитиме 5,2 мг/мл (у флаконах по 50 мг).
4. Із флакона з відновленим розчином набрати об’єм, що відповідає вирахуваній навантажувальній дозі / денній підтримувальній дозі (див. пункт 1 вище). В асептичних умовах перенести цей об’єм* у мішок або пляшку для інфузій, що містить 250 мл 0,9 %, 0,45 % або 0,225 % розчину натрію хлориду для ін’єкцій, або розчину Рінгера з лактатом для ін’єкцій. Також цей об’єм* відновленого лікарського засобу Каспофунгін Асіно може бути доданий до зменшеного об’єму 0,9 %, 0,45 % або 0,225 % розчину натрію хлориду для ін’єкцій або розчину Рінгера з лактатом для ін’єкцій. Не перевищувати остаточну концентрацію розчину – 0,5 мг/мл. З мікробіологічної точки зору, розчин для інфузії слід використовувати безпосередньо після приготування. Якщо він не використовується одразу, тривалість та умови зберігання, які не повинні перевищувати 24 годин при температурі від 2 до 8 °C, слід контролювати.
* При заборі з флакона 10 мл відновленого розчину забезпечується повна заявлена доза каспофунгіну (50 мг).
Діти
Лікарський засіб можна застосовувати дітям (див. розділ «Спосіб застосування та дози»).
Ефективність та безпека застосування лікарського засобу Каспофунгін Асіно дітям віком до 12 місяців вивчені недостатньо.
Передозування
Повідомлялося про випадкове призначення каспофунгіну в дозі 400 мг за 1 добу, що не призвело до виникнення клінічно значущих побічних реакцій.
Каспофунгін не виводиться при діалізі.
Побічні реакції
Повідомлялося про реакції гіперчутливості (анафілаксію та побічні реакції, медіатором яких, можливо, виступає гістамін).
У пацієнтів з інвазивним аспергільозом також повідомляли про набряк легень, респіраторний дистрес-синдром у дорослих та інфільтрати при рентгенографічному обстеженні.
Дорослі
У клінічних дослідженнях 1865 дорослих отримували одноразову або багаторазову дозу каспофунгіну: 564 пацієнти з фебрильною нейтропенією (дослідження емпіричної терапії), 382 пацієнти з інвазивним кандидозом, 228 пацієнтів із інвазивним аспергільозом, 297 пацієнтів з локалізованою інфекцією, спричиненою Candida, та ще 394 особи були зареєстровані у дослідженнях фази І. У дослідженні емпіричної терапії пацієнти отримували хіміотерапію з причини злоякісного новоутворення або їм було проведено трансплантацію гемопоетичних стовбурових клітин (включаючи 39 алогенних трансплантатів). У дослідженнях з участю пацієнтів з підтвердженою інфекцією, спричиненою Candida, у більшості пацієнтів з інвазивним кандидозом було серйозне основне захворювання (наприклад гематологічні або інші форми злоякісних процесів, нещодавно проведене оперативне втручання, ВІЛ), що вимагали застосування кількох супутніх лікарських засобів. У непорівняльному дослідженні Aspergillus пацієнти часто мали серйозні медичні стани (такі як трансплантація кісткового мозку або периферичних стовбурових клітин, гематологічні онкологічні захворювання, солідні пухлини або трансплантований орган), що вимагали застосування комбінованого лікування.
Найчастіше повідомлялося про флебіт як побічну реакцію, пов’язану зі способом введення лікарського засобу, у всіх групах пацієнтів. Інші місцеві реакції включали: еритему, біль / чутливість, свербіж, виділення секрету та відчуття печіння.
Клінічні та лабораторні зміни у всіх дорослих пацієнтів (загалом 1780), які отримували каспофунгін, були, як правило, легкої форми та рідко призводили до відміни лікарського засобу.
Побічні реакції представлено у таблиці 2
Таблиця 2
Побічні реакції, які було визначено під час клінічних досліджень та/або постмаркетингового застосування
|
Клас системи органів |
Часто (від ≥ 1/100 до < 1/10) |
Нечасто (від ≥ 1/1 000 до < 1/100) |
Невідомо (не можна оцінити на підставі наявних даних) |
|
З боку системи крові та лімфатичної системи |
зниження рівня гемоглобіну, зменшення гематокриту, зменшення кількості лейкоцитів |
анемія, тромбоцитопенія, коагулопатія, лейкопенія, збільшення кількості еозинофілів, зменшення кількості тромбоцитів, збільшення кількості тромбоцитів, зменшення кількості лімфоцитів, збільшення кількості лейкоцитів, зменшення кількості нейтрофілів |
|
|
З боку метаболізму та обміну речовин |
гіпокаліємія |
затримка рідини, гіпомагніємія, анорексія, електролітний дисбаланс, гіперглікемія, гіпокальціємія, метаболічний ацидоз |
|
|
З боку психіки |
тривожність, дезорієнтація, безсоння |
||
|
З боку нервової системи |
головний біль |
запаморочення, дисгевзія, парестезії, сонливість, тремор, гіпестезія |
|
|
З боку органів зору |
жовтушність склер, нечіткість зору, набряк повік, посилене сльозовиділення |
||
|
З боку серця |
пальпітація, тахікардія, аритмія, фібриляція передсердь, застійна серцева недостатність |
||
|
З боку судинної системи |
флебіт |
тромбофлебіт, відчуття припливів крові до обличчя та верхньої половині тіла, відчуття припливів жару, артеріальна гіпертензія, артеріальна гіпотензія |
|
|
З боку респіраторної системи, органів грудної клітки та середостіння |
задишка |
закладеність носа, фаринголарингеальний біль, тахіпное, бронхоспазм, кашель, нічна пароксизмальна задишка, гіпоксія, хрипи, свистяче дихання |
|
|
З боку ШКТ |
нудота, діарея, блювання |
абдомінальний біль, біль у верхній ділянці живота, сухість у роті, диспепсія, відчуття дискомфорту у шлунку, здуття живота, асцит, запор, дисфагія, метеоризм |
|
|
З боку гепатобілі-арної системи |
підвищення показників функції печінки –аланінаміно-трансферази (АЛТ), аспартатаміно-трансферази (АСТ), лужної фосфатази крові, зв’язаного білірубіну, білірубіну крові |
холестаз, гепатомегалія, гіпербілірубінемія, жовтяниця, порушення функції печінки, гепатотоксичність, захворювання печінки, підвищення рівня гамма-глутамілтрансферази |
|
|
З боку шкіри та підшкірної клітковини |
висипання, свербіж, еритема, гіпергідроз |
мультиформна еритема, макулярне висипання, макулопапульозне висипання, сверблячий висип, кропив’янка, алергійний дерматит, генералізований свербіж, еритематозне висипання, генералізований висип, кореподібне висипання, ураження шкіри |
токсичний епідермальний некроліз та синдром Стівенса–Джонсона (див. розділ «Особливості застосування») |
|
З боку кістково-м’язової системи та сполучної тканини |
артралгія |
біль у спині, біль у кінцівках, біль у кістках, м’язова слабкість, міалгія |
|
|
З боку нирок та сечовивідних шляхів |
ниркова недостатність, гостра ниркова недостатність |
||
|
Загальний стан та порушення, пов’язані зі способом застосування лікарського засобу |
підвищення температури тіла, озноб, свербіж у місці інфузії |
біль, біль у місці введення катетера, слабкість, відчуття холоду, відчуття жару, еритема у місці інфузії, індурація у місці інфузії, біль у місці інфузії, набряк у місці інфузії, флебіт у місці введення, периферичні набряки, болючість, дискомфорт у грудній клітці, біль у грудній клітці, набряк обличчя, відчуття зміни температури тіла, індурація, крововилив у місці інфузії, подразнення у місці інфузії, флебіт у місці інфузії, висипання у місці інфузії, кропив’янка у місці інфузії, еритема у місці введення, набряк у місці введення, біль у місці введення, припухлість у місці введення, нездужання, набряки |
|
|
Обстеження |
зниження рівня калію у крові, зниження рівня альбуміну в крові |
підвищення рівня креатиніну у крові, позитивний аналіз сечі на наявність еритроцитів, зниження рівня загального білка, білок у сечі, подовження протромбінового часу, скорочення протромбінового часу, зменшення рівня натрію у крові, збільшення рівня натрію у крові, зменшення рівня кальцію у крові, збільшення рівня кальцію у крові, зменшення рівня хлоридів в крові, збільшення рівня глюкози в крові, зменшення рівня магнію у крові, зменшення рівня фосфору в крові, збільшення рівня фосфору в крові, збільшення рівня сечовини крові, подовження активованого часткового тромбопластинового часу, зменшення рівня бікарбонату крові, збільшення рівня хлоридів в крові, збільшення рівня калію у крові, підвищення артеріального тиску, зменшення рівня сечової кислоти у крові, кров у сечі, патологічні дихальні шуми, зменшення рівня вуглекислого газу, збільшення рівня імуносупресорних лікарських засобів у крові, збільшення міжнародного нормалізованого співвідношення, циліндри у сечі, позитивний аналіз сечі на лейкоцити, підвищення рН сечі |
Застосування каспофунгіну в дозі 150 мг на добу (протягом періоду до 51 дня) оцінювали у 100 дорослих пацієнтів (див. розділ «Фармакодинаміка»). У цьому дослідженні порівнювали застосування каспофунгіну в дозі 50 мг на добу (після введення навантажувальної дози 70 мг у перший день) та 150 мг на добу при лікуванні інвазивного кандидозу. У цій групі пацієнтів безпека застосування каспофунгіну у вищій дозі була в цілому подібною до безпеки при застосуванні лікарського засобу в дозі 50 мг на добу. У двох групах лікування кількість пацієнтів із серйозними побічними реакціями, пов’язаними із застосуванням каспофунгіну, або реакціями, що призводили до відміни каспофунгіну, була подібною.
Діти
Дані 5 завершених клінічних досліджень, в яких брала участь 171 дитина, свідчать, що загальна частота появи клінічних побічних реакцій (26,3 %; 95 % інтервал довіри – 19,9, 33,6) не є більшою, ніж така у дорослих пацієнтів, які приймали каспофунгін (43,1 %; 95 % інтервал довіри – 40,0, 46,2). Однак діти, ймовірно, мають інший профіль побічних реакцій, ніж дорослі пацієнти. Найчастішими пов’язаними з прийомом лікарського засобу клінічними побічними реакціями, про що повідомлялося у дітей, які лікувалися каспофунгіном, були: підвищена температура тіла (11,7 %), висипання (4,7 %) та головний біль (2,9 %).
Побічні реакції представлено у таблиці 3
Таблиця 3
|
Клас системи органів |
Дуже часто (≥ 1/10) |
Часто (від ≥ 1/100 до < 1/10) |
|
З боку системи крові та лімфатичної системи |
збільшення кількості еозинофілів |
|
|
З боку нервової системи |
головний біль |
|
|
З боку серця |
тахікардія |
|
|
З боку судинної системи |
Припливи крові до обличчя, артеріальна гіпотензія |
|
|
З боку гепатобіліарної системи |
підвищення рівнів ферментів печінки (аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ) |
|
|
З боку шкіри та підшкірної клітковини |
висипання, свербіж |
|
|
Загальний стан та порушення, пов’язані зі способом застосування лікарського засобу |
гарячка |
озноб, біль у місці введення катетера |
|
Обстеження |
зниження рівня калію, гіпомагніємія, підвищення рівня глюкози, зниження рівня фосфору, підвищення рівня фосфору |
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь / ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності. 2 роки.
Час зберігання лікарського засобу після відновлення концентрату для розчину для інфузій та розведеного розчину для інфузій не підсумовується.
Відновлений концентрат для розчину для інфузій
Хімічна та фізична стабільність лікарського засобу після відновлення підтверджена протягом
24 годин при температурі ≤ 25 °C. З мікробіологічної точки зору лікарський засіб слід використовувати негайно. Якщо його не використати одразу, час та умови зберігання після відновлення залежать від відповідальності користувача, але зазвичай не перевищують 24 годин при температурі від 2 до 8 °C, якщо тільки відновлення не було проведено в контрольованих та валідованих асептичних умовах.
Не заморожувати відновлений концентрат для розчину для інфузій.
Розведений розчин для інфузій
Хімічна та фізична стабільність лікарського засобу після розведення підтверджена протягом
24 годин при температурі ≤ 25 °C та протягом 48 годин при температурі від 2 до 8 °C. З мікробіологічної точки зору лікарський засіб слід використовувати негайно. Якщо він не використовується одразу, час та умови зберігання після розведення залежать від відповідальності користувача, але зазвичай не перевищують 24 годин при температурі від 2 до 8 °C, якщо тільки розведення не було проведено в контрольованих та валідованих асептичних умовах.
Умови зберігання
Зберігати у недоступному для дітей місці при температурі від 2 до 8 °C.
Несумісність
Не слід застосовувати розчинники, що містять глюкозу, оскільки Каспофунгін Асіно нестабільний у таких розчинах.
Оскільки відсутні дослідження сумісності, не слід змішувати Каспофунгін Асіно з іншими лікарськими засобами.
Упаковка
По 50 мг у флаконі. По 1 флакону у картонній пачці.
Категорія відпуску. За рецептом.
Виробник
БАГ Хеaлс Кеа ГмбХ.
Місцезнаходження виробника та адреса місця провадження його діяльності
Амтсгерихштрассе 1-5, Лих, 35423, Німеччина.
Заявник
ТОВ «АСІНО УКРАЇНА»
Місцезнаходження заявника.
Україна, 03124, м. Київ, бульвар Вацлава Гавела, 8.
У разі виникнення побічних реакцій або запитань щодо безпеки та ефективності застосування лікарського засобу потрібно звертатися до відділу фармаконагляду ТОВ «АСІНО УКРАЇНА» за адресою: бульвар Вацлава Гавела, 8, м. Київ, 03124, тел/факс: +38 044 281 2333.


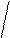 Перед
приготуванням
розчину для інфузії слід
визначати
площу
поверхні
тіла
пацієнта за
такою формулою:
Перед
приготуванням
розчину для інфузії слід
визначати
площу
поверхні
тіла
пацієнта за
такою формулою: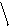 зріст (см) ×
маса тіла (кг)
зріст (см) ×
маса тіла (кг)