ЕНХЕРТУ
-
Велика Британія АСТРАЗЕНЕКА ЮК ЛІМІТЕДФорма выпуску: порошок для концентрату для розчину для інфузій, 100 мг, стерильний ліофілізований порошок для концентрату для розчину для інфузій для одноразового використання у скляному флаконі, закупореному гумовою пробкою з обжимною кришкою "flip-off crimp cap"; по 1 флакону в картонній коробціСклад: 1 флакон зі стерильним ліофілізованим порошком для концентрату для розчину для інфузій містить 107 мг трастузумабу дерукстекану, що відповідає номінальній кількості 100 мг у 5 мл відновленого розчину; /після відновлення, 1 флакон об’ємом 5 мл містить 20 мг/мл трастузумабу дерукстекану (див. розділ «Спосіб застосування та дози»);Умови відпуску: за рецептомНомер реєстраційного посвідчення: UA/20895/01/01код АТС: L01FD04Термін придатності: 48 місяців
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЕНХЕРТУ
(ENHERTU®)
Склад:
діюча речовина: трастузумаб дерукстекан (trastuzumab deruxtecan);
1 флакон зі стерильним ліофілізованим порошком для концентрату для розчину для інфузій містить 107 мг трастузумабу дерукстекану, що відповідає номінальній кількості 100 мг у 5 мл відновленого розчину; після відновлення, 1 флакон об’ємом 5 мл містить 20 мг/мл трастузумабу дерукстекану (див. розділ «Спосіб застосування та дози»);
допоміжні речовини: сахароза, L-гістидин, L-гістидину гідрохлориду моногідрат, полісорбат 80.
Лікарська форма
Порошок для концентрату для розчину для інфузій.
Основні фізико-хімічні властивості: ліофілізована маса від білого до жовтувато-білого кольору.
Фармакотерапевтична група
Антинеопластичні засоби. Моноклональні антитіла та кон’югати антитіла з лікарським засобом. Інгібітори HER2 (рецептор епідермального фактора росту людини 2 типу). Трастузумаб дерукстекан. Код АТХ L01F D04.
Фармакологічні властивості
Фармакодинаміка
Механізм дії
Лікарський засіб Енхерту є кон’югатом антитіла до HER2 рецептора з лікарським засобом. Антитіло являє собою гуманізований IgG1 до рецептора HER2, який зв’язаний з дерукстеканом, інгібітором топоізомерази I (DXd), за допомогою розщеплюваного лінкера, на основі тетрапептиду. У плазмі крові кон’югат залишається стабільним. Функція частини антитіла полягає у зв’язуванні з HER2, що експресується на поверхні певних пухлинних клітин. Після зв’язування з рецепторами на пухлинних клітинах трастузумаб дерукстекан піддається інтерналізації та внутрішньоклітинному розщепленню лінкера лізосомальними ферментами, які активуються в пухлинних клітинах. Після вивільнення проникаючий через мембрану DXd спричиняє пошкодження дезоксирибонуклеїнової кислоти (ДНК) та апоптоз клітин пухлини. DXd, похідна екзатекану, приблизно в 10 разів ефективніший за SN-38, активний метаболіт іринотекану.
Дослідження in vitro показують, що частина антитіла трастузумабу дерукстекану, яка має ту саму амінокислотну послідовність, що і трастузумаб, також зв’язується з FcγRIIIa та комплементом C1q. Антитіло опосередковує антитілозалежну клітинну цитотоксичність (ADCC) у клітинах раку молочної залози людини, які надлишково експресують HER2. Крім того, антитіло пригнічує передачу сигналів через шлях фосфатидилінозитол-3-кінази (PI3-K) у клітинах раку молочної залози людини, які надлишково експресують HER2.
Клінічна ефективність
HER2-позитивний рак молочної залози
Дослідження DESTINY-Breast03 (NCT03529110)
Ефективність та безпеку застосування лікарського засобу Енхерту оцінювали у дослідженні DESTINY-Breast03, багатоцентровому рандомізованому відкритому дослідженні 3 фази з активним контролем, яке проводилося у двох групах. У дослідженні брали участь пацієнти з HER2-позитивним нерезектабельним або метастатичним раком молочної залози, які раніше отримали терапію трастузумабом і таксанами для лікування метастатичного захворювання або у яких був рецидив захворювання під час ад’ювантної терапії або протягом 6 місяців після її завершення.
Критерієм включення була наявність архівних зразків пухлинної тканини молочної залози для підтвердження HER2-позитивного статусу, визначеного за результатами імуногістохімічного аналізу як 3+ бали (HER2 immunohistochemical (IHC) 3+), або позитивний статус за результатами аналізу методом гібридизації in situ (in situ hybridization (ISH)-positive). У дослідження не включали пацієнтів з наявністю в анамнезі лікування глюкокортикостероїдами з приводу інтерстиціальної хвороби легень/пневмоніту (ІХЛ/пневмоніту) або з наявністю ІХЛ/пневмоніту при скринінгу, пацієнтів з нелікованими метастазами в головний мозок або з метастазами в головний мозок з наявністю клінічних симптомів і пацієнтів з наявністю в анамнезі клінічно значущого захворювання серця, які раніше отримували лікування анти-HER2 кон’югатом антитіло-лікарський засіб з приводу метастатичного захворювання. Пацієнти проходили рандомізацію у співвідношенні 1:1 з призначенням лікарського засобу Енхерту у дозі 5,4 мг/кг (N = 261) або трастузумабу емтанзину у дозі 3,6 мг/кг (N = 263), що застосовуються шляхом внутрішньовенної інфузії один раз на три тижні. Рандомізація проводилася зі стратифікацією за статусом гормональних рецепторів, попереднім лікуванням пертузумабом та наявністю вісцеральних метастазів в анамнезі. Лікування проводилося до прогресування захворювання, летального результату, відкликання згоди чи розвитку неприйнятної токсичності.
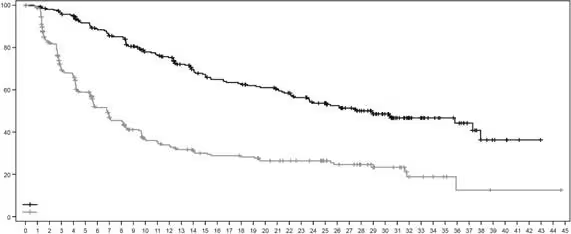
Первинним критерієм ефективності була виживаність без прогресування (ВБП), яка оцінювалася за допомогою незалежної центральної оцінки в сліпому режимі (Blinded Independent Central Review (BICR)) відповідно до критеріїв відповіді солідних пухлин на лікування (Response Evaluation Criteria In Solid Tumors (RECIST), версія 1.1). Ключовою вторинною кінцевою точкою ефективності була загальна виживаність (ЗВ). Вторинними кінцевими точками були ВБП за оцінкою дослідника, підтверджена частота об’єктивної відповіді (ЧОВ) і тривалість відповіді (ТВ).
Демографічні дані та вихідні характеристики пацієнтів були добре збалансовані між групами лікування. Вихідні демографічні дані та характеристики захворювання 524 рандомізованих пацієнтів були такими: медіана віку — 54 роки (діапазон від 20 до 83 років); вік від 65 років та старші (20,2 %); жіноча стать (99,6 %); належали до монголоїдної раси (59,9 %); належали до європеоїдної раси (27,3 %); належали до негроїдної раси чи афроамериканців (3,6 %); функціональний статус 0 балів (62,8 %) або 1 (36,8 %) бал за класифікацією Східної об’єднаної онкологічної групи (Eastern Cooperative Oncology Group (ECOG)); статус гормональних рецепторів (позитивний – 51,9 %); наявність вісцеральних метастазів (73,3 %); наявність метастазів в головний мозок на вихідному рівні (15,6 %), одну лінію попередньої системної терапії з приводу метастатичного захворювання отримали 48,3 % пацієнтів. Частка пацієнтів, які не отримували попередньої терапії з приводу метастатичного захворювання, становила 9,5 %. Частка пацієнтів, які раніше отримували терапію пертузумабом, становила 61,1 %.
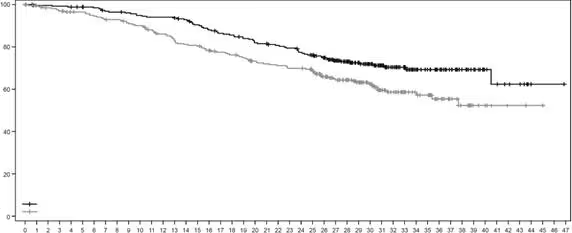
На момент проведення попередньо визначеного проміжного аналізу ВБП, що охоплював 245 подій (73 % від усієї запланованої кількості подій для остаточного аналізу), дослідження продемонструвало статистично значуще покращення ВБП за оцінкою BICR у пацієнтів, рандомізованих до групи застосування лікарського засобу Енхерту, порівнянно з пацієнтами групи застосування трастузумабу емтанзину. ВБП за оцінкою BICR з первинного аналізу (дата припинення збору даних 21 травня 2021 р.) та оновлені результати ЗВ, ЧОВ та ТВ після дати припинення збору даних 25 липня 2022 р. представлено у таблиці 1.
Таблиця 1: Результати оцінки ефективності у дослідженні DESTINY-Breast03
|
Показник ефективності |
Енхерту N = 261 |
трастузумаб емтанзин N = 263 |
|
Виживаність без прогресування (ВБП) за оцінкою BICRa |
||
|
Кількість подій (%) |
87 (33,3) |
158 (60,1) |
|
Медіана, місяці (95 % ДІ) |
НД (18,5; НПО) |
6,8 (5,6; 8,2) |
|
Відношення ризиків (95 % ДІ) |
0,28 (0,22; 0,37) |
|
|
p-значення |
p < 0,000001† |
|
|
Загальна виживаність (ЗВ)b |
||
|
Кількість подій (%) |
72 (27,6) |
97 (36,9) |
|
Медіана, місяці (95 % ДІ) |
НД (40,5; НПО) |
НД (34,0; НПО) |
|
Відношення ризиків (95 % ДІ) |
0,64 (0,47; 0,87) |
|
|
p-значенняc |
p = 0,0037 |
|
|
ВБП за оцінкою BICR (оновлено)b |
||
|
Кількість подій (%) |
117 (44,8) |
171 (65,0) |
|
Медіана, місяці (95 % ДІ) |
28,8 (22,4; 37,9) |
6,8 (5,6; 8,2) |
|
Відношення ризиків (95 % ДІ) |
0,33 (0,26; 0,43) |
|
|
Підтверджена частота об’єктивної відповіді (ЧОВ) за оцінкою BICRb |
||
|
n (%) |
205 (78,5) |
92 (35,0) |
|
95 % ДІ |
(73,1; 83,4) |
(29,2; 41,1) |
|
Повна відповідь, n (%) |
55 (21,1) |
25 (9,5) |
|
Часткова відповідь, n (%) |
150 (57,5) |
67 (25,5) |
|
Тривалість відповіді за оцінкою BICRb |
||
|
Медіана, місяці (95 % ДІ) |
36,6 (22,4; НПО) |
23,8 (12,6; 34,7) |
ДІ — довірчий інтервал; НПО — не піддається оцінюванню; НД — не досягнуто.
† Представлено у вигляді 6 десяткових знаків.
a Дата припинення збору даних 21 травня 2021 р.
b Дата припинення збору даних 25 липня 2022 р. для попередньо запланованого проміжного аналізу ЗВ.
c р-значення ґрунтується на основі стратифікованого лог-рангового критерію; результати були вищими за межу ефективності 0,013.
Рис. 1. Крива загальної виживаності за Капланом – Маєром (дата припинення збору даних 25 липня 2022 р.)
|
Загальна виживаність, % |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Час, місяців |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Кількість пацієнтів у групі ризику: |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Енхерту (261) |
261 |
256 |
256 |
255 |
254 |
251 |
249 |
244 |
243 |
241 |
238 |
236 |
236 |
236 |
231 |
224 |
218 |
213 |
211 |
206 |
201 |
200 |
196 |
193 |
187 |
182 |
173 |
156 |
142 |
124 |
109 |
91 |
73 |
64 |
51 |
44 |
38 |
30 |
22 |
18 |
11 |
9 |
7 |
6 |
1 |
1 |
0 |
|||||
|
Трастузумаб емтанзин (263) |
263 |
257 |
252 |
248 |
243 |
242 |
237 |
233 |
232 |
227 |
224 |
217 |
211 |
203 |
199 |
197 |
191 |
186 |
183 |
179 |
172 |
169 |
167 |
164 |
164 |
158 |
140 |
129 |
117 |
106 |
90 |
70 |
59 |
45 |
41 |
38 |
27 |
20 |
15 |
8 |
7 |
4 |
3 |
3 |
1 |
0 |
||||||
Рис. 2. Крива виживаності без прогресування за Капланом-Маєром за оцінкою BICR (дата припинення збору даних 25 липня 2022 р.)
|
Виживаність без прогресії, % |
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Час, місяців |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Кількість пацієнтів у групі ризику: |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Енхерту (261) |
261 |
256 |
250 |
244 |
240 |
225 |
216 |
207 |
205 |
191 |
176 |
173 |
167 |
154 |
146 |
140 |
134 |
131 |
130 |
125 |
123 |
117 |
113 |
107 |
99 |
96 |
90 |
82 |
73 |
64 |
55 |
41 |
32 |
28 |
23 |
20 |
18 |
13 |
7 |
5 |
4 |
2 |
1 |
0 |
||||||
|
Трастузумаб емтанзин (263) |
263 |
253 |
201 |
164 |
156 |
134 |
111 |
99 |
96 |
81 |
69 |
67 |
63 |
58 |
54 |
51 |
49 |
49 |
47 |
47 |
42 |
41 |
39 |
37 |
36 |
32 |
28 |
27 |
22 |
19 |
15 |
14 |
8 |
7 |
6 |
4 |
2 |
2 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
||||
Подібні результати ВБП спостерігалися у попередньо визначених підгрупах, включно з підгрупами за попередньою терапією пертузумабом, статусом гормональних рецепторів та наявністю вісцеральних метастазів.
Дослідження DESTINY-Breast02 (NCT03523585)
Ефективність і безпеку застосування лікарського засобу Енхерту оцінювали у дослідженні DESTINY-Breast02, багатоцентровому рандомізованому відкритому дослідженні 3 фази з активним контролем, у яке було включено пацієнтів з нерезектабельним або метастатичним HER2-позитивним раком молочної залози, у яких була резистентність або рефрактерність до попередньої терапії T-DM1. Критерієм включення була наявність архівних зразків пухлинної тканини молочної залози для підтвердження HER2-позитивного статусу, визначеного за результатами імуногістохімічного аналізу як 3+ бали (HER2 IHC 3+), або позитивний статус за результатами аналізу методом гібридизації in situ (SH-positive). У дослідження не включали пацієнтів з наявністю в анамнезі лікування глюкокортикостероїдами з приводу ІХЛ/пневмоніту або з наявністю ІХЛ/пневмоніту при скринінгу, пацієнтів з нелікованими метастазами в головний мозок або з метастазами в головний мозок з наявністю клінічних симптомів і пацієнтів з наявністю в анамнезі клінічно значущого захворювання серця. Пацієнтів було рандомізовано у співвідношенні 2:1 для отримання лікарського засобу Енхерту у дозі 5,4 мг/кг (n = 406) шляхом внутрішньовенної інфузії один раз на три тижні або терапію за вибором лікаря (n = 202, трастузумаб плюс капецитабін або лапатиніб плюс капецитабін). Рандомізація проводилася зі стратифікацією за статусом гормональних рецепторів, попереднім лікуванням пертузумабом та наявністю вісцеральних метастазів в анамнезі. Лікування проводилося до прогресування захворювання, летального результату, відкликання згоди чи розвитку неприйнятної токсичності.
Первинним критерієм ефективності була виживаність без прогресування (ВБП), яка оцінювалася за допомогою незалежної центральної оцінки в сліпому режимі (BICR) відповідно до критеріїв RECIST, версія 1.1. Ключовою вторинною кінцевою точкою ефективності була загальна виживаність (ЗВ). Вторинними кінцевими точками були ВБП за оцінкою дослідника, підтверджена частота об’єктивної відповіді (ЧОВ) і тривалість відповіді (ТВ).
Демографічні дані пацієнтів та вихідні характеристики захворювання були подібними у всіх групах лікування. Медіана віку 608 рандомізованих пацієнтів становила 54 роки (діапазон від 22 до 88 років); 99,2 % учасників дослідження були жіночої статі; належали до європеоїдної раси 63,2 %, належали до монголоїдної раси – 29,3 %, належали до негроїдної раси чи афроамериканців – 2,8 %; функціональний статус 0 балів за класифікацією ECOG мали 57,4 % пацієнтів або 1 бал – 42,4 % пацієнтів; позитивний статус гормональних рецепторів мали 58,6 %; наявність вісцеральних метастазів – 78,3 %; наявність метастазів в головний мозок на вихідному рівні – 18,1 %; одну лінію попередньої системної терапії з приводу метастатичного захворювання отримали 4,9 % пацієнтів.
Результати оцінки ефективності узагальнено в таблиці 2 і на рисунках 3 і 4.
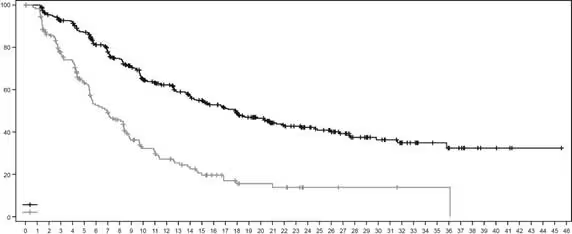
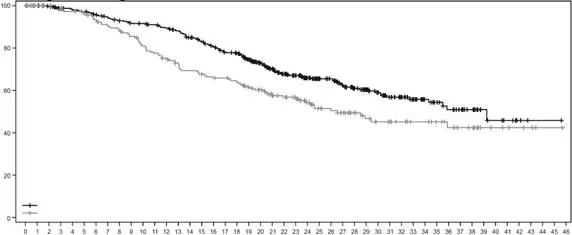
Таблиця 2: Результати оцінки ефективності у дослідженні DESTINY-Breast02
|
Показник ефективності |
Енхерту N = 406 |
Терапія за вибором лікаря N = 202 |
|
ВБП за оцінкою BICR |
||
|
Кількість подій (%) |
200 (49,3) |
125 (61,9) |
|
Медіана, місяці (95 % ДІ) |
17,8 (14,3; 20,8) |
6,9 (5,5; 8,4) |
|
Відношення ризиків (95 % ДІ) |
0,36 (0,28; 0,45) |
|
|
p-значення |
p < 0,000001† |
|
|
Загальна виживаність (ЗВ) |
||
|
Кількість подій (%) |
143 (35,2) |
86 (42,6) |
|
Медіана, місяці (95 % ДІ) |
39,2 (32,7; НПО) |
26,5 (21,0; НПО) |
|
Відношення ризиків (95 % ДІ) |
0,66 (0,50; 0,86) |
|
|
p-значенняa |
p = 0,0021 |
|
|
ВБП за оцінкою дослідника |
||
|
Кількість подій (%) |
206 (50,7) |
152 (75,2) |
|
Медіана, місяці (95 % ДІ) |
16,7 (14,3; 19,6) |
5,5 (4,4; 7,0) |
|
Відношення ризиків (95 % ДІ) |
0,28 (0,23; 0,35) |
|
|
Підтверджена частота об’єктивної відповіді (ЧОВ) за оцінкою BICR |
||
|
n (%) |
283 (69,7) |
59 (29,2) |
|
95 % ДІ |
(65,0; 74,1) |
(23,0; 36,0) |
|
Повна відповідь, n (%) |
57 (14,0) |
10 (5,0) |
|
Часткова відповідь, n (%) |
226 (55,7) |
49 (24,3) |
|
Тривалість відповіді за оцінкою BICR |
||
|
Медіана, місяці (95 % ДІ) |
19,6 (15,9; НПО) |
8,3 (5,8; 9,5) |
ДІ — довірчий інтервал; НПО — не піддається оцінюванню.
† Представлено у вигляді 6 десяткових знаків.
a p-значення ґрунтується на основі стратифікованого лог-рангового критерію; результати були вищими за межу ефективності 0,004.
Рис. 3. Крива виживаності без прогресування за оцінкою BICR за Капланом – Маєром
|
Виживаність без прогресії, % |
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Час, місяців |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Кількість пацієнтів у групі ризику: |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Енхерту (406) |
406 |
400 |
374 |
359 |
355 |
330 |
296 |
278 |
260 |
239 |
213 |
203 |
194 |
179 |
170 |
161 |
149 |
141 |
132 |
119 |
109 |
88 |
83 |
76 |
65 |
60 |
55 |
47 |
38 |
35 |
31 |
27 |
23 |
19 |
15 |
14 |
12 |
10 |
6 |
4 |
4 |
3 |
1 |
1 |
1 |
1 |
0 |
||||
|
Терапія за вибором лікаря (202) |
202 |
180 |
148 |
126 |
118 |
95 |
78 |
72 |
64 |
48 |
39 |
37 |
32 |
28 |
24 |
20 |
17 |
13 |
11 |
9 |
9 |
8 |
8 |
6 |
3 |
3 |
3 |
2 |
2 |
2 |
2 |
2 |
1 |
1 |
1 |
1 |
1 |
0 |
|||||||||||||
Рис. 4. Крива загальної виживаності за Капланом-Маєром
|
Загальна виживаність, % |
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Час, місяців |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Кількість пацієнтів у групі ризику: |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Енхерту (406) |
406 |
404 |
400 |
390 |
385 |
382 |
374 |
366 |
357 |
352 |
350 |
346 |
339 |
331 |
317 |
306 |
295 |
282 |
277 |
257 |
234 |
215 |
196 |
83 |
160 |
144 |
139 |
122 |
104 |
93 |
82 |
72 |
63 |
51 |
40 |
34 |
29 |
25 |
19 |
10 |
8 |
6 |
3 |
1 |
1 |
1 |
0 |
||||
|
Терапія за вибором лікаря (202) |
202 |
192 |
187 |
182 |
178 |
173 |
167 |
161 |
157 |
151 |
142 |
136 |
130 |
124 |
118 |
114 |
111 |
110 |
106 |
95 |
89 |
79 |
76 |
72 |
61 |
53 |
50 |
46 |
38 |
33 |
29 |
28 |
25 |
22 |
22 |
18 |
15 |
13 |
12 |
7 |
6 |
5 |
4 |
3 |
1 |
1 |
0 |
||||
Дослідження DESTINY-Breast01 (NCT03248492)
Ефективність та безпеку застосування лікарського засобу Енхерту оцінювали у дослідженні DESTINY-Breast01, багатоцентровому, відкритому, дослідженні фази 2 в одній групі, у якому брали участь пацієнти з HER2-позитивним нерезектабельним та/або метастатичним раком молочної залози, які отримали дві або більше попередні схеми терапії на основі анти- HER2, включно з трастузумабом емтанзином (100 %), трастузумабом (100 %) та пертузумабом (65,8 %). Критерієм включення була наявність архівних зразків пухлинної тканини молочної залози для підтвердження HER2-позитивного статусу, визначеного за результатами імуногістохімічного аналізу як 3+ бали (HER2 IHC 3+), або позитивний статус за результатами аналізу методом гібридизації in situ (ISH-positive). У дослідження не включали пацієнтів з наявністю в анамнезі лікування з приводу інтерстиціальної хвороби легень (ІХЛ) або з наявністю ІХЛ при скринінгу, пацієнтів з нелікованими метастазами в головний мозок або з метастазами в головний мозок з наявністю клінічних симптомів і пацієнтів з наявністю в анамнезі клінічно значущого захворювання серця. Пацієнти, включені в дослідження, мали щонайменше 1 вимірюване вогнище згідно з RECIST, версія 1.1. Лікарський засіб Енхерту вводили шляхом внутрішньовенної інфузії у дозі 5,4 мг/кг один раз на три тижні до прогресування захворювання, летального результату, відкликання згоди чи розвитку неприйнятної токсичності. Первинним критерієм ефективності була підтверджена частота об’єктивної відповіді (ЧОВ) відповідно до критеріїв RECIST, версія 1.1, у популяції всіх рандомізованих пацієнтів згідно з призначеним лікуванням (intent-to- treat (ITT)), яка оцінювалася за допомогою незалежної центральної оцінки (independent central review (ICR)). Вторинною кінцевою точкою ефективності була тривалість відповіді (ТВ).
Вихідні демографічні дані та характеристики захворювання 184 пацієнтів, включених у дослідження DESTINY-Breast01, були такими: медіана віку — 55 років (діапазон від 28 до 96 років); вік від 65 років (23,9 %); жіноча стать (100 %); належали до європеоїдної раси (54,9 %); належали до монголоїдної раси (38,0 %); належали до негроїдної раси чи афроамериканців (2,2 %); функціональний статус 0 балів (55,4 %) або 1 (44,0 %) бал за класифікацією ECOG; позитивний статус гормональних рецепторів (52,7 %); наявність вісцеральних метастазів (91,8 %); раніше ліковані та стабільні метастази в головний мозок (13,0 %); медіана кількості попередніх ліній терапії за наявності метастазів становить 5 (діапазон від 2 до 17); сума діаметрів усіх цільових вогнищ (< 5 см – 42,4 %, ≥ 5 см – 50,0 %).
Раніше проведений аналіз (медіана тривалості подальшого спостереження 11,1 місяця [діапазон від 0,7 до 19,9 місяця]) показав підтверджену частоту об’єктивної відповіді 60,9 % (95 % ДІ 53,4; 68,0), з яких 6,0 % пацієнтів з повною відповіддю та 54,9 % пацієнтів з частковою відповіддю; 36,4 % мали стабільне захворювання, у 1,6 % відбулося прогресування захворювання, а дані 1,1 % не піддавалися оцінюванню. Медіана тривалості відповіді на момент аналізу становила 14,8 місяця (95 % ДІ 13,8; 16,9), при цьому у 81,3 % пацієнтів тривалість відповіді становила ≥ 6 місяців (95 % ДІ 71,9; 87,8). Результати оцінки ефективності на момент оновленої дати припинення збору даних з медіаною тривалості подальшого спостереження 20,5 місяців (діапазон від 0,7 до 31,4 місяців) наведено в таблиці 3.
Таблиця 3: Результати оцінки ефективності в дослідженні DESTINY-Breast01 (популяція для повного аналізу)
|
DESTINY-Breast01 N = 184 |
|
|
Підтверджена частота об’єктивної відповіді (95 % ДІ)*† |
61,4 % (54,0; 68,5) |
|
Повна відповідь (ПВ) |
6,5 % |
|
Часткова відповідь (ЧВ) |
54,9 % |
|
Тривалість відповіді‡ |
|
|
Медіана, місяці (95 % ДІ) |
20,8 (15,0; НД) |
|
% пацієнтів з тривалістю відповіді ≥ 6 місяців (95 % ДІ)§ |
81,5 % (72,2; 88,0) |
ЧОВ 95 % ДІ, розрахований за методом Клоппера – Пірсона.
ДI – довірчий інтервал.
95 % ДІ, розрахований за методом Брукмеєра – Кроулі.
* Підтверджені відповіді (за результатами незалежної центральної оцінки в сліпому режимі) визначалися як зафіксована ПВ/ЧВ, повторно підтверджена візуалізаційним методом не менше ніж через 4 тижні після візиту, під час якого відповідь спостерігали вперше.
† Зі 184 пацієнтів 35,9 % мали стабільне захворювання, у 1,6 % відбулося прогресування захворювання, а дані 1,1 % не піддавалися оцінюванню.
‡ Включає 73 пацієнти з цензурованими даними.
§ На основі оцінки за методом Каплана-Маєра.
НД — не досягнуто.
Стабільна протипухлинна активність спостерігалася у попередньо визначених підгрупах відповідно до результатів попередньої терапії пертузумабом та статусу гормональних рецепторів.
Рак молочної залози з низьким рівнем експресії HER2
Дослідження DESTINY-Breast04 (NCT03734029)
Ефективність та безпеку застосування лікарського засобу Енхерту вивчали у дослідженні DESTINY-Breast04, багатоцентровому рандомізованому відкритому дослідженні фази 3, до якого було включено 557 дорослих пацієнтів з нерезактабельним або метастатичним раком молочної залози з низьким рівнем експресії HER2. Дослідження включає 2 когорти: 494 пацієнти з позитивним статусом гормональних рецепторів (HR+) та 63 пацієнти з негативним статусом гормональних рецепторів (HR-). Низький рівень експресії HER2 оцінювали в центральній лабораторії як IHC 1+ (визначався як слабке часткове фарбування мембрани більш ніж 10 % ракових клітин) або IHC 2+/ISH- на приладі PATHWAY/VENTANA за допомогою клону 4B5 для визначення статусу HER2 (anti-HER2/neu (4B5)). Пацієнти мали отримувати хіміотерапію з приводу метастатичного захворювання або мати рецидив захворювання під час ад’ювантної хіміотерапії або впродовж 6 місяців після її завершення. Згідно з критеріями включення на момент рандомізації пацієнти з HR+ повинні були отримати принаймні одну схему ендокринної терапії або мати протипоказання до подальшої ендокринної терапії. Пацієнти були рандомізовані у співвідношенні 2:1 до групи застосування лікарського засобу Енхерту у дозі 5,4 мг/кг (N = 373) шляхом внутрішньовенної інфузії один раз на три тижні або хіміотерапії на вибір лікаря (N = 184, ерибулін – 51,1 %, капецитабін – 20,1 %, гемцитабін – 10,3 %, наб-паклітаксел – 10,3 % або паклітаксел – 8,2 %). Рандомізація була стратифікована за HER2 IHC статусом, визначеним за результатами імуногістохімічного аналізу зразків пухлинної тканини молочної залози (IHC 1+ або IHC 2+/ISH-), кількості попередніх ліній хіміотерапії при метастатичній стадії хвороби (1 або 2) та HR статусу/перед CDK4/6i (HR+ з попереднім лікуванням інгібітором CDK4/6, HR+ без попереднього лікування інгібітором CDK4/6 або HR-). Лікування проводилося до прогресування захворювання, летального результату, відкликання згоди чи розвитку неприйнятної токсичності. У дослідження не включали пацієнтів з наявністю в анамнезі лікування глюкокортикостероїдами з приводу ІХЛ/пневмоніту або з наявністю ІХЛ/пневмоніту при скринінгу, а також пацієнтів з наявністю в анамнезі клінічно значущого захворювання серця. У дослідження також не включали пацієнтів з нелікованими метастазами в головний мозок або з метастазами в головний мозок з наявністю клінічних симптомів або функціональним статусом за шкалою ECOG >1 бала.
Первинною кінцевою точкою ефективності була виживаність без прогресування (ВБП) у пацієнтів з HR+ раком молочної залози, оцінка якої проводилася за BICR відповідно до критеріїв RECIST, версія 1.1. Ключовими вторинними кінцевими точками ефективності були ВБП, оцінка яких проводилася за BICR відповідно до критеріїв RECIST, версія 1.1, у загальній популяції (всі рандомізовані пацієнти з HR+ та HR-), загальна виживаність (ЗВ) у пацієнтів з HR+ та ЗВ у загальній популяції. Вторинними кінцевими точками були ЧОВ, ТВ та повідомлювані пацієнтом результати (patient-reported outcomes (PRO)).
Демографічні дані й характеристики пухлини на вихідному рівні були зіставними в групах лікування. Середній вік 557 рандомізованих пацієнтів становив 57 років (діапазон від 28 до 81 року); 23,5 % були віком від 65 років; 99,6 % були жіночої статі та 0,4 % чоловічої статі; 47,9 % були представниками європеоїдної раси, 40,0 % — представниками монголоїдної раси та 1,8 % — представниками негроїдної раси або афроамериканцями. На вихідному рівні пацієнти мали функціональний статус за шкалою ECOG 0 (54,8 %) або 1 (45,2 %) бал; 57,6 % мали IHC 1+; 42,4 % — IHC 2+/ISH-; 88,7 % — HR+ та 11,3 % — HR-; 69,8 % мали метастази в печінці, 32,9 % — метастази в легенях та 5,7 % — метастази в головний мозок. Частка пацієнтів, які раніше отримували антрацикліни в (нео)ад’ювантній терапії, становила 46,3 % та 19,4 % при місцево поширеному та/або метастатичному захворюванні. При метастатичному захворюванні пацієнти в середньому отримували 3 попередні лінії системної терапії (діапазон від 1 до 9), при цьому 57,6 % отримали 1 та 40,9 % отримали 2 попередні схеми хіміотерапії; у 3,9 % було раннє прогресування захворювання (прогресування під час нео/ад’ювантної терапії). У пацієнтів з HR+ середня кількість попередніх ліній ендокринної терапії становила 2 (діапазон від 0 до 9) і 70 % раніше отримували лікування інгібіторами CDK4/6.
Результати оцінки ефективності узагальнено в таблиці 4 і на рисунках 5 і 6.
Таблиця 4: Результати оцінки ефективності у дослідженні DESTINY-Breast04
|
Показник ефективності |
Когорта HR+ |
Загальна популяція (когорта HR+ та HR-) |
||
|
Енхерту (N = 331) |
Хіміотерапія (N = 163) |
Енхерту (N = 373) |
Хіміотерапія (N = 184) |
|
|
Загальна виживаність |
||||
|
Кількість подій (%) |
126 (38,1) |
73 (44,8) |
149 (39,9) |
90 (48,9) |
|
Медіана, місяці (95 % ДІ) |
23,9 (20,8; 24,8) |
17,5 (15,2; 22,4) |
23,4 (20,0; 24,8) |
16,8 (14,5; 20,0) |
|
Відношення ризиків (95 % ДІ) |
0,64 (0,48; 0,86) |
0,64 (0,49; 0,84) |
||
|
p-значення |
0,0028 |
0,001 |
||
|
Виживаність без прогресування за оцінкою BICR |
||||
|
Кількість подій (%) |
211 (63,7) |
110 (67,5) |
243 (65,1) |
127 (69,0) |
|
Медіана, місяці (95 % ДІ) |
10,1 (9,5; 11,5) |
5,4 (4,4; 7,1) |
9,9 (9,0; 11,3) |
5,1 (4,2; 6,8) |
|
Відношення ризиків (95 % ДІ) |
0,51 (0,40; 0,64) |
0,50 (0,40; 0,63) |
||
|
p-значення |
< 0,0001 |
< 0,0001 |
||
|
Підтверджена частота об’єктивної відповіді за оцінкою BICR* |
||||
|
n (%) |
175 (52,6) |
27 (16,3) |
195 (52,3) |
30 (16,3) |
|
95 % ДІ |
47,0; 58,0 |
11,0; 22,8 |
47,1; 57,4 |
11,3; 22,5 |
|
Повна відповідь, n (%) |
12 (3,6) |
1 (0,6) |
13 (3,5) |
2 (1,1) |
|
Часткова відповідь, n (%) |
164 (49,2) |
26 (15,7) |
183 (49,1) |
28 (15,2) |
|
Тривалість відповіді за оцінкою BICR* |
||||
|
Медіана, місяці (95 % ДІ) |
10,7 (8,5; 13,7) |
6,8 (6,5; 9,9) |
10,7 (8,5; 13,2) |
6,8 (6,0; 9,9) |
ДI — довірчий інтервал.
* На основі даних електронних індивідуальних реєстраційних форм для когорти HR+: N = 333 у групі застосування лікарського засобу Енхерту та N = 166 у групі хіміотерапії.
У підгрупах пацієнтів, попередньо визначених на підставі HR-статусу, попередньої терапії інгібіторами CDK4/6i, кількості попередніх ліній хіміотерапії, статусу IHC1+ та IHC2+/ISH-, було показано покращення ЗВ та ВБП. У підгрупі пацієнтів з HR-медіана ЗВ становила 18,2 місяця (95 % ДІ 13,6, неможливо оцінити) у групі застосування лікарського засобу Енхерту порівняно з 8,3 місяців (95 % ДІ 5,6; 20,6) у групі хіміотерапії з відношенням ризиків 0,48 (95 % ДІ 0,24; 0,95). Медіана ВБП становила 8,5 місяців (95 % ДІ 4,3; 11,7) у пацієнтів, рандомізованих до групи застосування лікарського засобу Енхерту, та 2,9 (95 % ДІ 1,4; 5,1) у пацієнтів, рандомізованих до групи хіміотерапії, з відношенням ризиків 0,46 (95 % ДІ 0,24; 0,89).
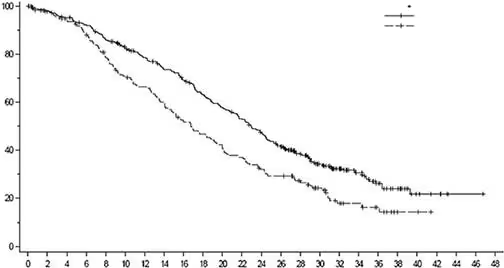
Під час оновленого описового аналізу з медіаною подальшого спостереження 32 місяці покращення показників ЗВ відповідало результатам первинного аналізу. ВР у загальній популяції становило 0,69 (95 % ДІ 0,55; 0,86), медіана ЗВ — 22,9 місяця (95 % ДІ 21,2; 24,5) у групі застосування лікарського засобу Енхерту та 16,8 місяця (95 % ДІ 14,1; 19,5) у групі застосування хіміотерапії. Криві Каплана – Маєра за даними оновленого аналізу ЗВ наведено на рисунку 5.
Рис. 5. Крива загальної виживаності за Капланом – Маєром (загальна популяція) (оновлений аналіз)
|
Загальна виживаність, % |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Час (місяців) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Кількість пацієнтів у групі ризику |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Енхерту (373) |
373 |
366 |
363 |
366 |
350 |
342 |
337 |
325 |
314 |
306 |
256 |
235 |
276 |
269 |
257 |
254 |
240 |
231 |
217 |
206 |
199 |
191 |
182 |
168 |
160 |
148 |
137 |
122 |
107 |
94 |
81 |
75 |
62 |
52 |
48 |
39 |
26 |
21 |
18 |
11 |
7 |
6 |
5 |
3 |
1 |
1 |
1 |
0 |
||||||
|
Хіміотерапія (184) |
184 |
170 |
164 |
160 |
156 |
152 |
145 |
137 |
127 |
119 |
113 |
107 |
106 |
100 |
96 |
88 |
81 |
76 |
73 |
69 |
64 |
59 |
58 |
53 |
49 |
45 |
45 |
44 |
37 |
33 |
27 |
18 |
15 |
12 |
12 |
10 |
8 |
5 |
2 |
2 |
2 |
1 |
0 |
|||||||||||
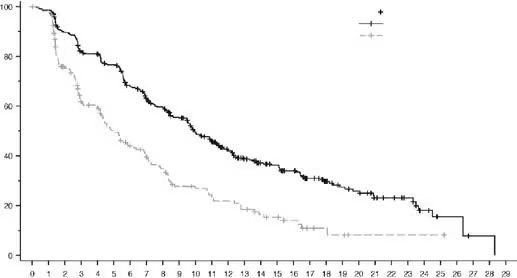
Рис. 6. Крива виживаності без прогресування за оцінкою BICR за Капланом – Маєром (загальна популяція)
|
Виживаність без прогресії, % |
|
|||||||||||||||||||||||||||||||||||
|
Час (місяців) |
||||||||||||||||||||||||||||||||||||
|
Кількість пацієнтів у групі ризику |
||||||||||||||||||||||||||||||||||||
|
Енхерту (373) |
373 |
365 |
325 |
295 |
290 |
272 |
238 |
217 |
201 |
183 |
156 |
142 |
118 |
100 |
88 |
81 |
71 |
53 |
42 |
35 |
32 |
21 |
18 |
15 |
8 |
4 |
4 |
1 |
1 |
0 |
||||||
|
Хіміотерапія (184) |
184 |
166 |
119 |
93 |
90 |
73 |
60 |
51 |
45 |
34 |
32 |
29 |
26 |
22 |
15 |
13 |
9 |
5 |
4 |
3 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|||||||||
НДКРЛ (NSCLC)
Дослідження DESTINY-Lung02 (NCT04644237)
Ефективність та безпеку застосування лікарського засобу Енхерту вивчали у дослідженні DESTINY-Lung02 – рандомізованому дослідженні фази 2, у якому оцінювали два рівні доз. Призначення дози лікування здійснювали в сліпому режимі для пацієнтів та дослідників. У дослідження було включено дорослих пацієнтів з метастатичним НДКРЛ з мутаціями гена HER2, які отримали принаймні одну схему хіміотерапії препаратами на основі платини. Виявлення активуючої мутації HER2 (ERBB2) проспективно визначалося у пухлинній тканині місцевими лабораторіями за допомогою валідованого тесту, такого як секвенування наступного покоління, полімеразна ланцюгова реакція або мас-спектрометрія. Пацієнти були рандомізовані у співвідношенні 2:1 до групи застосування лікарського засобу Енхерту у дозі 5,4 мг/кг або 6,4 мг/кг кожні 3 тижні. Рандомізація була стратифікована за попереднім лікуванням антитілом до білка 1 запрограмованої смерті клітини (PD-1) та/або антитілом до ліганда 1 запрограмованої смерті клітини (PD-L1) (так або ні). Лікування проводилося до прогресування захворювання, летального результату, відкликання згоди чи розвитку неприйнятної токсичності. У дослідження не включали пацієнтів з наявністю в анамнезі лікування глюкокортикостероїдами з приводу ІХЛ/пневмоніту або з наявністю ІХЛ/пневмоніту при скринінгу, а також пацієнтів з наявністю в анамнезі клінічно значущого захворювання серця. У дослідження також не включали пацієнтів з нелікованими метастазами в головний мозок та з метастазами в головний мозок з наявністю клінічних симптомів або функціональним статусом за шкалою ECOG > 1 бала.
Первинним критерієм ефективності була підтверджена ЧОВ за оцінкою BICR відповідно до критеріїв RECIST, версія 1.1. Вторинною кінцевою точкою ефективності була ТВ.
Демографічні дані пацієнтів та вихідні характеристики захворювання 102 учасників дослідження, які отримували дозу 5,4 мг/кг, були такими: середній вік 59,4 років (діапазон від 31 до 84 років); жіноча стать (63,7 %); належали до монголоїдної раси (63,7 %), належали до європеоїдної раси (22,5 %), інші (13,7 %); функціональний статус за шкалою ECOG 0 (28,4 %) або 1 (71,6 %) бал; 97,1 % мали мутацію в кіназному домені ERBB2, 2,9 % — в позаклітинному домені; 96,1 % мали мутацію HER2 в екзоні 19 або екзоні 20; 34,3 % мали стабільні метастази в головний мозок; 46,1 % курили в минулому, жоден з них не був курцем на час дослідження; 21,6 % раніше перенесли резекцію легені. При метастатичному захворюванні 32,4 % пацієнтів отримали понад 2 попередні лінії системної терапії, 100 % отримали хіміотерапію препаратами платини, 73,5 % отримали терапію анти-PD-1/PD-L1 та 50,0 % отримали хіміотерапію препаратами платини та терапію анти-PD-1/PD-L1 в комбінації.
Результати оцінки ефективності узагальнено в таблиці 5. Медіана тривалості подальшого спостереження становила 11,5 місяця (дата припинення збору даних 23 грудня 2022 р.).
Таблиця 5: Результати оцінки ефективності у дослідженні DESTINY-Lung02
|
Показник ефективності |
DESTINY-Lung02 5,4 мг/кг N = 102 |
|
Підтверджена частота об’єктивної відповіді (ЧОВ) за оцінкою BICR |
|
|
n (%) |
50 (49,0) |
|
(95 % ДІ)* |
(39,0; 59,1) |
|
Повна відповідь (ПВ), n (%) |
1 (1,0) |
|
Часткова відповідь (ЧВ), n (%) |
49 (48,0) |
|
Тривалість відповіді |
|
|
Медіана, місяці (95 % ДІ) † |
16,8 (6,4; НПО) |
* 95 % ДІ, розрахований за методом Клоппера – Пірсона.
ДІ — довірчий інтервал, НПО — не піддається оцінюванню.
† 95 % ДІ, розрахований за методом Брукмеєра – Кроулі.
Рак шлунка
Дослідження DESTINY-Gastric02 (NCT04014075)
Ефективність та безпеку застосування лікарського засобу Енхерту вивчали у дослідженні DESTINY-Gastric02 – багатоцентровому рандомізованому відкритому непорівняльному дослідженні фази 2, яке проводили у дослідницьких центрах Європи та США. У дослідження включали пацієнтів з місцево поширеною або метастатичною HER2-позитивною аденокарциномою шлунка або стравохідно-шлункового переходу (СШП), у яких відбулося прогресування захворювання на тлі попередньої схеми терапії на основі трастузумабу. Для пацієнтів необхідно було отримати підтверджений у центральній лабораторії HER2-позитивний статус, визначений як IHC 3+ або IHC 2+/ISH-позитивний. У дослідження не включали пацієнтів з наявністю в анамнезі лікування глюкокортикостероїдами з приводу ІХЛ/пневмоніту або з наявністю ІХЛ/пневмоніту при скринінгу, пацієнтів з наявністю в анамнезі клінічно значущого захворювання серця, а також пацієнтів з активними метастазами в головний мозок. Лікарський засіб Енхерту вводили шляхом внутрішньовенної інфузії у дозі 6,4 мг/кг один раз на три тижні до прогресування захворювання, летального результату, відкликання згоди чи розвитку неприйнятної токсичності. Первинним критерієм ефективності була підтверджена ЧОВ за оцінкою ICR відповідно до критеріїв RECIST, версія 1.1. Вторинними кінцевими точками були ТВ та ЗВ.
Демографічні дані пацієнтів та вихідні характеристики захворювання 79 учасників дослідження DESTINY-Gastric02 були такими: середній вік – 61 рік (діапазон від 20 до 78 років); 72 % пацієнтів були чоловічої статі; 87 % – належали до європеоїдної раси, 5,0 % належали до монголоїдної раси та 1,0 % належали до негроїдної раси або афроамериканців. Пацієнти мали статус ECOG або 0 (37 %) або 1 (63 %); у 34 % була аденокарцинома шлунка, а у 66 % — аденокарцинома СШП; 86 % мали IHC 3+, 13 % мали IHC 2+/ISH-позитивний, а у 63 % були метастази у печінці.
Результати оцінки ефективності за показниками ЧОВ та ТВ узагальнено в таблиці 6.
Таблиця 6: Результати оцінки ефективності в дослідженні DESTINY-Gastric02 (популяція для повного аналізу*)
|
Показник ефективності |
DESTINY-Gastric02 N = 79 |
|
Дата припинення збору даних 08 листопада 2021 р. |
|
|
Підтверджена частота об’єктивної відповіді† |
|
|
% (95 % ДІ)‡ |
41,8 (30,8; 53,4) |
|
Повна відповідь, n (%) |
4 (5,1) |
|
Часткова відповідь, n (%) |
29 (36,7) |
|
Тривалість відповіді |
|
|
Медіана§, місяці (95 % ДІ)¶ |
8,1 (5,9; НПО) |
НПО — не піддається оцінюванню.
* Включає всіх пацієнтів, які отримали щонайменше одну дозу лікарського засобу Енхерту.
† За незалежною централізованою оцінкою у сліпому режимі.
‡ Розраховано за методом Клоппера – Пірсона.
§ На основі оцінки за методом Каплана – Маєра.
¶ Розраховано за методом Брукмеєра – Кроулі.
Дослідження DESTINY-Gastric01 (NCT03329690)
Ефективність та безпеку застосування лікарського засобу Енхерту вивчали у дослідженні DESTINY-Gastric01 – багатоцентровому рандомізованому відкритому дослідженні фази 2, яке проводили у дослідницьких центрах Японії та Південної Кореї. У це підтверджувальне дослідження було включено дорослих пацієнтів з місцево поширеною або метастатичною HER2-позитивною аденокарциномою шлунка або СШП, у яких спостерігалося прогресування захворювання після принаймні двох попередніх схем терапії, включно з застосуванням трастузумабу, фторпіримідину та препарату платини. Пацієнти були рандомізовані у співвідношенні 2:1 до групи застосування лікарського засобу Енхерту (N = 126) або хіміотерапії на вибір лікаря: іринотекан (N = 55) або паклітаксел (N = 7). Для зразків пухлин необхідно було отримати підтверджений у центральній лабораторії HER2-позитивний статус, визначений як IHC 3+ або IHC 2+/ISH-позитивний. У дослідження не включали пацієнтів з наявністю в анамнезі лікування глюкокортикостероїдами з приводу ІХЛ/пневмоніту або з наявністю ІХЛ/пневмоніту при скринінгу, пацієнтів з наявністю в анамнезі клінічно значущого захворювання серця, а також пацієнтів з активними метастазами в головний мозок. Лікування проводилося до прогресування захворювання, летального результату, відкликання згоди чи розвитку неприйнятної токсичності. Первинним критерієм ефективності була непідтверджена ЧОВ за оцінкою ICR відповідно до критеріїв RECIST, версія 1.1. Вторинними критеріями ефективності були загальна виживаність (ЗВ), виживаність без прогресування (ВБП), ТВ та підтверджена ЧОВ.
Демографічні дані пацієнтів та вихідні характеристики захворювання були подібними у всіх групах лікування. Медіана віку 188 пацієнтів становила 66 років (діапазон від 28 до 82 років); 76 % учасників були чоловіками; 100 % – належали до монголоїдної раси. Пацієнти мали функціональний статус за шкалою ECOG 0 (49 %) або 1 (51 %); у 87 % була аденокарцинома шлунка, у 13 % – аденокарцинома СШП; 76 % мали IHC 3+ та 23 % мали IHC 2+/ISH-позитивний статус; у 54 % були метастази у печінці; у 29 % – метастази у легені; сума діаметрів усіх цільових вогнищ становила < 5 см у 47 %, від ≥ 5 до < 10 см у 30 % та ≥ 10 см у 17 %; 55 % отримали дві та 45 % – три або більше попередні схеми терапії при місцево поширеному або метастатичному захворюванні.
Результати ефективності (дата припинення збору даних 03 червня 2020 р.) застосування лікарського засобу Енхерту (n = 126) порівнянно з хіміотерапією на вибір лікаря (n = 62) були підтверджені ЧОВ 39,7 % (95 % ДІ 31,1; 48,8) та 11,3 % (95 % ДІ 4,7; 21,9). Кількість пацієнтів з повною відповіддю становила 7,9 % та 0 %, а з частковою відповіддю — 31,7 % та 11,3 %. Додатковими результатами ефективності застосування лікарського засобу Енхерту порівнянно з хіміотерапією на вибір лікаря були медіана ТВ 12,5 місяця (95 % ДІ 5,6; НПО) порівнянно з 3,9 місяця (95 % ДІ 3,0; 4,9). Медіана ВБП становила 5,6 місяця (95 % ДІ 4,3; 6,9) порівнянно з 3,5 місяця (95 % ДІ 2,0; 4,3; відношення ризиків = 0,47 [95 % ДІ 0,3; 1; 0,71]). Аналіз ЗВ, попередньо визначеної на рівні 133 випадків смерті, показав покращення виживаності в групі застосування лікарського засобу Енхерту порівнянно з групою терапії за вибором лікаря (відношення ризиків = 0,60). Медіана ЗВ становила 12,5 місяця (95 % ДІ 10,3; 15,2) у групі застосування лікарського засобу Енхерту та 8,9 місяця (95 % ДІ 6,4; 10,4) у групі терапії за вибором лікаря.
Педіатрична популяція
Європейське агентство з лікарських засобів дозволило не подавати результати досліджень в усіх підгрупах пацієнтів дитячого віку з раком молочної залози, НДКРЛ та раком шлунка (інформація про застосування лікарського засобу у педіатричній популяції наведена у розділі «Діти»).
Цей лікарський засіб було зареєстровано так званою схемою «умовного схвалення». Це означає, що очікується отримання додаткових доказів щодо цього лікарського засобу.
Європейське агентство з лікарських засобів щороку розглядатиме будь-яку нову інформацію, що може з’явитися, а виробник у разі необхідності оновлюватиме цю інструкцію.
Фармакокінетика
Всмоктування
Трастузумаб дерукстекан вводять внутрішньовенно. Інші способи застосування лікарського засобу у дослідженнях не вивчалися.
Розподіл
За результатами популяційного фармакокінетичного аналізу розрахований об’єм розподілу центрального компартмента (Vc) трастузумабу дерукстекану та інгібітора топоізомерази I (DXd) становив 2,68 л та 28,0 л відповідно.
Середній рівень зв’язування DXd з білками плазми крові людини in vitro становив приблизно 97 %.
Співвідношення концентрацій DXd у крові та плазмі in vitro становило приблизно 0,6.
Біотрансформація
Трастузумаб дерукстекан піддається внутрішньоклітинному розщепленню лізосомальними ферментами з вивільненням DXd.
Очікується, що гуманізоване моноклональне антитіло IgG1 до рецептора HER2 буде розщеплюватися на невеликі пептиди та амінокислоти катаболічними шляхами аналогічно до ендогенного IgG.
Результати досліджень метаболізму in vitro у мікросомах печінки людини показують, що DXd метаболізується переважно за участю CYP3A4 окислювальним шляхом.
Виведення
За результатами популяційного фармакокінетичного аналізу відомо, що після внутрішньовенного введення трастузумабу дерукстекану пацієнтам з метастатичним HER2-позитивним раком молочної залози, раком молочної залози з низьким рівнем експресії HER2 або НДКРЛ з мутаціями гена HER2 кліренс трастузумабу дерукстекану становив 0,4 л/добу, а кліренс DXd становив 18,4 л/год. У пацієнтів з місцево поширеною або метастатичною аденокарциномою шлунка або СШП кліренс трастузумабу дерукстекану був на 20 % вищим, ніж у пацієнтів з метастатичним HER2-позитивним раком молочної залози. Під час циклу 3 період напіввиведення (t1/2) трастузумабу дерукстекану і вивільненого DXd становив приблизно 7 днів. Спостерігалося помірне накопичення трастузумабу дерукстекану (приблизно на 35 % під час циклу 3 порівняно з циклом 1).
Після внутрішньовенного введення DXd щурам основним шляхом елімінації було виділення в жовч із виведенням через кишечник. DXd був найбільш поширеним компонентом, виявленим у сечі, калі та жовчі. Після внутрішньовенного введення мавпам разової дози трастузумабу дерукстекану (6,4 мг/кг) вивільнений незмінений DXd був найбільш поширеним компонентом, виявленим у сечі та калі. Виведення DXd у людини не вивчалося.
Взаємодії in vitro
Вплив лікарського засобу Енхерту на фармакокінетику інших лікарських засобів
Дослідження in vitro показують, що DXd не пригнічує основні ферменти CYP450, включно з CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6 та 3A. Дослідження in vitro показують, що DXd не пригнічує транспортери OAT1, OAT3, OCT1, OCT2, OATP1B1, OATP1B3, MATE1, MATE2-K, P-gp, BCRP та BSEP.
Вплив інших лікарських засобів на фармакокінетику Енхерту
В умовах in vitro DXd слугував субстратом P-gp, OATP1B1, OATP1B3, MATE2-K, MRP1 та BCRP.
Клінічно значущої взаємодії з лікарськими засобами, які є інгібіторами транспортерів MATE2 K, MRP1, P-gp, OATP1B або BCRP, не очікується (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Лінійність/нелінійність
Експозиція трастузумабу дерукстекану та вивільненого DXd при внутрішньовенному введенні збільшувалася пропорційно дозі в діапазоні доз від 3,2 мг/кг до 8,0 мг/кг (приблизно в 0,6–1,5 раза вище рекомендованої дози) з низькою та середньою міжіндивідуальною варіабельністю. За даними популяційного фармакокінетичного аналізу міжіндивідуальна варіабельність значень кліренсу трастузумабу дерукстекану та DXd становила 24 % та 28 %, відповідно, а центрального об’єму розподілу — 16 % та 55 % відповідно. Міжіндивідуальна варіабельність значень AUC (площа під кривою концентрація-час) трастузумабу дерукстекану та DXd становила приблизно 8 % та 14 % відповідно.
Особливі групи пацієнтів
На підставі результатів популяційного фармакокінетичного аналізу вік (20–96 років), расова та етнічна приналежність, стать та маса тіла пацієнта не мали клінічно значущого впливу на експозицію трастузумабу дерукстекану або вивільненого DXd.
Пацієнти літнього віку
Популяційний ФК аналіз показав, що вік (діапазон 20–96 років) пацієнта не впливав на ФК трастузумабу дерукстекану.
Порушення функції нирок
Спеціальних досліджень за участю пацієнтів із порушенням функції нирок не проводилося. Результати популяційного фармакокінетичного аналізу з включенням пацієнтів з порушенням функції нирок легкого ступеня (кліренс креатиніну [КК] ≥ 60 та < 90 мл/хв) або середнього (КК ≥ 30 та < 60 мл/хв; значення КК розраховували за формулою Кокрофта – Голта) ступеня тяжкості показали, що фармакокінетика вивільненого DXd не змінювалася у пацієнтів з порушенням функції нирок від легкого до середнього ступеня тяжкості порівняно з фармакокінетикою у осіб з нормальною функцією нирок (КК ≥ 90 мл/хв).
Порушення функції печінки
Спеціальних досліджень за участю пацієнтів із порушенням функції печінки не проводилося. На підставі результатів популяційного фармакокінетичного аналізу визначено, що вплив на зміни фармакокінетики трастузумабу дерукстекану у пацієнтів із загальним білірубіном ≤ 1,5 раза ВМН, незалежно від рівня АСТ, не є клінічно значущим. Дані щодо пацієнтів із загальним білірубіном > 1,5–3 рази ВМН, незалежно від рівня АСТ, недостатні для того, щоб робити висновки, а даних щодо пацієнтів із загальним білірубіном > 3 разів ВМН, незалежно від рівня АСТ, немає (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Діти
Дослідження фармакокінетики трастузумабу дерукстекану у дітей не проводилися.
Клінічні характеристики
Показання
Рак молочної залози
HER2-позитивний рак молочної залози
Монотерапія лікарським засобом Енхерту показана для лікування дорослих пацієнтів з нерезектабельним або метастатичним HER2-позитивним раком молочної залози, які раніше отримали одну або кілька схем терапії на основі анти-HER2 препаратів.
Рак молочної залози з низьким рівнем експресії HER2
Монотерапія лікарським засобом Енхерту показана для лікування дорослих пацієнтів з нерезектабельним або метастатичним раком молочної залози з низьким рівнем експресії HER2, які раніше отримували хіміотерапію при метастазуванні або в яких розвинувся рецидив під час або протягом 6 місяців після завершення ад’ювантної хіміотерапії (див. розділ «Спосіб застосування та дози»).
Недрібноклітинний рак легень (НДКРЛ)
Монотерапія лікарським засобом Енхерту показана для лікування дорослих пацієнтів з поширеним НДКРЛ, у пухлинах яких наявна активуюча мутація HER2 (ERBB2) і яким потрібна системна терапія після хіміотерапії на основі препаратів платини з імунотерапією або без неї.
Рак шлунка
Монотерапія лікарським засобом Енхерту показана для лікування дорослих пацієнтів з поширеною HER2-позитивною аденокарциномою шлунка або стравохідно-шлункового переходу (СШП), які раніше отримували лікування на основі трастузумабу.
Протипоказання
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин, зазначених у розділі «Склад».
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Одночасне застосування з ритонавіром, інгібітором OATP1B, CYP3A та P-gp, або з ітраконазолом, сильним інгібітором CYP3A та P-gp, не призвело до клінічно значущого (приблизно на 10–20 %) збільшення впливу трастузумабу дерукстекану або вивільненого інгібітора топоізомерази I DXd. При одночасному застосуванні трастузумабу дерукстекану з лікарськими засобами, які не є інгібіторами CYP3A, OATP1B або P-gp-транспортерів, корекція дози не потрібна (див. розділ «Фармакологічні властивості»).
Особливості застосування
Щоб виключити помилкове застосування, важливо перевірити етикетки на флаконах та переконатися, що приготовано для застосування лікарський засіб Енхерту (трастузумаб дерукстекан), а не трастузумаб або трастузумаб емтанзин.
Відстеження
Щоб полегшити відстеження біологічних лікарських засобів, необхідно чітко зазначати назву та номер серії лікарського засобу, що застосовувався, у медичній документації пацієнта.
Інтерстиціальна хвороба легень/пневмоніт
При застосуванні лікарського засобу Енхерту були зареєстровані випадки інтерстиціальної хвороби легень (ІХЛ) та/або пневмоніту (див. розділ «Побічні реакції»). Було зареєстровано летальні наслідки. Пацієнтам слід рекомендувати негайно повідомляти про кашель, задишку, лихоманку та/або про будь-які нові або посилення наявних симптомів з боку дихальної системи. За станом пацієнтів потрібно спостерігати щодо появи ознак та симптомів ІХЛ/пневмоніту. Необхідно негайно провести обстеження пацієнта у разі наявності ознак ІХЛ/пневмоніту. Пацієнтам із підозрою на ІХЛ/пневмоніт необхідно провести рентгенографію органів грудної клітки, бажано комп’ютерну томографію (КТ). Слід розглянути можливість консультації із пульмонологом. При безсимптомному перебігу ІХЛ/пневмоніту (1 ступінь тяжкості) слід розглянути можливість застосування кортикостероїдів (наприклад, преднізолон у дозі ≥ 0,5 мг/кг/добу або інший препарат в еквівалентній дозі). Введення лікарського засобу Енхерту слід відкласти доти, доки тяжкість побічної реакції не знизиться до ступеня 0, і тоді можна відновити лікування відповідно до рекомендацій, наведених у таблиці 8 (див. розділ «Спосіб застосування та дози»). При ІХЛ/пневмоніті з наявністю симптомів (2 ступінь тяжкості або більше) слід негайно розпочати системну терапію кортикостероїдами (наприклад, преднізолон у дозі ≥ 1 мг/кг/добу або інший препарат в еквівалентній дозі) та продовжувати її протягом не менше 14 днів з наступним поступовим зниженням дози протягом щонайменше 4 тижнів. У разі підтвердження діагнозу ІХЛ/пневмоніту з наявністю симптомів (2 ступінь тяжкості або більше) слід припинити застосування лікарського засобу Енхерту (див. розділ «Спосіб застосування та дози»). Пацієнти з наявністю в анамнезі ІХЛ/пневмоніту або пацієнти з порушенням функції нирок середнього або тяжкого ступеня можуть мати підвищений ризик розвитку ІХЛ/пневмоніту та повинні бути під ретельним медичним наглядом (див. розділ «Спосіб застосування та дози»).
Нейтропенія
У клінічних дослідженнях при застосуванні лікарського засобу Енхерту були зареєстровані випадки нейтропенії, включно з фебрильною нейтропенією з летальним наслідком. Перед початком застосування лікарського засобу Енхерту та перед введенням кожної наступної дози, а також за клінічними показаннями слід контролювати показники загального аналізу крові. Залежно від ступеня тяжкості нейтропенії може бути необхідно припинити терапію або знизити дозу лікарського засобу Енхерту (див. розділ «Спосіб застосування та дози»).
Зниження фракції викиду лівого шлуночка
При застосуванні анти-HER2 лікарських засобів спостерігалося зниження фракції викиду лівого шлуночка (ФВЛШ). Стандартне дослідження функції серця (ехокардіограма або дослідження MUGA [радіоізотопна вентрикулографія]) слід проводити для оцінки ФВЛШ до початку застосування лікарського засобу Енхерту та через регулярні проміжки часу під час лікування за клінічними показаннями. Зниження ФВЛШ слід усувати шляхом переривання лікування. Застосування лікарського засобу Енхерту слід повністю припинити у разі підтвердження ФВЛШ менше ніж 40 % або абсолютного зниження показника на понад 20 % від вихідного рівня. Слід повністю припинити застосування лікарського засобу Енхерту пацієнтам із застійною серцевою недостатністю (ЗСН) із симптомами (див. таблицю 8 у розділі «Спосіб застосування та дози»).
Ембріофетальна токсичність
Застосування лікарського засобу Енхерту під час вагітності може завдати шкоди плоду. Згідно з повідомленнями, отриманими в післяреєстраційний період, використання трастузумабу, блокатора рецепторів HER2, під час вагітності спричиняло маловоддя, яке призводило до летальної гіпоплазії легень, аномалій скелета та смерті новонароджених. На підставі даних, отриманих у дослідженнях на тваринах, і наявних знань про механізм дії лікарського засобу Енхерту передбачається, що інгібітор топоізомерази I DXd, який входить до його складу, також може завдати шкоди ембріону і плоду при введенні лікарського засобу вагітній жінці (див. розділ «Застосування у період вагітності або годування груддю»).
До початку застосування лікарського засобу Енхерту у пацієнток репродуктивного віку слід виключити вагітність. Пацієнтки повинні бути проінформовані про потенційні ризики для плода. Пацієнткам репродуктивного віку слід рекомендувати використовувати ефективну контрацепцію під час лікування та протягом щонайменше 7 місяців після введення останньої дози лікарського засобу Енхерту. Пацієнтам чоловічої статі, які ведуть статеве життя з жінками репродуктивного віку, слід рекомендувати використовувати ефективну контрацепцію під час лікування та протягом не менше ніж 4 місяця після введення останньої дози лікарського засобу Енхерту (див. розділ «Застосування у період вагітності або годування груддю»).
Пацієнти з порушенням функції печінки середнього або тяжкого ступеня
Дані про пацієнтів із порушенням функції печінки середнього ступеня обмежені, про пацієнтів із порушенням функції печінки тяжкого ступеня — відсутні. Оскільки метаболізм та виведення з жовчю є основними шляхами виведення інгібітора топоізомерази I (DXd), лікарський засіб Енхерту слід з обережністю призначати пацієнтам із порушенням функції печінки середнього або тяжкого ступеня (див. розділи «Спосіб застосування та дози» та «Фармакологічні властивості»).
Застосування у період вагітності або годування груддю
Жінки репродуктивного віку/контрацепція у чоловіків та жінок
До початку застосування лікарського засобу Енхерту у пацієнток репродуктивного віку слід виключити вагітність.
Жінки репродуктивного віку повинні використовувати ефективну контрацепцію під час терапії лікарським засобом Енхерту та впродовж принаймні 7 місяців після її завершення.
Пацієнтам чоловічої статі, які ведуть статеве життя з жінками репродуктивного віку, слід рекомендувати використовувати ефективну контрацепцію під час терапії лікарським засобом Енхерту та впродовж принаймні 4 місяців після її завершення.
Вагітність
Даних про застосування лікарського засобу Енхерту вагітним жінкам немає. Однак застосування трастузумабу, блокатора рецепторів HER2, під час вагітності може завдати шкоди плоду. Згідно з повідомленнями, отриманими в післяреєстраційний період, використання трастузумабу під час вагітності спричиняло маловоддя, яке у деяких випадках призводило до летальної гіпоплазії легень, аномалій скелета та смерті новонароджених. На підставі даних, отриманих у дослідженнях на тваринах, і наявних знань про механізм дії лікарського засобу Енхерту передбачається, що інгібітор топоізомерази I DXd, що входить до його складу, також може завдати шкоди ембріону і плоду при введенні лікарського засобу вагітній жінці.
Лікарський засіб Енхерту не рекомендується призначати вагітним жінкам. Пацієнтки повинні бути проінформовані про потенційні ризики для плода перед плануванням вагітності. У разі настання вагітності жінка має негайно звернутися до лікаря. Якщо пацієнтка завагітніла під час лікування або протягом 7 місяців після введення останньої дози лікарського засобу Енхерту, рекомендовано ретельне спостереження.
Годування груддю
Невідомо, чи потрапляє трастузумаб дерукстекан у грудне молоко людини. IgG людини виділяється у грудне молоко людини, а ймовірність його всмоктування та виникнення серйозних побічних реакцій у немовляти невідома. Тому жінкам не слід годувати груддю під час лікування лікарським засобом Енхерту та протягом 7 місяців після застосування останньої дози. Рішення щодо припинення годування груддю або припинення терапії лікарським засобом слід приймати, враховуючи користь годування груддю для дитини та/або користь терапії лікарським засобом Енхерту для жінки.
Фертильність
Спеціальних досліджень фертильності із застосуванням трастузумабу дерукстекану не проводилося. З огляду на результати досліджень токсичності на тваринах лікарський засіб Енхерту може призводити до порушень репродуктивної функції та фертильності. Невідомо, чи виділяється трастузумаб дерукстекан або його метаболіти в сім’яну рідину. Перед початком лікування пацієнтам чоловічої статі слід порадити звернутися за консультацією щодо кріоконсервації сперми. Пацієнти чоловічої статі не повинні здавати сперму для кріоконсервації або бути її донорами протягом усього періоду лікування та не менше ніж 4 місяці після введення останньої дози лікарського засобу Енхерту.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Лікарський засіб Енхерту може мати незначний вплив на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами. Пацієнтам слід рекомендувати бути обережними під час керування автотранспортом та роботи з іншими механізмами, якщо вони відчувають підвищену стомлюваність, головний біль або запаморочення під час терапії лікарським засобом Енхерту (див. розділ «Побічні реакції»).
Спосіб застосування та дози
Лікарський засіб Енхерту має призначатися лікарем та застосовуватися під наглядом медичного працівника, який має досвід застосування протипухлинних лікарських засобів. Щоб виключити помилкове застосування, важливо перевірити етикетки на флаконах та переконатися, що приготовано для застосування лікарський засіб Енхерту (трастузумаб дерукстекан), а не трастузумаб або трастузумаб емтанзин.
Лікарський засіб Енхерту не слід замінювати на трастузумаб або трастузумаб емтанзин.
Відбір пацієнтів
HER2-позитивний рак молочної залози
У пацієнтів, які отримують трастузумаб дерукстекан для лікування раку молочної залози, повинен бути документально підтверджений HER2-позитивний статус пухлини, визначений за результатами імуногістохімічного (IHC) аналізу як 3+ бали або аналізу методом гібридизації in situ (ISH) зі співвідношенням ≥ 2,0 чи методом флуоресцентної гібридизації in situ (FISH), оціненої за допомогою медичного виробу для діагностики in vitro (in vitro diagnostic (IVD)) з маркуванням CE. Якщо IVD з маркуванням CE недоступно, статус HER2 необхідно оцінювати за допомогою альтернативного валідованого тесту.
Рак молочної залози з низьким рівнем експресії HER2
У пацієнтів, які отримують трастузумаб дерукстекан, повинен бути документально підтверджений статус пухлини з низьким рівнем експресії HER2, визначений за результатами IHC як 1+ або IHC 2+/ISH-, оцінений за допомогою медичного виробу для IVD. Якщо IVD з маркуванням CE недоступний, статус HER2 необхідно оцінювати за допомогою альтернативного валідованого тесту (див. розділ «Фармакодинаміка»).
НДКРЛ
У пацієнтів, які отримують трастузумаб дерукстекан для лікування поширеного НДКРЛ, у пухлинах має бути наявна активуюча мутація HER2 (ERBB2), виявлена за допомогою медичного виробу для діагностики in vitro (IVD) з маркуванням CE. Якщо IVD з маркуванням CE недоступно, статус мутації HER2 необхідно оцінювати за допомогою альтернативного валідованого тесту.
Рак шлунка
У пацієнтів, які отримують трастузумаб дерукстекан для лікування раку шлунка або стравохідно-шлункового переходу, повинен бути документально підтверджений HER2-позитивний статус пухлини, визначений за результатами імуногістохімічного (IHC) аналізу як 3+ бали або аналізу методом гібридизації in situ (ISH) зі співвідношенням ≥ 2 чи методом флуоресцентної гібридизації in situ (FISH), оціненої за допомогою медичного виробу для діагностики in vitro (IVD) з маркуванням CE. Якщо IVD з маркуванням CE недоступно, статус HER2 необхідно оцінювати за допомогою альтернативного валідованого тесту.
Дозування
Рак молочної залози
Рекомендована доза лікарського засобу Енхерту становить 5,4 мг/кг, що вводиться шляхом внутрішньовенної інфузії кожні 3 тижні (цикли лікування тривалістю 21 день) до прогресування захворювання або розвитку непереносимої токсичності.
НДКРЛ
Рекомендована доза лікарського засобу Енхерту становить 5,4 мг/кг, що вводиться шляхом внутрішньовенної інфузії кожні 3 тижні (цикли лікування тривалістю 21 день) до прогресування захворювання або розвитку непереносимої токсичності.
Рак шлунка
Рекомендована доза лікарського засобу Енхерту становить 6,4 мг/кг, що вводиться шляхом внутрішньовенної інфузії кожні 3 тижні (цикли лікування тривалістю 21 день) до прогресування захворювання або розвитку непереносимої токсичності.
Початкову дозу слід вводити шляхом внутрішньовенної інфузії тривалістю 90 хвилин. Якщо попередня інфузія добре переносилася, тривалість подальших інфузій лікарського засобу Енхерту може становити 30 хвилин.
Якщо у пацієнта розвиваються симптоми, пов’язані з інфузією, необхідно зменшити швидкість інфузії або припинити введення лікарського засобу Енхерту (див. розділ «Побічні реакції»). У разі розвитку тяжких реакцій, пов’язаних з інфузією, введення лікарського засобу Енхерту слід повністю припинити.
Премедикація
Лікарський засіб Енхерту є еметогенним (див. розділ «Побічні реакції»), що передбачає можливе виникнення відстроченої нудоти та/або блювання. Перед кожним введенням лікарського засобу Енхерту пацієнтам слід проводити премедикацію комбінацією двох або трьох лікарських засобів (наприклад дексаметазоном у комбінації з антагоністом 5-HT3 рецепторів та/або антагоністом NK1 рецепторів, а також з іншими необхідними лікарськими засобами) для профілактики нудоти та блювання, спричинених хіміотерапією.
Модифікації дози
Лікування побічних реакцій може потребувати тимчасового припинення терапії, зниження дози або припинення терапії лікарським засобом Енхерту відповідно до рекомендацій, наведених у таблицях 7 та 8.
У разі зниження дози лікарського засобу Енхерту не слід повторно збільшувати його дозу.
Таблиця 7: Схема зменшення дози
|
Схема зменшення дози |
Рак молочної залози та НДКРЛ |
Рак шлунка |
|
Рекомендована початкова доза |
5,4 мг/кг |
6,4 мг/кг |
|
Перше зменшення дози |
4,4 мг/кг |
5,4 мг/кг |
|
Друге зменшення дози |
3,2 мг/кг |
4,4 мг/кг |
|
Потреба подальшого зменшення дози |
Припинення лікування |
Припинення лікування |
Таблиця 8: Коригування дози в разі побічних реакцій
|
Побічна реакція |
Ступінь тяжкості |
Коригування схеми лікування |
|
|
Інтерстиціальна хвороба легень (ІХЛ)/пневмоніт |
Безсимптомна ІХЛ/пневмоніт (1 ступінь тяжкості) |
Призупинити терапію лікарським засобом Енхерту, поки тяжкість побічної реакції не зменшиться до ступеня 0, потім: у разі зникнення побічної реакції протягом 28 днів або менше від дня їх виникнення рекомендується відновити терапію в попередній дозі; у разі зникнення побічної реакції протягом більше ніж 28 днів від дня їх виникнення рекомендується зниження дози на один рівень (див. таблицю 7); у разі підозри на ІХЛ/пневмоніт слід розглянути негайне призначення глюкокортикостероїдів (див. розділ «Особливості застосування»). |
|
|
ІХЛ/пневмоніт із симптомами (2 ступінь тяжкості або більший) |
Повністю припинити застосування лікарського засобу Енхерту. У разі підозри на ІХЛ/пневмоніт слід негайно призначити глюкокортикостероїди (див. розділ «Особливості застосування»). |
||
|
Нейтропенія |
3 ступінь тяжкості (менше ніж 1,0–0,5 × 109/л) |
Призупинити терапію лікарським засобом Енхерту, поки тяжкість побічної реакції не зменшиться до ступеня 2 або менше, потім відновити терапію в попередній дозі. |
|
|
4 ступінь тяжкості (менше ніж 0,5 × 109/л) |
Призупинити терапію лікарським засобом Енхерту, поки тяжкість побічної реакції не зменшиться до ступеня 2 або менше. Знизити дозу на один рівень (див. таблицю 7). |
||
|
Фебрильна нейтропенія |
Зниження абсолютної кількості нейтрофілів до рівня менше ніж 1,0 × 109/л та підвищення температури тіла вище 38,3 °C або стійка температура 38 °C та вище протягом більш ніж однієї години. |
Рекомендується призупинити застосування лікарського засобу Енхерту до зникнення побічної реакції. Знизити дозу на один рівень (див. таблицю 7). |
|
|
Зниження фракції викиду лівого шлуночка (ФВЛШ) |
ФВЛШ понад 45 % та абсолютне зниження від вихідного рівня на 10 – 20 % |
Рекомендується продовжувати застосування лікарського засобу Енхерту. |
|
|
ФВЛШ від 40 % до 45 % |
та абсолютне зниження показника на менше ніж 10 % від вихідного рівня |
Рекомендується продовжувати застосування лікарського засобу Енхерту. Провести повторну оцінку ФВЛШ протягом 3 тижнів. |
|
|
та абсолютне зниження показника на 10–20 % від вихідного рівня |
Рекомендується призупинити застосування лікарського засобу Енхерту. Провести повторну оцінку ФВЛШ протягом 3 тижнів. Якщо показник ФВЛШ не відновлюється до значень, які були до його зменшення не більше ніж на10 % від вихідного рівня, рекомендується повністю припинити застосування лікарського засобу Енхерту. Якщо показник ФВЛШ відновлюється до значень, які були до його зменшення не більше на 10 % від вихідного рівня, рекомендується відновити застосування лікарського засобу Енхерту у тій самій дозі. |
||
|
ФВЛШ менше ніж 40 % або абсолютне зниження від вихідного рівня на понад 20 % |
Рекомендується призупинити застосування лікарського засобу Енхерту. Провести повторну оцінку ФВЛШ протягом 3 тижнів. У разі підтвердження ФВЛШ менше ніж 40 % або абсолютного зниження цього показника на понад 20 % від вихідного рівня необхідно припинити застосування лікарського засобу Енхерту. |
||
|
Застійна серцева недостатність (ЗСН) із симптомами |
Повністю припинити застосування лікарського засобу Енхерту. |
||
Ступінь тяжкості токсичності зазначена відповідно до Загальних критеріїв термінології для позначення побічних явищ, версія 5.0 (NCI-CTCAE, версія 5.0).
Затримка або пропуск введення дози лікарського засобу
Якщо введення планової дози затримано або пропущено, її слід ввести якомога швидше, не чекаючи наступного запланованого циклу. Графік наступних введень слід скоригувати так, щоб підтримувати 3-тижневий інтервал між введенням доз. Лікарський засіб слід вводити у тій самій дозі та з тією самою швидкістю, за яких пацієнт добре переносив останню інфузію.
Особливі групи пацієнтів
Пацієнти літнього віку
Пацієнтам віком від 65 років корекція дози лікарського засобу Енхерту не потрібна. Наявні обмежені дані щодо застосування лікарського засобу пацієнтам віком ≥ 75 років.
Порушення функції нирок
Для пацієнтів з порушенням функції нирок легкого (кліренс креатиніну [КК] ≥ 60 та < 90 мл/хв) або середнього (КК ≥ 30 та < 60 мл/хв) ступеня тяжкості корекція дози не потрібна (див. розділ «Фармакологічні властивості»). Потенційну необхідність коригування дози для пацієнтів з порушенням функції нирок тяжкого ступеня або термінальною стадією хвороби нирок визначити неможливо, оскільки порушення функції нирок тяжкого ступеня було критерієм невключення у клінічні дослідження. У пацієнтів з порушенням функції нирок середнього ступеня тяжкості частіше відзначалося виникнення ІХЛ/пневмоніту 1 або 2 ступеня тяжкості. У пацієнтів з порушенням функції нирок середнього ступеня на вихідному рівні, які отримували лікарський засіб Енхерту у дозі 6,4 мг/кг, частота серйозних побічних реакцій була вищою, ніж у пацієнтів з нормальною нирковою функцією. Пацієнти з порушенням функції нирок середнього або тяжкого ступеня повинні перебувати під ретельним наглядом щодо розвитку побічних реакцій, зокрема ІХЛ/пневмоніту (див. розділ «Особливості застосування»).
Порушення функції печінки
Пацієнтам із концентрацією загального білірубіну ≤ 1,5 раза верхньої межі норми (ВМН) корекція дози не потрібна, незалежно від рівня аспартатамінотрансферази (АСТ). Потенційна необхідність корекції дози для пацієнтів із концентрацією загального білірубіну > 1,5 раза ВМН, незалежно від рівня АСТ, не може бути визначена через обмеженість даних; тому ці пацієнти повинні перебувати під ретельним наглядом (див. розділи «Особливості застосування» та «Фармакологічні властивості»).
Спосіб застосування
Лікарський засіб Енхерту призначений для внутрішньовенного введення. Приготування концентрату, приготування розчину для інфузій та введення цього лікарського засобу шляхом внутрішньовенної інфузії має здійснювати медичний працівник. Лікарський засіб Енхерту не можна вводити внутрішньовенно струминно або болюсно.
Інструкції з приготування концентрату для розчину для інфузій та розведення лікарського засобу перед застосуванням
Щоб виключити помилкове застосування, важливо перевірити етикетки на флаконах та переконатися, що приготовано для застосування лікарський засіб Енхерту (трастузумаб дерукстекан), а не трастузумаб або трастузумаб емтанзин.
Слід виконувати відповідні процедури для приготування хіміотерапевтичних лікарських засобів. Також слід дотримуватися необхідних асептичних умов при проведені зазначених нижче процедур відновлення та розведення розчину.
Приготування концентрату для розчину для інфузій
- Приготування концентрату необхідно виконувати безпосередньо перед розведенням.
- Для отримання повної дози може бути потрібно більше одного флакона зі стерильним ліофілізованим порошком. Слід розрахувати дозу (міліграмах), загальний об’єм необхідного концентрату лікарського засобу Енхерту та необхідну кількість флаконів лікарського засобу Енхерту.
- Для відновлення вмісту флакона для отримання дози 100 мг трастузумабу дерукстекану, у флакон стерильним шприцом повільно вводять 5 мл води для ін’єкцій до отримання кінцевої концентрації 20 мг/мл.
- Обережно перемішують вміст флакона до повного відновлення. Не струшувати.
- Якщо приготований концентрат лікарського засобу Енхерту не був використаний відразу, його слід зберігати в холодильнику при температурі від 2 до 8 °C до 24 годин з моменту приготування концентрату у захищеному від дії світла місці. Не заморожувати.
- Відновлений лікарський засіб не містить консервантів та призначений тільки для одноразового застосування.
Розведення
- Розрахований об’єм концентрату набирають із флакона(ів) за допомогою стерильного шприца. Перевіряють концентрат на наявність твердих часток і змін кольору. Розчин має бути прозорим та безбарвним або світло-жовтого кольору. Не використовуйте розчин, якщо в ньому є сторонні частки або якщо розчин виглядає каламутним чи його колір змінився.
- Розрахований об’єм концентрату лікарського засобу Енхерту розчиняють в пакеті для інфузій, що містить 100 мл 5 % розчину глюкози. Не використовуйте розчин натрію хлориду (див. розділ «Несумісність»). Рекомендується використовувати пакет для інфузій з полівінілхлориду або поліолефіну (сополімер етилену та поліпропілену).
- Обережно перевертають пакет для інфузій, щоб ретельно перемішати розчин. Не струшувати.
- Слід накрити пакет для інфузій для захисту від дії світла.
- Якщо приготований розчин не був використаний відразу, його слід зберігати при кімнатній температурі не більше ніж 4 години, включно з часом приготування концентрату та проведення інфузії, або в холодильнику при температурі від 2 до 8 °C до 24 годин у захищеному від дії світла місці. Не заморожувати.
- Невикористану частину, що залишилася у флаконі, потрібно утилізувати.
Введення
- Якщо приготовлений розчин для інфузій зберігався в холодильнику (при температурі від 2 до 8 °C), перед введенням рекомендується довести розчин до кімнатної температури в захищеному від дії світла місці.
- Лікарський засіб Енхерту слід вводити шляхом внутрішньовенної інфузії лише з використанням вбудованого фільтра (0,20 або 0,22 мкм) з поліефірсульфону (ПЕС) або полісульфону (ПС).
- Початкову дозу слід вводити шляхом внутрішньовенної інфузії тривалістю 90 хвилин. Якщо попередня інфузія добре переносилася, тривалість подальших інфузій лікарського засобу Енхерту може становити 30 хвилин. Лікарський засіб не можна вводити внутрішньовенно струминно або болюсно.
- Необхідно накрити пакет для інфузій для захисту від дії світла.
- Не можна змішувати Енхерту з іншими лікарськими засобами, а також не слід вводити інші лікарські засоби через ту саму систему для внутрішньовенних інфузій.
Утилізація
Будь-який невикористаний лікарський препарат і відходи слід утилізувати згідно з місцевими вимогами.
Діти
Безпека та ефективність застосування лікарського засобу Енхерту дітям (віком до 18 років) ще не встановлені. Дані відсутні.
Передозування
Максимальна переносима доза трастузумабу дерукстекану не визначена. У клінічних дослідженнях не вивчали разові дози, що перевищували 8,0 мг/кг. У разі передозування пацієнти повинні перебувати під пильним медичним наглядом для виявлення можливих ознак або симптомів побічних реакцій і, якщо потрібно, отримувати симптоматичне лікування.
Побічні реакції
▼ Цей лікарський засіб знаходиться під додатковим моніторингом. Це дасть змогу швидко отримувати нову інформацію щодо безпеки. Спеціалістів у галузі охорони здоров’я просять повідомляти про будь-які підозрювані побічні реакції.
Резюме профілю безпеки
Енхерту 5,4 мг/кг
В об’єднаній вибірці було оцінено безпеку застосування лікарського засобу для пацієнтів, які отримали принаймні одну дозу лікарського засобу Енхерту 5,4 мг/кг (n = 1449) у клінічних дослідженнях різних типів пухлин. Медіана тривалості лікування в цій об’єднаній вибірці становила 9,8 місяця (діапазон 0,7–45,1 місяця).
Найбільш частими побічними реакціями були нудота (75,0 %), втомлюваність (57,3 %), блювання (42,1 %), алопеція (37,6 %), нейтропенія (35,2 %), закреп (35,0 %), анемія (34.4 %), зниження апетиту (33,1 %), діарея (28,8 %), підвищення рівня трансаміназ (26,5 %), м’язово-скелетний біль (26,2 %), тромбоцитопенія (24,5 %) та лейкопенія (23,7 %).
Найбільш частими побічними реакціями 3 або 4 ступеня тяжкості відповідно до Загальних критерії термінології для позначення побічних явищ Національного інституту раку США (NCI-CTCAE версії 5.0) були нейтропенія (17,0 %), анемія (9,5 %), втомлюваність (8,4 %), лейкопенія (6,4 %), нудота (5,9 %), тромбоцитопенія (5,0 %), лімфопенія (4,8 %), гіпокаліємія (3,8 %), підвищення рівня трансаміназ (3,6 %), блювання (2,7 %), діарея (2,0 %), зниження апетиту (1,7 %), пневмонія (1,4 %) та зниження фракції викиду (1,1 %). Побічні реакції 5 ступеня виникли у 1,4 % пацієнтів, включно з ІХЛ (1,0 %).
Тимчасове припинення лікування через побічні реакції виникло у 34,3 % пацієнтів, які отримували лікарський засіб Енхерту. Найбільш частими побічними реакціями, пов’язаними з тимчасовим припиненням лікування, були нейтропенія (13,3 %), втомлюваність (5,0 %), анемія (4,7 %), лейкопенія (3,7 %), тромбоцитопенія (3,0 %), інфекція верхніх дихальних шляхів (2,7 %) та ІХЛ (2,6 %). Зниження дози реєструвалося у 20,6 % пацієнтів, які отримували лікарський засіб Енхерту. Найбільш частими побічними реакціями, пов’язаними зі зниженням дози, були втомлюваність (5,0 %), нудота (4,9 %), нейтропенія (3,5 %) та тромбоцитопенія (2,1 %). Припинення лікування через побічні реакції виникло у 13,0 % пацієнтів, які отримували лікарський засіб Енхерту. Найбільш частою побічною реакцією, пов’язаною з остаточним припиненням лікування, була ІХЛ (9,2 %).
Енхерту 6,4 мг/кг
В об’єднаній вибірці для оцінки безпеки проводили оцінку пацієнтів, які отримали принаймні одну дозу лікарського засобу Енхерту 6,4 мг/кг (n = 669) у клінічних дослідженнях різних типів пухлин. Медіана тривалості лікування в цій об’єднаній вибірці становила 5,7 місяців (діапазон: 0,7–41,0 місяців).
Найбільш частими побічними реакціями були нудота (72,2 %), втомлюваність (58,4 %), зниження апетиту (53,5 %), анемія (44,7 %), нейтропенія (43,5 %), блювання (40,1 %), діарея (35,9 %), алопеція (35,4 %), запор (32,3 %), тромбоцитопенія (30,8 %), лейкопенія (29,3 %) та підвищення рівня трансаміназ (24,2 %).
Найбільш частими побічними реакціями 3 або 4 ступеня тяжкості відповідно до Загальних критеріїв термінології для позначення побічних явищ Національного інституту раку США (NCI-CTCAE, версія 5.0) були нейтропенія (28,7 %), анемія (22,6 %), лейкопенія (13,3 %), тромбоцитопенія (9,1 %), втомлюваність (8,4 %), зниження апетиту (7,8 %), лімфопенія (6,9 %), нудота (5,8 %), підвищення рівня трансаміназ (4,3 %), гіпокаліємія (4,3 %), пневмонія (3,1 %), фебрильна нейтропенія (2,8 %), блювання (2,4 %), діарея (2,2 %), зниження маси тіла (1,9 %), підвищення рівня лужної фосфатази в крові (1,6 %), інтерстиціальна хвороба легень (ІХЛ, 1,5 %), задишка (1,2 %), зниження фракції викиду (1,2 %) та підвищення рівня білірубіну в крові (1,2 %). Побічні реакції 5 ступеня, включно з ІХЛ (2,1 %) виникли, у 2,7 % пацієнтів.
Тимчасове припинення лікування через побічні реакції виникло у 40,7 % пацієнтів, які отримували лікарський засіб Енхерту. Найбільш частими побічними реакціями, пов’язаними з тимчасовим припиненням лікування, були нейтропенія (16,6 %), анемія (7,8 %), втомлюваність (5,7 %), ІХЛ (4,8 %), лейкопенія (4,2 %), зниження апетиту (3,7 %), пневмонія (3,6 %), інфекція верхніх дихальних шляхів (3,4 %) та тромбоцитопенія (3,1 %). Зниження дози реєструвалося у 31,1 % пацієнтів, які отримували лікарський засіб Енхерту. Найбільш частими побічними реакціями, пов’язаними зі зниженням дози, були втомлюваність (10,6 %), нейтропенія (6,6 %), нудота (6,4 %), зниження апетиту (5,4 %) та тромбоцитопенія (3,0 %). Припинення лікування через побічні реакції виникло у 17,6 % пацієнтів, які отримували лікарський засіб Енхерту. Найбільш частою побічною реакцією, пов’язаною з остаточним припиненням лікування, була ІХЛ (12,9 %).
25,3 % пацієнтів з раком шлунка, які отримували лікарський засіб Енхерту у дозі 6,4 мг/кг (n = 229), проводили переливання крові протягом 28 днів після початку анемії або тромбоцитопенії. Переливання проводилися переважно при анемії.
Перелік побічних реакцій, представлений у формі таблиці
Побічні реакції у пацієнтів, які отримали принаймні одну дозу лікарського засобу Енхерту у клінічних дослідженнях, представлені у таблиці 9. Побічні реакції згруповані за класами систем органів (КСО) відповідно до Медичного словника з питань регуляторної діяльності (MedDRA) та за частотою. Частота виникнення класифікується таким чином: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто (від ≥ 1/1 000 до < 1/100), рідко (від ≥ 1/10 000 до < 1/1 000), дуже рідко (< 1/10 000) та невідомо (не можна визначити за наявними даними). В межах кожної групи побічних реакцій за частотою вони представлені у порядку зменшення серйозності.
Таблиця 9: Побічні реакції у пацієнтів, які отримували трастузумаб дерукстекан у дозі 5,4 мг/кг та 6,4 мг/кг при різних типах пухлин
|
Клас систем органів |
5,4 мг/кг |
6,4 мг/кг |
|
Категорія частоти |
Побічна реакція |
Побічна реакція |
|
Інфекційні та паразитарні захворювання |
||
|
Дуже часто |
інфекція верхніх дихальних шляхівa |
пневмонія, інфекція верхніх дихальних шляхівa |
|
Часто |
пневмонія |
|
|
З боку крові та лімфатичної системи |
||
|
Дуже часто |
анеміяб, нейтропеніяв, тромбоцитопеніяг, лейкопеніяґ, лімфопеніяд |
анеміяб, нейтропеніяв, тромбоцитопеніяг, лейкопеніяґ, лімфопеніяд |
|
Часто |
фебрильна нейтропенія |
|
|
Нечасто |
фебрильна нейтропенія |
|
|
Порушення з боку обміну речовин і харчування |
||
|
Дуже часто |
гіпокалієміяе, зниження апетиту |
гіпокалієміяе, зниження апетиту |
|
Часто |
дегідратація |
дегідратація |
|
Порушення з боку нервової системи |
||
|
Дуже часто |
головний більє, запаморочення |
головний більє, дисгевзія |
|
Часто |
дисгевзія |
запаморочення |
|
Порушення з боку органів зору |
||
|
Часто |
сухість очей, нечіткість зоруж |
сухість очей, нечіткість зоруж |
|
Порушення з боку дихальної системи, органів грудної клітки та середостіння |
||
|
Дуже часто |
інтерстиціальна хвороба легеньз, задишка, кашель, носова кровотеча |
інтерстиціальна хвороба легеньз, задишка, кашель |
|
Часто |
носова кровотеча |
|
|
Порушення з боку шлунково-кишкового тракту |
||
|
Дуже часто |
нудота, блювання, запор, діарея, біль у животіи, стоматитl, диспепсія |
нудота, блювання, діарея, запор, біль у животіи, стоматитl |
|
Часто |
здуття живота, гастрит, метеоризм |
диспепсія, здуття живота, гастрит, метеоризм |
|
Порушення з боку печінки та жовчовивідних шляхів |
||
|
Дуже часто |
підвищення рівня трансаміназї |
підвищення рівня трансаміназї |
|
Порушення з боку шкіри та підшкірної клітковини |
||
|
Дуже часто |
алопеція |
алопеція |
|
Часто |
висипй, свербіж, гіперпігментація шкірик |
висипї, свербіж, гіперпігментація шкірик |
|
Порушення з боку скелетно-м’язової та сполучної тканини |
||
|
Дуже часто |
м’язово-скелетний більл |
м’язово-скелетний більл |
|
Загальні розлади та реакції в місці введення |
||
|
Дуже часто |
втомлюваністьм, пірексія |
втомлюваністьм, пірексія, периферичний набряк |
|
Часто |
периферичний набряк |
|
|
Результати лабораторних та інструментальних досліджень |
||
|
Дуже часто |
зниження фракції викидун, зниження маси тіла |
зниження фракції викидун, зниження маси тіла |
|
Часто |
підвищення рівня лужної фосфатази в крові, підвищення рівня білірубіну в кровіо, підвищення рівня креатиніну в крові |
підвищення рівня лужної фосфатази в крові, підвищення рівня білірубіну в кровіо, підвищення рівня креатиніну в крові |
|
Травми, отруєння та ускладнення процедур |
||
|
Часто |
інфузійні реакціїп |
інфузійні реакціїп |
а Включає грип, грипоподібні стани, назофарингіт, фарингіт, синусит, риніт, ларингіт та інфекції верхніх дихальних шляхів.
б Для всіх типів пухлин при дозі 5,4 мг/кг відзначається анемія, зниження рівня гемоглобіну, зниження кількості еритроцитів та зниження рівня гематокриту. Для всіх типів пухлин при дозі 6,4 мг/кг відзначається анемія, зниження рівня гемоглобіну та зниження кількості еритроцитів.
в Включає нейтропенію та зниження кількості нейтрофілів.
г Включає тромбоцитопенію та зниження кількості тромбоцитів.
ґ Включає лейкопенію та зниження кількості лейкоцитів.
д Включає лімфопенію та зниження кількості лімфоцитів.
е Включає гіпокаліємію та зниження рівня калію в крові.
є Для всіх типів пухлин при дозі 5,4 мг/кг включає головний біль, синусовий головний біль та мігрень. Для всіх типів пухлин при дозі 6,4 мг/кг включає головний біль та мігрень.
ж Включає нечіткість зору та порушення зору.
з Для всіх типів пухлин при дозі 5,4 мг/кг інтерстиціальна хвороба легень включає явища, які були розцінені як ІХЛ: пневмоніт (n = 88), інтерстиціальна хвороба легень (n = 72), організувальна пневмонія (n = 6), пневмонія (n = 4), дихальна недостатність (n = 5), радіаційний пневмоніт (n = 2), альвеоліт (n = 2), легенева токсичність (n = 2), грибкова пневмонія (n = 1), пухлина легені (n = 1), гостра дихальна недостатність (n = 1), інфільтрація легень (n = 1), лімфангіт (n = 1), легеневий фіброз (n = 1), ідіопатична інтерстиціальна пневмонія (n = 1), захворювання легень (n = 1), гіперчутливий пневмоніт (n = 1) та затемнення в легенях (n = 1). Для всіх типів пухлин при дозі 6,4 мг/кг інтерстиціальна хвороба легень включає явища, які були розцінені як ІХЛ: пневмоніт (n = 75), інтерстиціальна хвороба легень (n = 39), організувальна пневмонія (n = 4), дихальна недостатність (n = 4), затемнення в легенях (n = 2), пневмонія (n = 1) та променевий пневмоніт (n = 1).
и Включає дискомфорт у животі, біль у шлунково-кишковому тракті, біль у животі, біль внизу живота та біль у верхній частині живота.
і Для всіх типів пухлин при дозі 5,4 мг/кг включає стоматит, афтозну виразку, виразку слизової оболонки ротової порожнини, ерозію слизової оболонки ротової порожнини та висип на слизовій оболонці ротової порожнини. Для всіх типів пухлин при дозі 6,4 мг/кг включає тільки стоматит.
ї Включає підвищення рівня трансаміназ, підвищення рівня аланінамінотрансферази, підвищення рівня аспартатамінотрансферази, підвищення рівня гамма-глутамілтрансферази, порушення функції печінки, патологічні показники функціональних проб печінки, підвищення показників функціональних проб печінки та гіпертрансаміназемію.
й Для всіх типів пухлин при дозі 5,4 мг/кг включає висип, пустульозний висип, макулопапульозний висип, папульозний висип, макулярний висип і сверблячий висип. Для всіх типів пухлин при дозі 6,4 мг/кг включає висип, пустульозний висип, макулопапульозний висип і сверблячий висип.
к Для всіх типів пухлин при дозі 5,4 мг/кг включає гіперпігментацію шкіри, зміну кольору шкіри та порушення пігментації. Для всіх типів пухлин при дозі 6,4 мг/кг включає гіперпігментацію шкіри та порушення пігментації.
л Включає біль у спині, міалгію, біль у кінцівках, м’язово-скелетний біль, м’язові спазми, біль у кістках, біль у шиї, м’язово-скелетний біль у грудній клітці та дискомфорт у кінцівках.
м Включає астенію, втомлюваність, загальне нездужання та сонливість.
н Для всіх типів пухлин при дозі 5,4 мг/кг термін «зниження фракції викиду» включає лабораторні показники зниження ФВЛШ (n = 214) та/або переважно наступні терміни: зниження фракції викиду (n = 52), серцева недостатність (n = 3), застійна серцева недостатність (n = 1) та дисфункція лівого шлуночка (n = 2). Для всіх типів пухлин при дозі 6,4 мг/кг термін «зниження фракції викиду» включає лабораторні показники зниження ФВЛШ (n = 97) та/або переважно наступні терміни: зниження фракції викиду (n = 11) та дисфункція лівого шлуночка (n = 1).
о Для всіх типів пухлин при дозі 5,4 мг/кг включає підвищення рівня білірубіну в крові, гіпербілірубінемію, підвищення рівня зв’язаного білірубіну та підвищення рівня незв’язаного білірубіну в крові. Для всіх типів пухлин при дозі 6,4 мг/кг включає підвищення рівня білірубіну в крові, гіпербілірубінемію та підвищення рівня зв’язаного білірубіну.
п Для всіх типів пухлин при дозі 5,4 мг/кг випадки інфузійних реакцій включають інфузійну реакцію (n = 16) та гіперчутливість (n = 2). Для всіх типів пухлин при дозі 6,4 мг/кг випадки інфузійних реакцій включають інфузійну реакцію (n = 6) та гіперчутливість (n = 1). Усі випадки інфузійних реакцій були 1 та 2 ступеня тяжкості.
Опис окремих побічних реакцій
Інтерстиціальна хвороба легень/пневмоніт
У клінічних дослідженнях з кількома типами пухлин (n = 1449) при застосуванні лікарського засобу Енхерту у дозі 5,4 мг/кг ІХЛ виникала у 12,5 % пацієнтів. Більшість випадків ІХЛ були 1 (3,2 %) та 2 ступеня (7,4 %) тяжкості. Випадки 3 ступеня тяжкості спостерігалися у 0,8 % пацієнтів, а випадків 4 ступеня не зареєстровано. Явища 5 ступеня (летальні) виникли у 1,0 % пацієнтів. Медіана часу до настання першого явища становила 5,5 місяця (діапазон від 26 днів до 31,5 місяця) (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
У клінічних дослідженнях з кількома типами пухлин (n = 669) при застосуванні лікарського засобу Енхерту у дозі 6,4 мг/кг ІХЛ виникала у 17,9 % пацієнтів. Більшість випадків ІХЛ були 1 (4,9 %) та 2 ступеня (9,4 %) тяжкості. Випадки 3 ступеня тяжкості спостерігалися у 1,3 % пацієнтів, а випадки 4 ступеня — у 0,1 % пацієнтів. Явища 5 ступеня (летальні) виникли у 2,1 % пацієнтів. У одного пацієнта була наявна ІХЛ, яка посилилася після лікування та призвела до ІХЛ 5 ступеня (летальна). Медіана часу до настання першого явища становила 4,2 місяця (діапазон від -0,5 до 21,0) (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Нейтропенія
У клінічних дослідженнях (n = 1449) з кількома типами пухлин при застосуванні лікарського засобу Енхерту у дозі 5,4 мг/кг нейтропенія спостерігалася у 35,2 % пацієнтів, а у 17,0 % – явища були 3 або 4 ступеня тяжкості. Медіана часу до настання нейтропенії становила 43 дні (діапазон від 1 дня до 31,9 місяця), а медіана тривалості першого явища становила 22 дні (діапазон від 1 дня до 17,1 місяця). Фебрильна нейтропенія була зареєстрована у 0,9 % пацієнтів, а 0,1 % мали 5 ступінь (див. розділ «Спосіб застосування та дози»).
У клінічних дослідженнях (n = 669) з кількома типами пухлин при застосуванні лікарського засобу Енхерту у дозі 6,4 мг/кг нейтропенія спостерігалася у 43,5 % пацієнтів, а у 28,7 % – явища були 3 або 4 ступеня тяжкості. Медіана часу до настання явища становила 16 днів (діапазон від 1 дня до 24,8 місяця), та медіана тривалості першого явища становила 9 днів (діапазон від 2 днів до 17,2 місяця). Фебрильна нейтропенія була зареєстрована у 3,0 % пацієнтів, а 0,1 % мали явища 5 ступеня (див. розділ «Спосіб застосування та дози»).
Зниження фракції викиду лівого шлуночка
У клінічних дослідженнях з кількома типами пухлин (n = 1449) при застосуванні лікарського засобу Енхерту у дозі 5,4 мг/кг зниження ФВЛШ було зареєстровано у 57 пацієнтів (3,9 %), з яких у 10 (0,7 %) це явище було 1 ступеня тяжкості, у 40 (2,8 %) – 2 ступеня, а у 7 (0,5 %) — 3 ступеня. За даними лабораторних показників (ехокардіограма або дослідження MUGA) частота випадків зниження ФВЛШ 2 ступеня становила 202/1341 (15,1 %), а 3 ступеня – 12/1341 (0,9 %). Застосування лікарського засобу Енхерту пацієнтам, у яких до початку лікування ФВЛШ була менше ніж 50 %, не вивчалося (див. розділ «Спосіб застосування та дози»).
У клінічних дослідженнях з кількома типами пухлин (n = 669) при застосуванні лікарського засобу Енхерту у дозі 6,4 мг/кг зниження ФВЛШ було зареєстровано у 12 пацієнтів (1,8 %), з яких у 1 (0,1 %) це явище було 1 ступеня тяжкості, у 8 (1,2 %) – 2 ступеня, а у 3 (0,4 %) — 3 ступеня. За даними лабораторних показників (ехокардіограма або дослідження MUGA) частота випадків зниження ФВЛШ 2 ступеня становила 89/597 (14,9 %), а 3 ступеня – 8/597 (1,3 %).
Інфузійні реакції
У клінічних дослідженнях (n = 1449) з кількома типами пухлин при застосуванні лікарського засобу Енхерту у дозі 5,4 мг/кг інфузійні реакції спостерігалися у 18 пацієнтів (1,2 %), усі явища були 1 або 2 ступеня тяжкості. Явищ 3 ступеня тяжкості зареєстровано не було. У трьох випадках (0,2 %) інфузійні реакції призвели до тимчасового припинення лікування, а явищ, які б призвели до повного припинення лікування, не було.
У клінічних дослідженнях (n = 669) з кількома типами пухлин при застосуванні лікарського засобу Енхерту у дозі 6,4 мг/кг інфузійні реакції спостерігалися у 7 пацієнтів (1,0 %), усі явища були 1 або 2 ступеня тяжкості. Явищ 3 ступеня тяжкості зареєстровано не було. В одному випадку (0,1 %) інфузійна реакція призвела до тимчасового припинення лікування, а явищ, які б призвели до повного припинення лікування, не було.
Імуногенність
Як і всі лікарські засоби білкового походження, Енхерту може бути імуногенним. У всьому діапазоні доз, оцінених у клінічних дослідженнях, у 2,1 % (47/2213) пацієнтів після застосування лікарського засобу Енхерту вироблялися антитіла до трастузумабу дерукстекану. Частота появи нейтралізуючих антитіл до трастузумабу дерукстекану під час лікування становила 0,1 % (2/2213). Взаємозв’язку між утворенням антитіл та алергічними реакціями не було виявлено.
Педіатрична популяція
Безпека застосування лікарського засобу Енхерту для цієї популяції не встановлена.
Пацієнти літнього віку
У клінічних дослідженнях (n = 1449) з кількома типами пухлин, в яких лікарський засіб Енхерту застосовували у дозі 5,4 мг/кг, 24,2 % пацієнтів були віком від 65 років, а 4,3 % —віком від 75 років. У пацієнтів віком від 65 років (50,0 %) спостерігалася вища частота побічних реакцій 3–4 ступеня тяжкості порівняно з пацієнтами віком до 65 років (42,7 %), що призводило до більшої кількості випадків припинення лікування через побічні реакції.
З 669 пацієнтів з декількома типами пухлин, які брали участь у клінічних дослідженнях застосування лікарського засобу Енхерту у дозі 6,4 мг/кг, 39,2 % були віком від 65 років, а 7,6 % — віком від 75 років. Частота побічних реакцій 3–4 ступеня тяжкості, що спостерігалися у пацієнтів віком від 65 років, становила 59,9 %, а в молодших пацієнтів – 62,9 %. Частота побічних реакцій 3–4 ступеня спостерігалася у пацієнтів віком 75 років – 64,7 % а у пацієнтів віком до 75 років – 61,5 %. У пацієнтів віком від 75 років спостерігалася більш висока частота серйозних побічних реакцій (37,3 %) та летальних наслідків (7,8 %) порівняно з пацієнтами віком до 75 років (20,7 % та 2,3 %). Наявна обмежена кількість даних щодо безпеки застосування для пацієнтів віком від 75 років.
Відмінності за етнічною ознакою
У клінічних дослідженнях не спостерігалося суттєвих відмінностей у дії чи ефективності цього лікарського засобу між пацієнтами різних етнічних груп. У пацієнтів азійського походження, які отримували лікарський засіб Енхерту у дозі 6,4 мг/кг, спостерігалася вища частота (різниця ≥ 10 %) нейтропенії (58,1 % у порівнянні з 18,6 %), анемії (51,1 % проти 32,4 %), лейкопенії (42,7 % у порівнянні з 6,9 %), тромбоцитопенії (40,5 % у порівнянні з 15,4 %) та лімфопенії (17,6 % у порівнянні з 7,3 %), ніж у пацієнтів інших етнічних груп. У 4,3 % пацієнтів азійського походження спостерігалися кровотечі протягом 14 днів після появи тромбоцитопенії порівняно з 1,6 % пацієнтів інших етнічних груп.
Повідомлення про побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності
48 місяців.
Пропонований термін придатності (після відновлення та розведення)
Відновлений розчин
Хімічна та фізична стабільність при застосуванні була продемонстрована упродовж 24 годин при температурі від 2 до 8 °C.
З мікробіологічної точки зору лікарський засіб слід використати негайно після відновлення вмісту флакона. Якщо він не був використаний негайно, відповідальність за тривалість та умови зберігання до початку використання та при застосуванні несе користувач. Якщо відновлення розчину не відбувалося у місці з контрольованими та валідованими асептичними умовами, час його зберігання зазвичай не має перевищувати 24 години при температурі від 2 до 8 °C.
Розведений розчин
Розведений розчин рекомендується використати негайно. Якщо він не був використаний негайно, відновлений розчин, розведений в інфузійних пакетах, із 5 % розчином глюкози, можна зберігати при кімнатній температурі (≤ 30 °C) протягом 4 годин або в холодильнику при температурі від 2 до 8 °C протягом 24 годин, у захищеному від дії світла місці. Зазначені терміни зберігання починаються з моменту відновлення розчину.
Умови зберігання
Зберігати у холодильнику при температурі від 2 до 8 °C.
Не заморожувати.
Зберігати у недоступному для дітей місці.
Несумісність
Дані щодо сумісності Енхерту з іншими лікарськими засобами відсутні, тому цей лікарський засіб не можна змішувати з іншими лікарськими засобами, за винятком тих, що зазначені в розділі «Спосіб застосування та дози».
Розчин натрію хлориду для інфузій не можна використовувати для приготування розчину або розведення, оскільки це може спричинити утворення твердих частинок.
Упаковка
Стерильний ліофілізований порошок для концентрату для розчину для інфузій для одноразового використання у скляному флаконі, закупореному гумовою пробкою з обжимною кришкою «flip-off crimp cap»; по 1 флакону в картонній коробці з маркуванням українською мовою.
Категорія відпуску
За рецептом.
Виробник
Виробник: Даічі Санкіо Юроп ГмбХ / Daiichi Sankyo Europe GmbH.
Місцезнаходження виробника та адреса місця провадження його діяльності
Виробник: Луітпольдштрассе 1, 85276 Пфаффенхофен, Німеччина / Luitpoldstrasse 1, 85276 Pfaffenhofen, Germany.
Заявник
АСТРАЗЕНЕКА ЮК ЛІМІТЕД / ASTRAZENECA UK LIMITED
Місцезнаходження заявника
1 Френсіс Крік Авеню, Кембридж Біомедікал Кампус, Кембридж, СВ2 0АА, Велика Британія / 1 Francis Crick Avenue, Cambridge Biomedical Campus, Cambridge, СВ2 0АА, United Kingdom.
